2-芳基吲哚类化合物的合成及杀菌活性测定
2023-11-11高青青李浩彤霍静蕾王彤萱霍静倩张金林
高青青,李浩彤,霍静蕾,王彤萱,王 凯,霍静倩,张金林
(河北农业大学 植物保护学院,河北 保定 071000)
在农业生产中,植物病原菌微生物制约农作物的生产安全[1],植物病原真菌严重影响农作物的产量和品质。杀菌剂的应用是控制由植物病原真菌引起的植物病害和保障农产品安全生产的重要手段,然而在生产中杀菌剂的不合理使用容易产生药害,且易导致植物病原菌对其产生抗药性[2]。近年来,随着杀菌剂的抗药性问题日益突出,发现具有新型结构骨架杀菌化合物和新型杀菌剂作用靶标具有重要意义。吲哚作为典型的杂环天然产物骨架之一,其在自然界中扮演重要的角色[3],凭借其活性高、种类多等特点在日常生活中应用广泛,例如在农药[4]、医药[5]、化工染料[6]等领域均有所研究。在医药领域,吲哚类化合物可以对肺癌具有抑制作用[7],而且对哮喘[8]、肥胖症[9]、心脑血管和神经系列疾病具有治疗作用[10],代表药物有吲哚美辛[11]、褪黑素[12]、利血平[13]等。同时,吲哚类化合物在农用化学品上也有应用,例如吲哚乙酸、吲哚丁酸作为植物生长调节剂被广泛应用于农作物生长及水果蔬菜的储藏[14]。吲哚-3-乙酸(植物生长素)[15]被认为是植物生长发育的主要激素之一。它可以调节植物体内的很多代谢过程,对植物的生长发育具有重要促进作用。此外,吲哚类化合物在除草活性方面具有优良的效果,开发了一系列新型吲哚-3-羧酸衍生物,并测定了其除草活性[16]。含有吲哚结构的天然产物芦竹碱具有很强的杂草抑制活性和抗植物病毒活性[17]。王雪莉等人[18]报道了双吲哚甲烷类化合物对植物病原菌如油菜菌核病菌和黄瓜灰霉病菌具有抑制作用,结果表明在质量浓度为10 μg/mL 条件下对油菜菌核病菌和黄瓜灰霉病菌的抑制率分别为61.1%和60.8%。然而目前还没有商品化的吲哚类杀菌剂,使得开发一种新型吲哚类杀菌剂成为可能。
本实验室前期开发了一种新型高效“一锅法”合成2-芳基吲哚的方法[19]。本试验在前期研究基础上,利用“一锅法”合成了6 个2-芳基吲哚类化合物3a-3f,并采用生长速率法[20]对所得化合物进行杀菌活性评价,将杀菌效果较好的化合物进一步进行活体试验,以期得到具有优良杀菌活性的化合物,为开发新型杀菌剂奠定基础。
1 材料与方法
1.1 材料
采用Bruker 500 进行核磁共振1H NMR 的测定,溶剂使用氘代氯仿(CDCl3)。利用Thermo Q Exactive Focus 进行化合物高分辨率质谱的测定;X-4双目显微熔点测定仪(河南巩义高科仪器有限责任公司)测定化合物的熔点。
所有化学反应均在干燥的手套箱内进行。无水环戊基甲醚(CPME) 购自J&K,未经进一步纯化直接使用。其他使用的试剂化学品购自安耐吉试剂公司、阿拉丁试剂公司或毕得医药,未经纯化直接使用。杀菌活性测定供试菌种为小麦赤霉病菌(F.g:Fusarium graminearum)、立枯丝核菌(R.s:Rhizoctonia solani)、禾谷丝核菌(R.c:Rhizoctonia cerealis)、茄子枯萎病菌(F.o:Fusarium oxysporum)、瓜果腐霉菌(P.a:Pythium aphanidermatum)、 玉米穗腐菌(F.v:Fusarium verticillioides)、黄瓜灰霉菌(B.c:Botrytis cinerea)、花生褐斑菌(C.a:Cercospora arachidicola)、苹果轮纹菌(P.p:Physalospora piricola)、番茄早疫菌(A.s:Alternaria solani)、油菜菌核菌(S.s:Sclerotinia sclerotiorum)均保存于河北农业大学植物保护学院农药系。供试黄瓜品种为:‘新泰密刺’。
1.2 合成方法
参考文献[19]的合成方法,制备目标化合物3a-3f,合成路线如图1 所示。首先进行化合物1a的合成,取100 mL 圆底烧瓶,称取苯酚1.68 g(18 mmol), 加入5 mL 的DMF, 称取4 g(30 mmol)K2CO3加入反应瓶中搅拌10 min,再加入2-氟溴苄2.85 g(15 mmol),再次加入15 mL DMF,55 ℃过夜搅拌。将反应液倒入分液漏斗,加入乙酸乙酯和大量饱和食盐水,振荡分层取有机相,如此重复3 次,收集有机相,用无水Na2SO4干燥,减压除去溶剂,将产物分离纯化,洗脱剂用纯石油醚,用1H NMR(500 MHz)和HRMS 进行结构表征。

图1 目标化合物的合成路线Fig.1 Synthesis route of the target compounds
化合物3a-3f 的合成:该反应在干燥的手套箱内进行,以化合物1a 合成为例,取1 个微波管,放入转子,称取100.4 mg(0.6 mmol)的LiN(SiMe3)2和60.8 mg(0.4 mmol) CsF,再量取1a 97.06 mg(0.48 mmol) 和2- 甲基苯甲醛24.03 mg(0.2 mmol),加入溶剂环戊基甲基醚CPME 1.0 mL,盖上塞子捏紧,从手套箱取出后110 ℃反应12 h,反应完毕后加2 滴水淬灭,再加入乙酸乙酯,得到的粗产物用100 ~200 目的硅胶进行分离纯化,洗脱液V(石油醚)∶V(乙酸乙酯)=50 ∶1,制备目标化合物3a-3f,并且均进行1H NMR (500 MHz)和HRMS 的结构表征。
1.3 离体杀菌活性的测定
采用生长速率法测定合成的6 种吲哚类衍生物对11 种植物病原菌的杀菌活性。具体操作如下:将每种测试化合物(20.0 mg)溶于适量的N,N-二甲基甲酰胺(0.1 mL),并用含有0.1%吐温80 的水定容至20.0 mL 制备成待测化合物溶液。向每个培养皿中加入1 mL 测试溶液和9 mL PDA 培养基,制成100 μg/mL 浓度的带药培养基,以不含药剂的无菌水为空白对照。三唑酮、苯醚甲环唑、吡唑醚菌酯、啶酰菌胺、氟唑菌酰胺和氰稀菌酯为阳性对照药剂。每个处理做3 次重复。把接种后的培养皿倒放在培养箱24 ℃内,72 h 之后用十字交叉法测定菌丝生长的直径,并按以下公式计算抑制率,采用 Duncan's新复极差法进行差异显著性比较。
对于初筛效果较好的目标化合物进行梯度稀释,每个目标化合物设置7 个浓度,以不含药剂的空白溶液作为空白对照,以苯醚甲环唑和吡唑醚菌酯作为阳性对照,每个处理设置3 个重复。按上述方法分别计算各药剂对应抑制率,使用SPSS 软件对药剂系列浓度与抑制率之间的关系进行线性回归分析,求出对应化合物的毒力回归方程、相关系数R2,求出每种化合物有效抑制中浓度(EC50值)。
1.4 温室盆栽法测定活体杀菌活性
选用对灰霉病易感的黄瓜品种‘新泰密刺’种子,消毒后将种子置于28 ℃培养箱中进行催芽,选择长势一致的露白的种子移植至塑料盆中生长,每盆种植1 株,每个处理设3 盆重复,待黄瓜长至三片叶时备用。称取待测化合物5 mg,溶于150 μL N,N-二甲基甲酰胺(DMF)中,加入吐温80 的蒸馏水定容至5 mL,制成1 000 μg/mL 浓度的母液。再用吐温80 水将农药母液稀释成100 μg/mL 的供试浓度,以不含药剂的吐温80 水为空白对照,以啶酰菌胺和苯醚甲环唑为阳性对照,使用手动按压喷雾瓶进行统一喷药处理,将各个化合物待测药液均匀喷洒至花盆中3 株三叶期的黄瓜叶片上,喷药后自然晾晒24 h 后,将培养好的供试菌落制成菌饼,将菌饼带菌面朝下接种于黄瓜叶片上,每个叶片接种1 个菌饼,做3 个重复。接种后在温室中培养,7 d 后调查结果,通过与空白对照病斑面积相比,计算出每个药剂浓度对病害控制百分比,以100 级代表无病,即抑制率100%;0 级代表最严重的发病程度,即抑制率为0。
2 结果与分析
2.1 目标化合物的合成
采用“一锅法”合成制备了6 个新型2-芳基吲哚类化合物,具体目标化合物的氢谱、高分辨质谱及物理性状结果如下:
化合物3a,黄色固体,产率55.8%, m.p.: 96 ~97 ℃;1H NMR (500 MHz, CDCl3) δ 8.19 (s, 1H),7.69 (d, J = 7.8 Hz, 1H), 7.54 - 7.48 (m, 1H), 7.44(d, J = 8.2 Hz, 1H), 7.36 - 7.30 (m, 3H), 7.24 (t, J= 7.3 Hz, 1H), 7.17 (t, J = 7.5 Hz, 1H), 6.65 (d, J =2.2 Hz, 1H), 2.54 (s, 3H).HRMS (ESI) [M+H]+calcd for C15H13N:207.1048,found:208.1120。
化合物3b,白色固体,产率86.8%, m.p.:82 ~83 ℃;1H NMR (500 MHz, CDCl3) δ 8.30 (s, 1H),7.62 (d, J = 7.8 Hz, 1H), 7.38 - 7.30 (m, 2H), 7.24- 7.19 (m, 2H), 7.18 (d, J = 2.3 Hz, 1H), 7.11 (t, J =7.4 Hz, 1H), 6.86 (dd, J = 8.2, 2.2 Hz, 1H), 6.81 (s,1H), 3.85 (s, 3H).HRMS (ESI)[M+H]+calcd for C15H13NO:223.0997,found:224.1068。
化合物3c,黄色固体,产率78.0%, m.p.:82 ~83 ℃;1H NMR (500 MHz, CDCl3) δ 9.67 (s, 1H),7.86 (d, J = 9.0 Hz, 1H), 7.65 (d, J = 7.8 Hz, 1H), 7.43(d, J = 8.1 Hz, 1H), 7.30 (t, J = 8.5 Hz, 1H), 7.19 (t, J= 7.2 Hz, 1H), 7.12 (t, J = 7.3 Hz, 1H), 7.10 - 7.02 (m,2H), 6.92 (s, 1H), 4.03 (s, 3H).HRMS (ESI)[M+H]+calcd for C15H13NO:223.0997,found:224.1068。
化合物3d,白色固体,产率54.3%, m.p.:88 ~89 ℃;1H NMR (500 MHz, CDCl3) δ 8.33 (s, 1H),7.87 (s, 1H), 7.80 (d, J = 6.5 Hz, 1H), 7.64 (d, J =7.9 Hz, 1H), 7.54 (d, J = 6.5 Hz, 2H), 7.40 (d, J = 2.9 Hz, 1H), 7.24 (t, J = 3.5 Hz, 1H), 7.14 (t, J = 7.4 Hz,1H), 6.89 (s, 1H).HRMS (ESI)[M+H]+calcd for C15H10F3N:261.0765,found:262.0836。
化合物3e,白色固体,产率86.6%, m.p.:91 ~92 ℃;1H NMR (500 MHz, CDCl3) δ 9.67 (s, 1H), 7.86(d, J = 7.8 Hz, 1H), 7.65 (d, J = 7.9 Hz, 1H), 7.43(d, J = 8.1 Hz, 1H), 7.33 - 7.27 (m, 1H), 7.19 (t, J =8.2 Hz, 1H), 7.15 - 7.02 (m, 3H), 6.92 (s, 1H), 4.03(s, 3H).HRMS (ESI)[M+H]+calcd for C15H13N:207.1048,found:208.1121。
化合物3f,白色固体,产率65.2%, m.p.:87 ~88 ℃;1H NMR (500 MHz, CDCl3) δ 8.33 (s, 1H),7.82 (d, J = 7.9 Hz, 1H), 7.71 - 7.65 (m, 2H), 7.62 (t,J = 7.5 Hz, 1H), 7.51 (t, J = 7.5 Hz, 1H), 7.43 (d, J =8.1 Hz, 1H), 7.29 - 7.22 (m, 2H), 7.17 (t, J = 7.5 Hz,1H), 6.72 (s, 1H).HRMS (ESI) [M+H]+calcd for C15H10F3N:261.0765,found:262.083。
表1 化合物3a-3f 的化学结构Table 1 The structure of target compounds 3a-3f
2.2 目标化合物离体杀菌活性测定结果
为了测定所合成化合物的杀菌生物活性,对目标分子的离体杀菌活性进行筛选研究。杀菌活性结果如表2 所示。在100 mg/L 浓度下,化合物3a 对立枯丝核菌的抑制率为80.3%,显著优于阳性对照药剂啶酰菌胺(P<0.05)。化合物3a 和3f 对禾谷丝核菌的抑制率分别为86.7%和79.6%,显著优于阳性对照药剂三唑酮、氰烯菌酯和啶酰菌胺(P<0.05)。化合物3a、3e 和3f 对黄瓜灰霉病的抑制率分别为84.7%、85.1%和87.8%,优于阳性对照药剂氰烯菌酯和啶酰菌胺(P<0.05)。为了进一步评估目标化合物的杀菌潜力,将化合物在100 mg/L浓度下,初筛结果较好的化合物3a、3e 和3f 进行了抑制中浓度EC50的测定,测定结果如表3 所示。化合物3a 对禾谷丝核菌表现优异的杀菌活性,EC50值为3.290 μg/mL,优于对照药剂吡唑醚菌酯(4.593 μg/mL)。化合物3a 和3f 对黄瓜灰霉病菌表现出较好的抑制活性,EC50值分别为7.408 和9.662 μg/mL,与对照药剂苯醚甲环唑(4.225 μg/mL)和吡唑醚菌酯(4.168 μg/mL)效果相当。

表2 化合物3a-3f 的杀菌活性(100 mg/L,菌丝生长速率法,抑制率%)Table 2 In vitro fungicidal activity of compounds 3a-3f (100 mg/L, growth rate method, inhibition rate%)
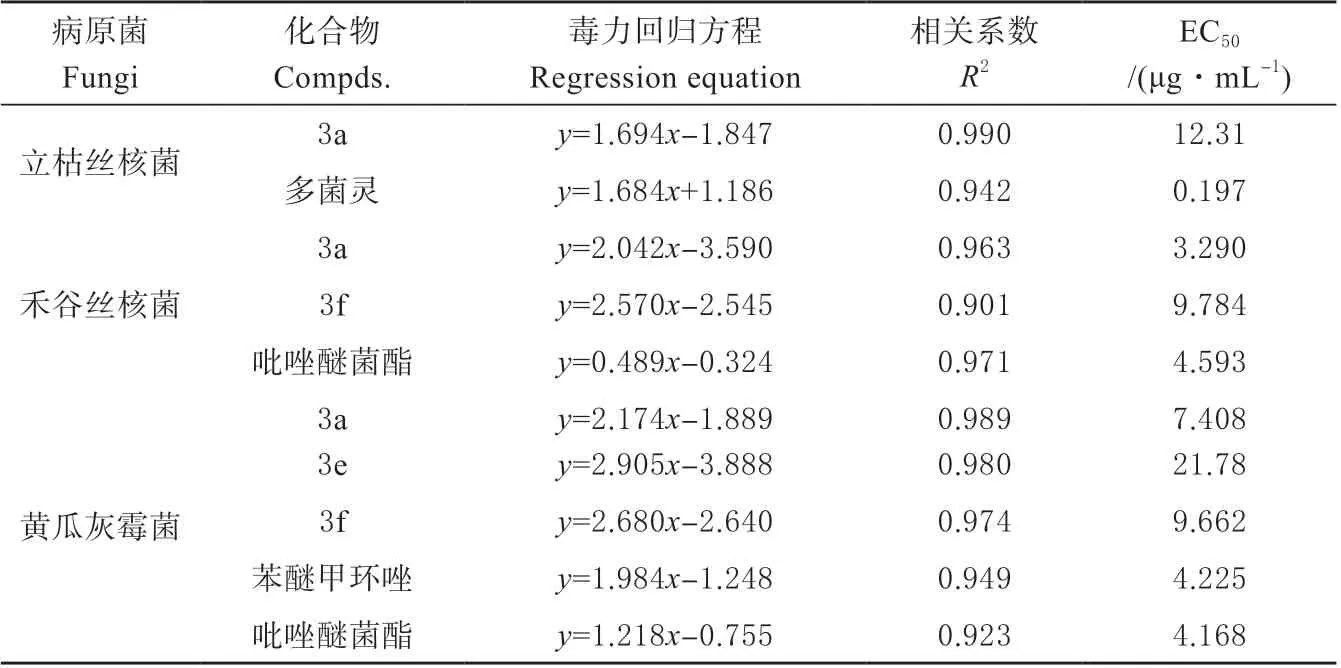
表3 目标化合物的EC50 测定结果Table 3 The EC50 values of target compounds
2.3 目标化合物活体杀菌活性测定
为进一步评价化合物的活体杀菌活性,选择化合物3a、3e 和3f,测定了其对黄瓜灰霉病的保护活性,结果如表4 所示:空白处理的黄瓜叶片感染严重,化合物3a 在100 μg/mL 时对黄瓜灰霉病表现出良好的保护活性,与啶酰菌胺和苯醚甲环唑效果相当,化合物3e 和3f 对黄瓜灰霉病也表现出较好的保护活性。上述结果表明,2-芳基吲哚类化合物具有良好的抗菌活性,其可以作为潜在的活性化合物骨架,为开发新型杀菌剂奠定基础。

表4 目标化合物对黄瓜灰霉病菌的活体保护活性Table 4 In vivo protective activity of target compounds against B.cinerea on cucumber
3 结论与讨论
目前有关吲哚类化合物的合成方法有很多,传统的Bischler[21]合成方法和Fischer[22]合成方法需要苛刻的反应条件,并且会用到危险性化学品肼。现在许多吲哚合成的方法用到过渡金属来作为催化剂提高反应效率[23-24],然而活性药物对微量重金属污染物含量具有限制,因此开发使用一种绿色环保的吲哚类化合物合成方法具有重要意义。此外,化合物合成方法简单、经济、安全、绿色环保是目前农药生产中最重要的考虑因素,同时也是高活性化合物能否实现产业化的关键所在,因此,基于绿色合成方法进行新农药的创制至关重要。本研究在前期试验的基础上以2-氟溴苄、苯酚、LiN(SiMe3)2和CsF 等商品化合物为原料,以环戊己甲基醚为溶剂,在反应温度为110 ℃的条件下,采用“一锅法”合成方法,设计并合成了6 个2-芳基吲哚类衍生物。该方法简化了反应操作过程,保证了反应的安全性,且容易规模化,避免了使用昂贵试剂和苛刻反应条件。
2-芳基吲哚是具有广泛生物活性的优越分子骨架[25],目前,有关2-芳基吲哚类化合物的杀菌活性鲜见报道。基于此,本研究选取了11 种农业生产中常见的植物病原真菌,对本研究中合成得到6 种2-芳基吲哚类化合物的进行了离体杀菌活性评价,并在初筛的基础上进行黄瓜灰霉病活体杀菌活性测定。杀菌活性结果显示,所合成的化合物表现出不同的杀菌活性,其中2-芳基吲哚类化合物中邻位取代基为-CH3时(化合物3a)的杀菌活性优于间位取代基-CH3(化合物3e),邻位取代基为-CF3时(化合物3f)的杀菌活性优于间位取代基-CF3(化合物3d),当取代基为-OCH3时的化合物杀菌活性均较低。综上所述,不同的取代基及取代基位置不同均会影响化合物的杀菌活性。活体杀菌活性测定结果显示,化合物3a 表现出与商品化杀菌剂相当的活性,其可以作为潜在的活性化合物或骨架,为进一步研究发现新的杀菌剂提供基础。本研究不仅为新型杀菌剂创新奠定基础,且对发现新型杀菌化合物作用靶标具有一定的推动作用。
