基于网络药理学和分子对接探究大黄-瓜蒌药对防治新型冠状病毒感染合并急性肺损伤的有效成分和分子靶点
2023-11-10齐卓操刘树森吴苏婉刘永铭刘家明龙子江杨爱东
齐卓操,刘树森,吴苏婉,谭 波,高 丹,汪 顺,刘永铭,刘家明,龙子江,杨爱东
(1.上海中医药大学中医学院,上海 201203;2.上海市重大传染病和生物安全研究院,上海 200032;3.哈尔滨商业大学药学院,黑龙江 哈尔滨 150076;4.上海中医药大学附属曙光医院,上海 201203;5.安徽中医药大学中西医结合学院,安徽 合肥 230012)
近3年来,新型冠状病毒感染(corona virus disease 2019,COVID-19)在全球各国迅速蔓延,影响巨大[1]。随着对COVID-19研究的深入,与原始毒株相比传播力更强、潜伏期更短及发病进程更快的变异毒株不断出现,COVID-19的防治难度日益增加[2]。在较严重病例中,感染可导致肺炎、肺部损伤以及急性呼吸综合征等病症[3]。急性肺损伤(acute lung injury,ALI)作为典型的COVID-19症状,具体表现为多种因素导致的肺细胞损伤。近年来,新发急性呼吸道病毒感染备受关注,其危害性主要是ALI导致的严重低氧血症。随着ALI的进展,肺泡的气体交换能力会随着肺部炎症介质的积累而不断下降,最终导致呼吸衰竭进而危害生命安全[4]。与其它致病因素相比,COVID-19引起的肺损伤初始临床症状包括更加严重的低氧血症和呼吸困难,以及影像学特征不明显的肺部损伤[5]。为防止COVID-19引起肺损伤及其它严重症状,寻找合适的药物和治疗方法防治COVID-19合并ALI成为临床迫切需要。
新版COVID-19防治指南阐明,中医药在COVID-19防治中的价值不可忽视,并对中医药防治策略进一步更新[6]。大黄-瓜蒌药对出自《温病条辨》[7]卷二,原方为宣白承气汤(瓜蒌皮、生大黄、苦杏仁、生石膏)。该方为COVID-19的经典名方和常用方[8],课题组前期研究亦提示,宣白承气汤对ALI具有保护和治疗作用[9]。在宣白承气汤经典方中生大黄泻热以通便,瓜蒌皮润肺而化痰,合用痰热可清。目前针对大黄-瓜蒌药对的临床和实验研究尚未被广泛重视。而网络药理学这种预测及研究方法已在中药相关研究中取得积极成效,其系统整体性和交叉关联性的特点与中医药理论中的整体观念、辨证论治的思想高度统一。因此,本研究运用网络药理学方法预测大黄-瓜蒌药对干预COVID-19合并ALI,以期为大黄-瓜蒌抗COVID-19或ALI的临床应用提供依据,为中药大黄-瓜蒌药对的研究开发提供新的思路和方法。
1 材料与方法
1.1 大黄-瓜蒌有效成分与靶基因筛选通过TCMSP数据库(https://old.tcmsp-e.com/tcmsp.php)检索大黄、瓜蒌的有效成分的理化性质和作用靶点信息,收录不完整的信息通过化学专业数据库(http://www.organchem.csdb.cn)进行补充。所有靶点信息均通过Uniprot数据库(https://www.uniprot.org/)获得标准化基因名称。
1.2 疾病相关基因筛选使用GeneCards数据库(https://www.genecards.org),设置物种为“Homo sapiens”,以 “Corona Virus Disease 2019”、“COVID-19”及“Acute Lung Injury”、“ALI” 作为关键词进行检索。同时,使用DrugBank数据库(https://go.drugbank.com/)和DisGeNET数据库(http://www.disgenet.org/)按照以上相同筛选条件检索。合并3个数据库的靶点数据,使用excel表格功能合并去重后,通过UniProt数据库获得标准化基因名称。
1.3 关键靶基因和关键有效成分筛选将大黄-瓜蒌药对相关靶基因和疾病相关靶基因导入在线韦恩图绘制网站Draw Venn Diagram(http://bioinformatics.psb.ugent.be/webtools/Venn/),通过取交集获得的共同靶点,被认为是大黄-瓜蒌药对防治COVID-19合并ALI的关键靶点。利用Cytoscape 3.9.1软件构建“药对-有效成分-靶点”网络,并根据degree值筛选出前4名的化合物作为关键有效成分,通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得二维结构数据。
1.4 PPI构建及核心靶点筛选在STRING数据库(https://string-db.org/)中添加关键靶点,并设置物种为“Homo sapiens”,最低相互作用阈值为0.4,其他参数为默认值[10],最终获得PPI网络。利用Cytoscape 3.9.1软件中的CytoHubba插件对PPI网络进行可视化,然后根据degree值大小筛选核心靶点[10]。
1.5 GO与KEGG富集分析在DAVID数据库(https://david.ncifcrf.gov/)录入筛选的关键靶点,设置物种为“Homo sapiens”、P<0.05为筛选条件,以P值进行排序[10]。GO功能分析分类如下:生物过程(biological process,BP)、细胞成分(cellular component,CC)、分子功能(molecular function,MF)[10],采用气泡图、弦图分别对排序前10个GO条目及KEGG通路进行可视化。利用Cytoscape 3.9.1软件(ClueGO插件)进行富集网络分析。
1.6 分子对接验证从PDB数据库(https://www.rcsb.org/)和Uniprot数据库(http://www.uniprot.org/)下载核心靶点的高解析精度(<2.50 Å)的蛋白质三维结构数据,将筛选的关键成分和核心靶点信息输入AutoDock Vina(The Scripps Research Institute,Molecular Biology,CA,USA)软件,进行分子对接,结合能负值越大,对接构象越稳定,自发结合能力越强。
2 结果
2.1 大黄-瓜蒌药对有效成分及相关靶基因的预测通过TCMSP数据库检索,分别获得大黄成分44个,瓜蒌成分56个。将大黄、瓜蒌靶点信息核对、合并、去重后,输入Uniprot数据库,校正并标准化所得到的基因名,最终得到300个潜在的大黄-瓜蒌药对靶基因。
2.2 疾病相关靶基因的预测在GeneCards、OMIM及DrugBank数据库中检索COVID-19与ALI的相关基因,核对、去除重复基因,最终筛选出COVID-19与ALI相关靶点。将靶点信息输入Uniprot数据库,对基因名标准化,得到COVID-19相关靶基因1 502个,ALI相关靶基因4 359个。
2.3 关键靶基因和关键有效成分筛选采用大黄-瓜蒌药对靶基因、COVID-19与ALI相关靶基因绘制Venn图,获得32个共同靶点(即关键靶点)(Fig 1)。构建的“药对-有效成分-靶点”网络图,一共具有53个节点和63条边,即大黄-瓜蒌药对中有19个关键有效成分作用于32个关键靶点(Tab 1和Fig 2)。其中degree值排名前4位的成分依次为油酸(oleic acid)、小麦黄素(tricin)、芦荟大黄素(aloe-emodin)、D-乳酸(D(-)-lactic acid,DLA),被认为可能是大黄-瓜蒌药对发挥防治COVID-19合并ALI的关键有效成分。

Fig 1 Venn diagrams integrating key targets of Dahuang-Gualou,COVID-19 and ALI

Tab 1 Chemical information for active compounds of Dahuang-Gualou medicine pair
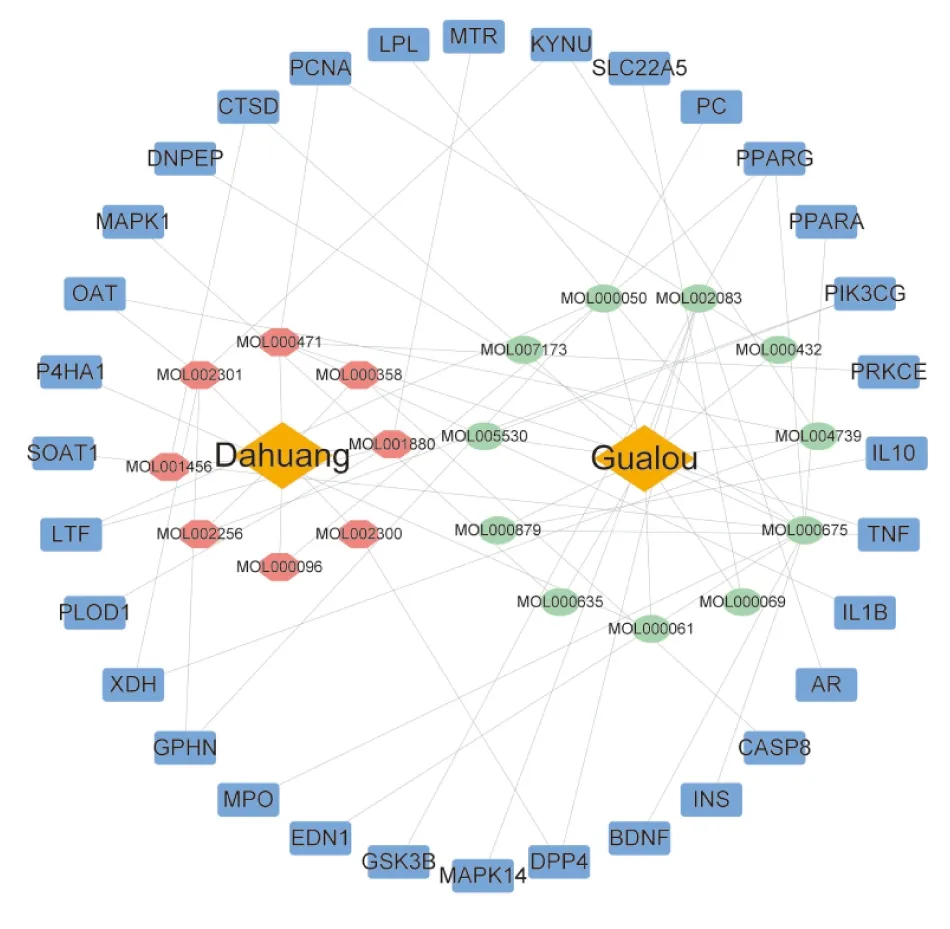
Fig 2 The “medicine pair-active component-target” network
2.4 构建PPI网络分析采用32个共同靶点构建的PPI网络图一共具有23个节点和99条边(Fig 3)。PPI网络图中靶点颜色深浅与其代表的大黄-瓜蒌药对靶点的degree值正相关,颜色越深,degree值越大。Degree值排序前10位的核心基因分别为:INS、TNF、IL-1β、PPARG、MAPK1、PPARA、MAPK14、IL10、GSK3B、CASP8。它们是大黄-瓜蒌药对治疗COVID-19合并ALI的潜在核心靶点。

Fig 3 PPI network of common targets
2.5 关键靶点基因功能及富集分析采用DAVID在线工具对关键靶点进行基因功能分析、通路富集分析[10],共获得显著富集的136个GO条目(P<0.05),其中生物过程105项,包括基因表达的负调控等;细胞成分11项,包括细胞外区等;分子功能20项,包括蛋白质结合等(Fig 4)。KEGG弦图提示,COVID-19合并ALI相关的通路(Fig 5)。

Fig 4 Bubble diagrams of GO enrichment
2.6 分子对接验证采用分子对接技术对大黄-瓜蒌药对的关键成分(油酸、小麦黄素、芦荟大黄素、D-乳酸)与核心靶点(INS、TNF、IL-1β、PPARG、MAPK1、PPARA、MAPK14、IL10、GSK3B、CASP8)的结合情况进行验证。如Fig 6所示,小麦黄素、芦荟大黄素与核心靶点亲和力较好,能自发结合。在最佳模式下,小麦黄素与INS、TNF、IL-1β的结合能分别为-7.6、-8.6、-7.7 kcal·mol-1,而芦荟大黄素与INS、TNF、IL-1β的结合能分别为-7.9、-8.9、-8.6 kcal·mol-1(Tab 2)。
3 讨论
本研究采用TCMSP数据库检索获得“大黄-瓜蒌”药对100个有效成分及靶基因,其中大黄成分44个,瓜蒌成分56个。另外,从GeneCards、DisGeNET、DrugBank数据库中筛选与COVID-19、ALI相关的潜在靶点,通过“药对-有效成分-靶点”网络和PPI分析,得到关键有效成分19个及关键靶点32个。依据degree值排序,关键成分包括黄酮类和蒽醌类成分,核心靶点(10个)多为蛋白激酶、促炎细胞因子等。同时,获得“大黄-瓜蒌”药对的关键靶点在136个GO条目和57条KEGG通路中(P<0.05)显著富集,其中抗病毒、抗炎机制为本研究主要相关的功能与通路,如IL-17信号通路、T细胞受体信号通路等。最后,分子对接研究也表明,大黄-瓜蒌药对的关键有效成分小麦黄素和芦荟大黄素可以与疾病相关核心靶点(INS、TNF、IL-1β)自发结合。

Fig 5 KEGG chord graph

Tab 2 The binding affinities of active compounds of Dahuang-Gualou medicine pair and clinical treatment drugs with core targets
小麦黄素和芦荟大黄素分别属于黄酮类和蒽醌类化合物。如黄酮类化合物具有抗病毒、抗炎作用,可通过调节p38MAPK或NF-κB炎症通路,有效减轻LPS诱导的ALI炎症反应[11]。而芦荟大黄素、大黄酸与大黄素等大黄蒽醌类化合物也可抑制LPS引起的ALI细胞模型,其作用机制主要为炎症通路等[12]。其中芦荟大黄素与蒽醌类化合物结合受体的结合力强于大黄酸和大黄素,表现出更强的抗炎能力,这一特性与芦荟大黄素分子结构的疏水作用更强有关[12]。由此提示,以小麦黄素和芦荟大黄素为代表的黄酮类和蒽醌类化合物可能是大黄-瓜蒌药对发挥抗病毒、调节肺部急性炎症、抗ALI作用的关键作用物质基础。
PPI网络图排序靠前的靶点,即INS、TNF、IL-1β、PPARG、MAPK1、PPARA、MAPK14、IL-10、GSK3B与CASP8,可能是大黄-瓜蒌药对治疗目的疾病的核心靶点。已有研究表明,COVID-19患者有明显的淋巴细胞减少和中性粒细胞增加,在幸存的重症COVID-19患者中出现了T细胞计数逐渐恢复,促炎细胞因子(IL-10与IL-17等)升高的情况[13]。由此可知,在COVID-19病程发展阶段会引发免疫反应,调节免疫将成为将治疗COVID-19重要方向。MAPK1、MAPK14等是治疗COVID-19的关键靶标,参与炎症转化等相关过程[14]。
GO分析结果提示,大黄-瓜蒌药对在基因表达的负调控、细胞外区及蛋白质结合等方面具有突出作用。同时,KEGG通路富集结果提示,大黄-瓜蒌药对的抗病毒、抗炎作用与IL-17信号通路、T细胞受体信号通路等相关。其中,6个靶点与IL-17信号通路相关,分别为GSK3B、CASP8、IL-1β、MAPK1、MAPK14与TNF。5个靶点与T细胞受体信号通路相关,分别为IL10、GSK3B、MAPK1、MAPK14、TNF。IL-17是由CD4+T细胞分泌的一种促炎因子,其能够诱导上皮细胞、内皮细胞、成纤维细胞合成分泌免疫及炎症因子(包括多种白介素)。IL-17信号通路可激活MAPK途径中的抗细胞因子和趋化因子,从而影响机体的免疫反应[14]。T细胞受体信号通路在T细胞活化、T细胞亚群分化以及效应T细胞功能等过程中至关重要,是经典的炎症通路之一[14]。这表明大黄-瓜蒌药对可以通过这些靶点作用于显著富集的通路,在目的疾病的治疗中发挥重要价值。
综上所述,本研究结果提示“大黄-瓜蒌”药对防治COVID-19合并ALI的治疗作用机制可能与以小麦黄素和芦荟大黄素为代表的黄酮类和蒽醌类成分结合核心靶点(INS、TNF、IL-1β等),从而调控病毒、炎症相关信号通路和生物学过程。由于“大黄-瓜蒌”药对的新成分和新靶点仍在不断被报道,扩展数据分析范围并完善计算机算法显得尤为重要。本研究初步揭示了大黄-瓜蒌药对防治COVID-19合并ALI的有效成分与潜在靶点,下一步将通过高效液相色谱等实验鉴定有效成分,开展药理实验验证核心靶点与关键通路,以期指导临床应用。
