桦褐孔菌提取物介导LXRs信号通路调控肝纤维化
2023-11-10刘赛虎窦佳艺崔振宇廉丽花南极星吴艳玲
刘赛虎,窦佳艺,崔振宇,廉丽花,南极星,吴艳玲
(延边大学药学院,长白山天然药物研究教育部重点实验室,吉林 延吉 133002)
肝纤维化是由慢性肝损伤所致的可逆性病理改变,是发展成肝硬化甚至肝癌的一个必经阶段[1]。肝星状细胞(hepatic stellate cells,HSCs)的活化是肝纤维化发展过程中的标志现象[2]。在健康肝脏中,HSCs主要产生IV型胶原,构成正常肝脏的胶原特征。随着持续性刺激损伤,HSCs转化为肌成纤维细胞,表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),产生大量胶原蛋白,如I型胶原(type Ⅰ collagen,collagen Ⅰ)以及纤维化肝脏特征的其他细胞外基质(extracellular matrix,ECM)成分[3]。ECM的降解与合成分别受基质金属蛋白酶(matrix metalloproteinases,MMPs)和组织基质金属蛋白酶抑制剂(tissue inhibitor of matrix metalloproteinases,TIMPs)调控,其比值是评价细胞外基质代谢动态平衡的关键[4]。此外,炎症反应也是肝纤维化发展的核心因素之一。当肝脏暴露于各种危险信号时,炎症小体会诱导促炎因子的分泌,如白介素-1β(interleukin-1β,IL-1β),半胱天冬氨酸蛋白酶1(cysteinyl aspartate specific proteinase-1,Caspase-1)和白介素-6(interleukin-6,IL-6)等,从而启动并延续异常的伤口愈合反应[5]。因此,抑制HSCs的激活和炎症反应可以作为预防和改善肝纤维化的重要策略。肝X受体(liver X receptors,LXRs)在脂质代谢的转录控制中起着核心作用,其激活会调节一系列参与胆固醇吸收、流出、运输和排泄的基因表达[6]。本课题组前期研究发现,LXRs也参与了肝脏炎症和纤维化的调节,为肝脏疾病的防治提供了新的潜在靶点[7]。桦褐孔菌(Inonotusobliquus)是多孔菌科,纤孔菌属的一种药食两用真菌,传统用于预防和治疗糖尿病、胃肠道疾病及肿瘤等[8]。研究发现,桦褐孔菌的多糖组分能够改善弓形虫感染的小鼠肝损伤,另外对高脂饮食诱导的大鼠脂质紊乱起到保护作用[9-10]。此外,总三萜类化合物可以明显减轻对乙酰氨基酚引起的急性肝损伤,对肝脏及其功能有一定的保护作用[11]。我们前期研究初步证明了桦褐孔菌乙醇提取物(Inonotusobliquusextract,IOE)的肝保护作用,但其对肝纤维化的改善作用和作用机制尚不明确[12]。目前,临床上尚缺乏确实有效的肝纤维化治疗药物。因此,本研究通过围绕IOE对HSCs的活化、ECM沉积和炎症因子分泌的影响,讨论其对肝脏的调控作用是否通过潜在的LXRs信号通路介导,从而探究其抗肝纤维化的潜力,为开发新型、有效的肝纤维化的治疗药物提供科学依据。
1 材料与方法
1.1 药材与试剂桦褐孔菌采摘自黑龙江省伊春市林区;Silymarin(SIGMA,S0417);硫代乙酰胺(thioacetamide,TAA)(aladdin,T118452);MTT(Solarbio,M8180);ECL发光试剂盒(Tanon,180-5001);ALT(A001),AST(A002)(长春汇力);DMEM(C11965500 BT);胎牛血清(900-108);总RNA提取试剂盒(上海普洛麦格生物产品公司);Fasting一步法除基因组cDNA第一链合成预混试剂(TIANGEN);庆大霉素(Macklin,G6064)、噻孢霉素(biotopped);TGF-β(PeproTech);即用型快捷免疫组化MAXVision2HRP试剂盒(鼠/兔)(迈新生物技术,KIT-5920);Anti-α-SMA(bs-0189R);Anti-collagen I(bs-0578R);Anti-MMP13(ab75606);Anti-TIMP1(ab61224);Anti-IL-6(sc-57315);Anti-LXRα/β(sc-377260)。
1.2 实验动物饲养雄性,C57BL/6小鼠,体质量(20±5)g,购于延边大学动物实验中心 [动物许可证: SYXK(吉)2020-0010]。小鼠饲养环境温度为(22±2) ℃,相对湿度保持在50%~60%,给予正常标准化饲料,分笼饲养,自由饮水,实行每12 h光暗循环光照。本实验沿用前期研究IOE给药剂量,分别为100、300和500 mg·kg-1[12]。小鼠适应1周后,随机分为7组,每组7只:正常组、TAA组、TAA+IOE低中高剂量组(100、300和500 mg·kg-1)、IOE单独给药组(500 mg·kg-1)以及TAA+水飞蓟素(silymarin,100 mg·kg-1)阳性对照组。小鼠肝纤维化模型的建立:第1周,腹腔注射TAA溶液(100 mg·kg-1),一周2次;从第2~4周增加至200 mg·kg-1,一周3次,连续4周。同时,第2~4周,除正常组和TAA组外,其余各组小鼠每天灌胃给予IOE(100、300和500 mg·kg-1)和Silymarin(100 mg·kg-1)。至最后一次腹腔注射TAA 24 h后,对小鼠进行安乐死,收集血液和肝组织,部分肝组织浸泡在10%福尔马林液中,用于后续组织病理学检查;其余肝脏样本保存在-80 ℃中备用。
1.3 仪器净化工作台(上海新范医疗器械有限公司);水平摇床、二氧化碳培养箱(Thermo scientific);迷你双垂直电泳仪、凝胶成像分析仪(Bio-Rad);PCR扩增仪(Eppendorf);酶标仪(Bio Tek);石蜡切片机(德国徕卡公司);电子天平(奥豪斯仪器有限公司);BX53F荧光显微镜(Olympus)。
1.4 IOE的制备本实验采用乙醇热回流提取IOE。取桦褐孔菌菌核,置于干燥研钵中研磨成芝麻颗粒大小粉末。在50 ℃下干燥至恒重,称取粉末50 g,以料液比1 ∶10加入体积分数为50%的乙醇溶液,浸泡24 h。在50 ℃温度下提取1 h,收集滤液,药渣重复上述步骤2次。合并3次滤液置于旋转蒸发仪中,进行减压浓缩得到浸膏。在真空条件下冷冻干燥成粉末,即为IOE,4 ℃保存。
1.5 血清生化指标检测小鼠取血后静置30 min,4 ℃离心得到血清。按照试剂盒说明书检测小鼠血清中AST和ALT的水平。
1.6 小鼠肝脏组织病理学检查小鼠肝脏组织固定于体积分数为10%的福尔马林溶液。取出肝脏组织,流水冲洗过夜,乙醇梯度脱水,石蜡包埋,肝脏组织5 μm切片,经苏木精-伊红(HE)染色、天狼猩红染色和α-SMA免疫组织化学染色后观察肝脏组织病理学改变。
1.7 细胞培养大鼠HSCs为韩国生命工学研究院(韩国大田)Jung Joon Lee博士慷慨相赠。从-80 ℃超低温冰箱中取出HSCs种子,在37 ℃水浴环境下快速解冻,待将要完全融化时,将细胞悬液缓慢加入到含有10%胎牛血清、100 U·L-1庆大霉素/噻孢霉素的DMEM培养基中,在37 ℃、5% CO2的细胞培养箱中进行传代培养,细胞状态良好进行后续实验。
1.8 MTT取对数生长期HSCs,以1×104个/孔的细胞密度接种于96孔板中。设置不同浓度IOE给药组(0~25 mg·L-1),每组6个复孔。孵育24 h后,向每孔中加入100 μL MTT溶液(5 g·L-1)。3 h后吸出孔内MTT溶液,加入100 μL DMSO,室温摇匀至紫色晶体完全溶解。使用酶标仪在570 nm处测定吸光度值,计算细胞存活率。
1.9 细胞实验方案HSCs接种于6孔板,培养24 h后,给予转化生长因子-β(transforming growth factor-β, TGF-β)10 μg·L-1刺激2 h。随后,孵育IOE 6 h后收集各分组细胞,提取蛋白。
1.10 Western blot实验采用RIPA裂解液提取肝脏组织和HSCs蛋白,BCA法测定蛋白浓度。制备等量的蛋白样品进行Western blot检测,以GAPDH为内参,分析蛋白相对含量。
1.11 RT-PCR按照上海普洛麦格总RNA提取试剂盒的说明书进行细胞组织的总RNA提取,并测定其含量后制备cDNA,取反转录产物进行RT-PCR。以GAPDH为内参,检测每个样品mRNA的相对表达。引物序列见Tab 1。

2 结果
2.1 IOE对TAA诱导小鼠血清生化指标和肝组织形态学改变的影响ALT和AST的酶活性反映体内肝脏损伤程度。如Fig 1A、B所示,与正常组相比,TAA组小鼠血清ALT和AST水平升高(P<0.01),而IOE可以呈剂量依赖性地降低血清ALT和AST水平(P<0.01),并且效果与Silymarin阳性对照组相比无差异。通过HE和天狼猩红染色观察小鼠肝脏组织病理学改变。结果如Fig 1C,D所示,正常组肝细胞形态正常,肝小叶排列整齐,以中央静脉为中心呈放射状排列,而TAA组中央静脉区域周围出现大量炎性细胞浸润,肝细胞肿胀,红色胶原纤维沉积,发生交联增生。给予不同浓度IOE后,中央静脉区附近炎性细胞明显减少,红色胶原纤维沉积明显减少,肝组织病理学改变得到改善,并且效果与阳性对照药物Silymarin相似。
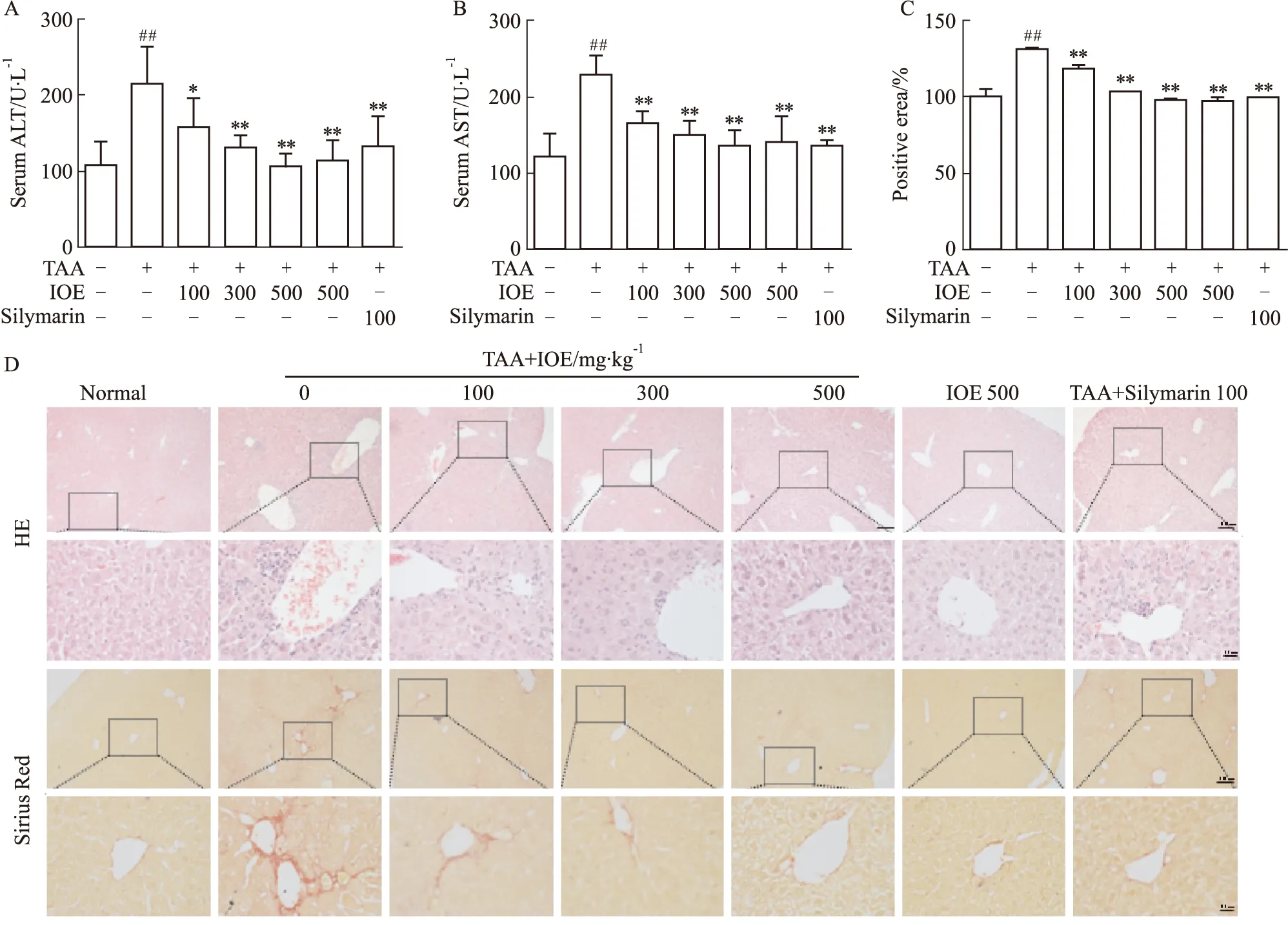
Fig 1 Effects of IOE on serum transaminases and liver histomorphological changes induced by TAA in mice n=6)

Tab 1 The primer sequences for RT-PCR
以上结果说明,IOE可以有效抑制TAA诱导小鼠血清生化指标的升高,并改善其肝组织病理特征。
2.2 IOE减少TAA诱导的小鼠肝脏ECM和胶原的沉积如Fig 2A所示,与正常组相比,TAA组小鼠肝脏α-SMA和collagen Ⅰ的蛋白表达和TIMP-1/MMP13的相对比率明显升高(P<0.01),然而IOE处理可以明显下调α-SMA和collagen Ⅰ蛋白表达和TIMP-1/MMP13的蛋白比,并呈剂量依赖性(P<0.01)。同时,α-SMA的免疫组化实验也印证了上述实验结果。如Fig 2B所示,与正常组相比,TAA模型组小鼠肝脏组织中观察到明显α-SMA棕色阳性表达,而IOE给药组和Silymarin阳性对照组小鼠肝脏组织中α-SMA棕色阳性表达明显减少。
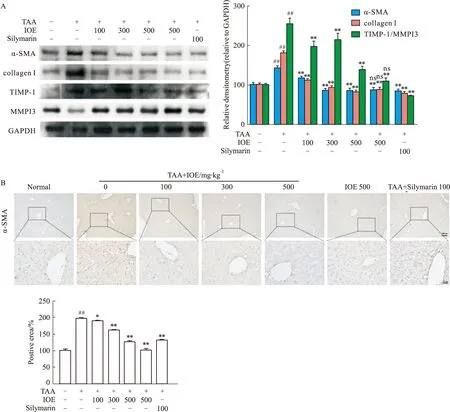
Fig 2 IOE reduced TAA-induced ECM and collagen deposition
以上结果表明,IOE能够减少TAA诱导的小鼠肝脏中ECM和胶原的沉积,改善肝纤维化。
2.3 IOE对TAA诱导的小鼠炎症因子及LXRα/β信号通路表达的影响如Fig 3A所示,与正常组相比,TAA组小鼠炎症因子IL-6的蛋白表达明显升高(P<0.01),而IOE处理可以呈剂量依赖性地降低IL-6的蛋白表达(P<0.01)。同时,如Fig 3A所示,与正常组相比,TAA组小鼠LXRα/β的蛋白表达明显降低(P<0.01),而IOE可以呈剂量依赖的方式上调LXRα/β的蛋白表达(P<0.01),且中剂量(300 mg·kg-1)和高剂量(500 mg·kg-1)的效果与Silymarin阳性对照组相似。

Fig 3 Effects of IOE on expression of IL-6 and LXRα/β in TAA-induced mice n=6)
以上结果表明,IOE可以抑制肝纤维化过程中炎症因子的分泌,更重要的是,IOE可以激活LXRα/β信号通路,调节肝纤维化。
2.4 IOE对HSCs存活率及活化HSCs中ECM沉积的影响如Fig 4A所示,IOE(0.5~2.5 mg·L-1)在24 h内对HSCs的细胞活力没有影响,在5~25 mg·L-1剂量时对HSCs的细胞活力有轻微影响。 如Fig 4B所示,TGF-β刺激明显增加了collagen Ⅰ的蛋白表达(P<0.01),而给予不同浓度IOE(5~25 mg·L-1)孵育6 h发现,IOE可以明显降低α-SMA、collagen Ⅰ和TIMP-1/MMP13的蛋白比(P<0.01)。同时,RT-PCR实验也印证了上述实验结果。如Fig 4C所示,TGF-β刺激明显升高了α-SMA、collagen Ⅰ和TIMP-1的mRNA水平(P<0.01),而给予不同浓度IOE(5~25 mg·L-1)孵育6 h发现,IOE可以明显降低他们的mRNA水平(P<0.01)。
以上结果说明,IOE能够调控活化的HSCs中ECM的合成与降解动态平衡,防止ECM和胶原蛋白过度沉积。
2.5 IOE对活化HSCs中炎症因子及LXRα/β信号通路表达的影响如Fig 5A所示,TGF-β刺激明显增加了Caspase-1的mRNA水平(P<0.01),而给予不同浓度IOE(5~25 mg·L-1)孵育6 h发现,IOE可以明显降低Caspase-1表达(P<0.01)。同时,如Fig 5A所示,TGF-β刺激明显降低了活化HSCs中IL-6和LXRα/β的蛋白表达(P<0.01),给予不同浓度IOE(5-25 mg·L-1)孵育6 h发现,IOE可以降低IL-6的蛋白表达,并能呈剂量依赖性升高LXRα/β的蛋白表达(P<0.01)。在Fig 5B细胞荧光双染实验结果也可以发现,与正常组相比,TGF-β刺激的HSCs中LXRα/β(绿色)荧光表达明显降低,IL-6(红色)荧光表达明显升高。给予不同浓度IOE后,可呈剂量依赖性升高LXRα/β(绿色)荧光表达并减少IL-6(红色)荧光表达。
以上结果说明,IOE能够抑制活化HSCs中炎症因子的分泌,并激活LXRα/β信号通路。
3 讨论
肝纤维化是一种可逆的慢性肝损伤疾病,病毒性肝炎、代谢疾病、长期酗酒、非酒精性脂肪肝以及非酒精性脂肪性肝炎都可能诱发肝纤维化[13]。HSCs的活化推动肝纤维化的发展,其静止状态时主要功能为吸收和储存维生素A。当肝脏受损时,HSCs被激活转变为肌成纤维细胞,造成ECM过度沉积并伴随炎症反应发生[3]。因此,抑制HSCs的活化对于肝纤维化的预防和治疗具有重大意义。本课题组前期研究表明,桦褐孔菌乙醇提取物可以降低CCl4诱导的小鼠血清中ALT和AST的升高,提示其具有肝保护功能[12]。因此,本研究通过围绕调控ECM沉积、抑制HSCs活化和炎症反应,在体内外模拟建立肝纤维化微环境,发现IOE可以介导激活LXRs信号通路,从而调控肝纤维化的进程。

Fig 4 Effects of IOE on survival rate of HSCs and ECM deposition in n=6)
肝纤维化伴随着结缔组织过度沉积,其机制是HSCs被激活转化为肌成纤维细胞释放ECM,例如α-SMA和collagen Ⅰ是纤维化的主要标志物。此外,ECM的合成与降解处于一种动态平衡的状态,依赖于TIMPs及MMPs。MMPs可以降解ECM,而TIMPs可以与MMPs结合,从而抑制ECM降解,导致ECM的合成与沉积增加[4]。本研究发现,与正常组相比,TAA诱导的小鼠体内和TGF-β激活的HSCs中,α-SMA、collagen Ⅰ和TIMP-1的蛋白表达明显上升,MMP13的蛋白表达明显降低,提示发生ECM沉积,破坏ECM合成与降解平衡。IOE可以明显降低α-SMA、collagen Ⅰ的蛋白表达,恢复TIMP-1与MMP13之间的动态平衡。这说明IOE可减少ECM沉积,维持其合成与降解的动态平衡,从而发挥改善肝纤维化的作用。
肝纤维化的发生和发展中,炎症和先天免疫系统的激活会导致HSCs激活。在肝损伤的早期阶段,细胞死亡引发的炎症有助于细胞碎片的清除,促进肝再生,确保急性肝损伤后肝结构和功能的恢复。然而,一旦刺激持续产生,就会诱发慢性炎症和进行性肝纤维化[14]。研究发现,炎症细胞因子如IL-1β、TNF-α等趋化因子以及TLR通路也参与肝纤维化的调控,在肝纤维化的进展中也起着重要作用[15]。本研究发现,与正常组相比,TAA诱导的小鼠体内和TGF-β激活的HSCs中,炎症因子如IL-6和Caspase-1表达明显升高,而给予IOE后炎症因子表达明显降低。以上结果提示,IOE可以抑制肝纤维化过程中的炎症反应,或许是其改善肝纤维化的另一重要策略。
LXRs是参与调控肝脏疾病的重要靶点。有研究表明,LXR-/-动物暴露于四氯化碳或蛋氨酸胆碱缺乏的饮食中会导致α-SMA和胶原比例面积增加,与野生型小鼠相比肝纤维化加剧。同时,LXR-/-星状细胞表现出纤维化基因的表达被启动激活,炎症介质水平增加[16]。这表明LXR配体在抑制肝星状细胞活化标志物和小鼠肝纤维化中起关键作用。如预期相同,LXRs可以调节ECM沉积和肝脏炎症反应[17]。本研究发现,与正常组相比,TAA诱导的小鼠体内和TGF-β激活的HSCs中LXRα/β的蛋白表达明显降低,而给予IOE可以明显升高LXRα/β的蛋白表达。由此可以说明,IOE可能是通过激活LXRα/β缓解肝纤维化发生时的ECM沉积和炎症反应,从而逆转其发生与发展。
综上所述,IOE改善TAA诱导的血清转氨酶升高、肝脏组织病理学变化,抑制ECM沉积和炎症反应,并激活LXRα/β受体,改善小鼠肝纤维化发生发展。同时,IOE也可以减少活化HSCs中ECM沉积和炎症因子分泌,激活LXRα/β信号通路,从而抑制HSCs活化。
