甲氨蝶呤对小鼠实验性干燥综合征的影响
2023-11-10杨雅琪
杨雅琪,靳 伟,罗 琼,徐 强
(南京大学生命科学学院,医药生物技术国家重点实验室,江苏 南京 210023)
干燥综合征(Sjogren’s syndrome, SS)是一种慢性自身免疫性疾病,其特征是由泪腺和唾液腺功能障碍引起的眼和口干燥,常表现出广泛的临床表现和分散的并发症,导致患者出现抑郁、疲劳、疼痛等症状,严重影响日常生活质量。此外,大约5%的SS患者会发展为低级别B细胞非霍奇金淋巴瘤,尤其是黏膜相关淋巴组织(mucosa-assaciated lymphoid tissue, MALT)淋巴瘤。迄今为止,人们普遍认为一些遗传多态性[1-2]、病毒侵染和免疫系统失调是诱发SS的重要原因。其机制包括干扰素(IFN-β)途径的激活[3],B淋巴细胞的持续活化[4]以及Th1和Th17细胞的增殖[5]等。目前,全球范围内尚无根治SS的方法,也没有获得该疾病适应症的药物。英国风湿病学会和欧洲抗风湿病联盟发布的SS患者管理指南都旨在通过局部治疗缓解外分泌腺体症状,未提供具体的治疗目标[6-7]。因此,寻找低毒、高效的治疗SS的药物是当前领域的热点之一。
甲氨蝶呤(methotrexate, MTX)是一种抑制二氢叶酸还原酶的抗代谢类有机化合物,主要用于类风湿关节炎、银屑病等自身免疫性疾病和抗肿瘤的治疗,具有强大的疗效和耐受性[8]。体外研究表明,MTX可以通过多种途径如增加胞外腺苷的积累与抗炎腺苷的结合[9];产生活性氧诱导转化T细胞凋亡[10];抑制NF-κB[11]、JAK-STAT[12]炎症信号通路和细胞因子的产生等调节机体免疫炎症反应。然而,其对同样是自身免疫性疾病的SS是否有效还未知。本研究旨在探讨MTX对实验性干燥综合征(experimental Sjogren’s syndrome, ESS)的治疗效果并初步探讨其机理,从而在短时间内寻找到治疗SS全身性炎症反应的候选药物。
1 材料
1.1 实验动物健康C57BL/6J雌性小鼠,体质量(18~20) g,6~8周龄,SPF级,购于北京维通利华实验动物技术有限公司,生产许可证号:SCXK(苏)2016-0003,饲养于南京大学生命科学学院动物实验室,在(21 ± 2)℃、自由取食、自由饮水和12 h昼夜交替的SPF级条件下饲养。所有动物实验均在南京大学实验动物委员会的批准下进行,且实验方法符合动物实验的相关指南。
1.2 试剂MTX(S1210)、匹罗卡品(GC17256)购自Sellekchem;硫酸羟氯喹(HCQ,L2004157)购自Aladdin;羧甲基纤维素钠(C8621)购自Solarbio;BCA 蛋白定量试剂盒(23227)购自Thermo;完全弗氏佐剂、不完全弗氏佐剂(F5506)购自Sigma;戊巴比妥钠购自Sigma;肝素钠(Sigma);M3R 抗原肽段(C955JEK060-1,VLVNTFCDSCIPKTYWNLGY)、SSA 抗原肽段(C955JEK060-5,AVALREYRKKMDIPA)购自金斯瑞;Polyclonal Goat Anti-Mouse IgG购自Cell Way-Lab;吐温 20、乙醇(国内分析纯);生物素偶联 anti-mouse IgG(405303)、HRP亲和素(405210)、TMB 底物显色液(77247)、终止液 3M (77316)、流式抗体 PE-anti-CD45购自Biolegend。
1.3 实验仪器Elx800酶标检测发光仪(美国Bio-Tek公司);qPCR(美国Bio-Rad公司);2720热循环仪、声波聚焦流式细胞仪Attune NxT(美国Thermo Fisher scientific公司);荧光显微镜(日本Olympus公司)。
2 方法
2.1 动物分组及颌下腺蛋白诱导的小鼠ESS模型建立取8周C57BL/6雌性小鼠,随机分成4组(每组12只):I组为正常对照组;Ⅱ组为溶剂对照组,给予羧甲基纤维素钠;III组为MTX治疗组(5 mg·kg-1);Ⅳ组为HCQ治疗组(50 mg·kg-1)。自免疫当天起,每天灌胃给予200 μL化合物。
免疫当天,在无菌环境下,取2只野生型C57BL/6雌鼠双侧颌下腺,用预冷的无菌PBS冲洗两遍后于组织研磨机中搅碎为组织-PBS匀浆液,12 000g离心10 min,取上清进行BCA定量,PBS将抗原稀释为8 g·L-1。然后将同等体积的颌下腺蛋白上清液与完全弗氏佐剂(含1 g·L-1热灭活的结核分歧杆菌)分别置于乳化用的注射器中,推压直至注射器管内混合液呈乳白色且遇水不易散开,此时可以将混合的抗原乳化液转移至1 mL注射器中,置于冰上备用。除Normal组外,每只待造模小鼠背部皮下三点注射400 μg颌下腺蛋白与完全弗氏佐剂乳化后的混合液进行抗原免疫;初次免疫第14 d,在背部注射同等量颌下腺蛋白与不完全弗氏佐剂的乳化液加强免疫。
2.2 测定唾液流速用0.1%戊巴比妥钠麻醉小鼠后,腹腔注射100 μL 匹罗卡品(5 mg·kg-1)。将小鼠头部垫高以防呛鼻、窒息后,开始计时 15 min,用 20 μL移液管尖端收集唾液。
2.3 酶联免疫吸附法(ELISA)将毛细玻璃管置于30 g·L-1肝素钠中4 ℃浸泡过夜,第2天即可用于小鼠眼眶静脉丛取血。每只小鼠取血100~150 μL即可,放于37.5 ℃水浴锅中水浴10 min后2 500g离心5 min,取上清备用。96孔MaxiSorp板分别用M3R和SSA抗原肽(5 mg·L-1)4 ℃包被过夜,第2天用PBST洗板3次后每孔加100 μL Blocking Buffer封闭1 h;洗板3次,拍干,除空白对照孔外,血清样品稀释1 600倍后每孔100 μL室温孵育2 h;洗板3次,拍干,除空白对照孔外,每孔加100 μL生物素偶联 anti-IgG (0.5 mg·L-1),室温孵育1 h;洗板3次,拍干,除空白对照孔外,每孔加100 μg HRP亲和素(0.5 mg·L-1),室温孵育30 min;洗板至少4次,完全拍干后每孔加50 μL TMB显色液,约10 min后可见孔内液体变蓝,每孔加20 μL Stop Solution终止显色,最后孔内溶液呈黄色,置于酶标检测发光仪内,450 nm波长处检测A值。
2.4 病理切片苏木精-伊红(HE)染色C57BL/6小鼠处死后,取出双侧颌下腺,放入装有4 %多聚甲醛的管子里固定、脱水、石蜡包埋。切片经HE染色,由光学显微镜观察、拍照。
2.5 流式细胞术小鼠断颈处死后,取双侧颌下腺用冰PBS冲洗净后,在6孔板中剪碎成泥; 加2 mL 0.5 g·L-1胶原酶 IV,置于37 ℃摇床中消化30 min;加2 mL含质量浓度为1 g·L-1FBS的RPMI 1640培养基摇晃均匀终止消化;将组织细胞混悬液滤至新的15 mL离心管中,300g离心5 min;弃上清,用2 mL Tris-NH4Cl重悬,去红5 min后,离心,PBS洗两遍,转至1.5 mL离心管中,3 000 r·min-1离心5 min,弃上清。在PBS中以1 ∶1 000稀释流式抗体CD45(避光),每管加入200 μL,室温孵育30 min。染色结束后 3 000 r·min-1离心5 min,弃上清,PBS清洗两遍后,用1 mL PBS轻柔重悬后即可上机检测。
2.6 qPCR检测mRNA表达总体上样量为 10 μL,配方为 5 μL 2×iQTMSYBR®Green Supermix 荧光染料、 3.5 μL水、1 μL cDNA、0.25 μL引物(Former)、0.25 μL引物(Reverse);根据所需 cDNA 和引物的量分别配置水、cDNA 的混合液和荧光染料、引物的混合液;配制好后涡旋,离心;上样,封膜,离心。设置参数,扩增程序为 95 ℃,10 min;95 ℃,30 s;60 ℃,10 s,40个循环。根据扩增曲线,计算每组样品相对的mRNA表达量。结果以GAPDH作为参照基因进行标准化。

3 结果

Tab 1 Primers involved in Real-Time PCR
3.1 SG蛋白成功建立小鼠ESS模型临床上,SS患者通常表现出口干,腺体肿大,淋巴细胞免疫紊乱,疾病相关特异性抗体大量分泌等症状。为了探讨SG蛋白建立的小鼠ESS模型是否具有临床相似性,自免疫当天起,对其进行评估。与正常组相比,造模小鼠的体质量稳定增长,基本在20~21 g(Fig 1A),唾液流速从第8天开始显著下降(Fig 1B),第42天颌下腺和颈部淋巴结明显肿大(Fig 1C),SS特异性抗SSA抗体和抗M3R抗体均有所升高(Fig 1D),颌下腺组织中出现大量淋巴细胞浸润(Fig 1E,F),说明利用SG蛋白建立的小鼠ESS模型可以表现出SS患者的核心症状,为进一步探究MTX对ESS小鼠的影响提供实验模型。

Fig 1 ESS induced in C57BL/6J mice by subcutaneous injection of SG protein
3.2 MTX对ESS小鼠体质量和唾液流速的影响为了探讨MTX对小鼠ESS的治疗效果,自免疫当天起,给予5 mg·kg-1MTX持续治疗56 d。与模型组相比,MTX治疗组小鼠体质量同步稳定增长(Fig 2A),并且小鼠未出现精神萎靡,食欲不振等不良反应,说明5 mg·kg-1MTX对小鼠没有明显的毒副作用。MTX治疗第42天后,ESS小鼠唾液流速明显回升,与阳性药HCQ治疗组效果相当(Fig 2B),说明5 mg·kg-1MTX可以明显改善ESS小鼠唾液流速的减少。

Fig 2 Effects of 5 mg·kg-1 MTX on body weight (A) and salivary flow rates (B) in mice
3.3 MTX对ESS小鼠血清中自身抗体水平的影响SS患者通常会表现出较高的抗SSA抗体和抗M3R抗体阳性率。为了探究MTX对ESS小鼠血清中这些特异性抗体的影响,ELISA检测了各组小鼠血清中抗SSA抗体和抗M3R抗体水平。与模型组相比,免疫第28、42、56天后,MTX均没有明显抑制ESS小鼠血清中抗SSA抗体(Fig 3A)和抗M3R抗体(Fig 3B)的水平,说明5 mg·kg-1MTX不能阻止ESS小鼠血清中自身抗体的产生。而阳性药HCQ治疗组则可以在治疗第42天后显著减少抗SSA抗体和抗M3R抗体的分泌。

Fig 3 Effects of 5 mg·kg-1 MTX on anti-SSA and anti-M3R autoantibody levels in mice
3.4 MTX对ESS小鼠颌下腺组织中灶性淋巴细胞浸润的影响小鼠颌下腺组织切片HE染色结果显示,与模型组相比,MTX治疗后腺体中的管状、泡状结构明显清晰,灶性淋巴细胞浸润面积显著减小(Fig 4A);同时,流式细胞术分析显示颌下腺中淋巴细胞的占比明显下调(Fig 4B),与阳性药HCQ治疗组抑制效果相当,说明5 mg·kg-1MTX能够明显改善ESS小鼠颌下腺组织中由淋巴细胞浸润引起的慢性炎症反应。
3.5 MTX对ESS小鼠颌下腺组织中炎症细胞因子的影响炎性细胞因子的产生可以诱导免疫反应细胞向小鼠颌下腺组织中的趋化。Tnfsf-13b、Ccl19、Ccl21、Cxcr4、Cxcl12、Cxcr5、Cxcl13等炎性因子对 T 细胞、B 细胞的浸润活化和疾病的加重都至关重要。为了探究MTX对ESS小鼠颌下腺组织中炎症细胞因子的影响,qPCR检测了免疫第56天后各组小鼠颌下腺组织中炎性细胞因子的相对表达量。与模型组相比,MTX治疗后炎性细胞因子Ccl21、Cxcr5、Cxcl13的表达明显下调,但Tnfsf-13b、Ccl19、Cxcr4、Cxcl12的表达水平变化并不显著(Fig 5),说明5 mg·kg-1MTX可能通过调节Cxcr5-Cxcl13轴以及Ccl21的分泌抑制淋巴细胞向颌下腺组织的趋化。阳性药HCQ治疗组则抑制Ccl21和Cxcl12基因的表达,这可能与MTX和HCQ的分子作用机制不同有关。

Fig 4 Effect of 5 mg·kg-1 MTX on proportion of leukocyte infiltration in salivary glands of
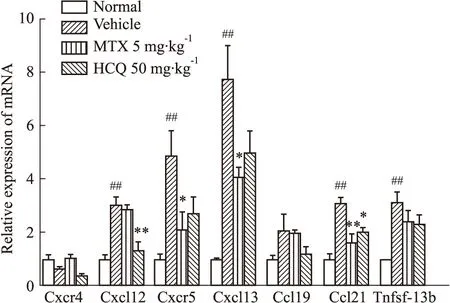
Fig 5 Effect of 5 mg·kg-1 MTX on levels of inflammatory cytokines in salivary glands of
4 讨论
SS患者占我国总人口的0.22%~0.77%,并且有30%~40%的患者会表现出全身性的症状。而无循证治疗仅根据临床经验使用人工泪液、唾液等各种人工替代品减轻口眼干燥等局部症状,无法解决全身性的炎症反应。目前为了获得治疗SS的药物,老药新用和靶向治疗两种策略都在快速发展。尽管SS的发病机制不断被发现,但是尚无针对SS的靶向治疗方案,在研的抗IFN-β、抗BAFF等靶向药物可能是未来精准治疗SS的主要趋势。而已有的治疗类风湿性疾病的药物在SS临床前试验中并没有表现出良好的药物效果。
MTX具有抗炎和免疫抑制作用,已有临床考察发现MTX联合帕夫林胶囊、白芍总苷或者雷公藤多苷对SS的治疗疗效显著。所以,本实验通过构建ESS雌鼠模型[13],探究单独使用MTX治疗SS的效果。研究表明,在5 mg·kg-1MTX作用后,ESS小鼠唾液流速明显加快,这与随后被证实的小鼠颌下腺组织中淋巴细胞浸润量减少相关。值得注意的是,Cxcr5只在B淋巴细胞和滤泡辅助T细胞中表达,这可能提示炎症相关趋化因子Cxcr5/Cxcl13的变化会影响B淋巴细胞向颌下腺组织的趋化。
MTX治疗具有一定局限性,研究表明,5 mg·kg-1MTX能够明显改善淋巴细胞的局部浸润与趋化,但不能改善浆细胞分泌的抗SSA抗体和抗M3R抗体水平,所以还是需要考虑通过与其他生物制剂联用来增强药效。已有报道称,MTX会导致机体免疫监视功能的下降,而在病毒持续存在的情况下,病毒诱发的SS可能会产生病毒再激活的潜在风险。同时,对于治疗炎症性自身免疫疾病来说,给予MTX的剂量把握尤为重要,本文没有讨论多个不同剂量MTX对小鼠ESS的影响,不恰当MTX的使用可能会导致小鼠体质量下降,肝、肾毒性,甚至是死亡。
综上所述,MTX在一定程度上通过抑制淋巴细胞浸润改善小鼠ESS,但药物使用剂量以及作用机制还有待进一步研究。
