血浆EBV DNA变化预测晚期胃癌化疗近期疗效的价值
2023-11-10彭丽香黄晏骁江长安
彭丽香 黄晏骁 曾 频 江长安 赵 鹏
胃癌居全国恶性肿瘤发病第2位,死亡第3位,据估计2014年新发胃癌病例41.0万,死亡29.4万,严重危害人民群众健康[1]。我省2010年的统计数据亦表明,胃癌仍然是我省居民最主要的癌症死因之一[2]。2014年,癌症基因组图谱研究(TCGA)项目组提出将胃癌分为4个亚型,EB(Epstein-Barr,EBV)病毒阳性型便是其中之一[3]。EB病毒阳性胃癌,占所有胃癌的9%,其特征包括PIK3CA频发突变、PD-L1/2过表达、DNA超甲基化和免疫细胞信号转导[3]。后来,Camargo MC等的研究证实EBV状态与胃癌患者预后密切相关[4]。
1993年,Tokunaga M首次发现EBV存在胃癌细胞,认为其可能与胃癌发生发展有关,并将这一类胃癌命名为EBV相关胃癌[5]。与体内正常长链完整EBVDNA不同,癌症患者血浆中EBV-DNA常为游离短DNA片段[6]。在鼻咽癌中血浆EBVDNA检测分析用于早期无症状鼻咽癌的筛查[6];而放疗中期血浆EBVDNA负荷可有效预测晚期鼻咽癌的疗效,且放疗后仍可检测到EBV DNA的患者PFS和OS明显更差[7]。
研究显示,活检组织中EBV编码RNA(EBER) 的原位杂交(ISH)仍然是检测EBV的金标准,且使用PCR测定EBV病毒载量在EBV相关疾病的诊断中越来越重要[8]。因此,本研究拟通过化疗,观察血浆EBV DNA在晚期胃癌患者的阳性率变化,基于此进一步探究血浆EBV DNA基础值及化疗后变化与化疗近期疗效间的关系。
1 资料与方法
1.1 一般资料
主要收集江西省肿瘤医院2017年6月至2020年5月胃癌根治性手术切除样本350例,均于10%中性福尔马林缓冲液固定,石蜡包埋。男性患者209 例、女性患者141例,年龄32~79岁,中位年龄59岁。入组标准:经影像学和组织病理学确诊为进展期的胃腺癌患者,≥18岁,ECOG行为评分0~2分,骨髓储备功能好,无肝、肾、心、肺等重要脏器的严重损害,至少具备1个可测量病灶,初始接受姑息或新辅助化疗。剔除条件:同时患鼻咽癌和淋巴瘤。
1.2 主要试剂
ELISA 试剂盒购自Rapidbio公司,荧光定量PCR试剂盒购自BioTeKe公司,原位杂交消化酶、EBER探针、PCR引物、DNA聚合酶、各清洗缓冲液、脱蜡液、液体封盖膜、细胞处理液及其他常规试剂均购自美国罗氏公司。
1.3 方法
①EBV-RNA(EBVR)原位杂交法诊断胃癌组织中是否存在EBV(EBV诊断金标准):肿瘤组织石蜡包埋后3 μm厚度切片,60 ℃恒温箱烤片2 h,Ventana BenchMark XT全自动染色仪进行全自动原位杂交检测。检测过程:组织脱蜡后经热修复及酶消化,荧光素标记的探针与组织中特异的靶序列进行杂交,加入带生物素的二抗与链酶亲合素-碱性磷酸酶混合物结合,底物经显色后产生蓝色沉淀物。用已知阳性组织作为阳性外对照。
②PCR检测胃癌患者基础值和每2周化疗前血浆EBV-DNA表达水平:化疗前对患者给予外周血EBV-DNA的PCR检测。检测过程:细胞单独培养或取不同的共培养细胞模型,待细胞生长至70%~80%后,更换无血清培养基饥饿24 h。加入100 nmol/L E2处理细胞12 h,各组调整DMSO至一致,最后分别得到对照组(ctrl)、E2处理组(E2),处理相应时间后立即终止药物处理,用TRIzol 试剂提取各组细胞中总RNA,逆转录为cDNA。逆转录及PCR反应均按照TaKaRa试剂盒及荧光定量PCR试剂盒说明进行操作,直至获得目标序列并定量,进而测得血浆EBV-DNA表达水平。实验重复3次。
③为进一步研究血浆EBV DNA变化与化疗疗效的关系,将疗效评价结果分为两类:无进展组(包括完全缓解、部分缓解、疾病稳定)和进展组(疾病进展)。
1.4 统计学方法
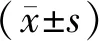
2 结果
2.1 原位杂交法及PCR检测诊断EBV在晚期胃癌患者中的阳性率
350例胃腺癌患者组织切片经 EBV-RNA(EBVR)原位杂交法诊断胃腺癌组织中存在EBV阳性37例,阳性率为10.57%。
2.2 血浆EBV DNA基础值及化疗后变化
2.2.1 原位杂交法诊断的胃腺癌患者血浆EBV DNA阳性率化疗后变化 37例经 EBV-RNA(EBVR)原位杂交法诊断胃腺癌组织中存在EBV阳性的胃腺癌患者血浆EBV DNA阳性率在化疗进程中总体呈逐渐下降趋势, 两两比较发现,化疗每完成2周后,阳性率较前均明显下降, 差异有统计学意义(表1)。

表1 每2周期化疗前37例胃癌患者血浆EBV阳性变化
2.2.2 胃腺癌患者每2周期化疗后EBV DNA阳性率与无进展人数变化 依据RECIST标准评价客观疗效后,显示每2周期化疗后37例胃腺癌患者中无进展人数(图1)。在图中化疗2~6周期中血浆EBV DNA阳性率降幅最大,而无进展人数降幅最小,且血浆EBV DNA阳性率与无进展人数具有相关性(图2)。

注:主坐标为人数,次坐标为阳性率。

图2 胃腺癌患者EBV DNA阳性率变化与无进展人数的相关性
3 讨论
胃癌的主要部分与多种致病性感染有关,包括但不限于幽门螺杆菌(H. pylori)或EB病毒(EBV)[9]。
肿瘤微环境(TME)由肿瘤细胞、免疫细胞、基质细胞等细胞外成分组成,对肿瘤进展和治疗耐药性起着举足轻重的作用,这些基质细胞通过释放各种分子直接激活癌细胞中的生长信号或重塑周围区域来促进肿瘤生长[10-11]。例如,在GC中,PD-L1表达与不同的临床病理特征相关,包括高密度TILs,MMR缺乏和EBV阳性[12]。
研究显示,EBV阳性胃腺癌患者在化疗初期存在血浆EBV DNA转阴,而2~4个周期后复阳现象,如表1所示,而在该类患者中有部分存在远处转移情况。本研究还发现,在37例EBV阳性胃腺癌患者中存在合并幽门螺杆菌感染的患者,其中包含了5例进展患者,虽然人数较少,但在相同条件下化疗后其血浆EBV DNA的降幅明显小于其它未感染幽门螺杆菌胃癌患者。当然,幽门螺杆菌感染患者的EBV DNA拷贝数显著较高,幽门螺杆菌阳性个体中EBV DNA载量增加的趋势表明幽门螺杆菌在调节EBV向裂解期的转化中可能起作用,同时,在GC中存在Hp的情况下,基于添加EBV的协同效应产生的估计风险增加了26倍[13]。同一肿瘤内的多种病毒感染可能会影响TME[14]。然而,是否存在两者共同作用的因素导致肿瘤细胞的耐药性或促进EBV的表达这个不得而知。本次实验的相关人数较少,仅仅单独研究其相关性可能不妥,因此很难判断其是否具有相关性,当然这或许也符合上述的肿瘤发生和发展存在多因素影响。
不少研究表明,EBV 感染导致的疾病种类多样,不同标本类型都可以给临床提供有价值的诊疗信息,不同疾病应选择不同样本以实现EBV感染的准确诊断[15],因此,一旦晚期胃癌伴转移,在行姑息性手术后其他转移处只能行化疗处理,而其化疗效果尚不可控,此刻只检测血浆内EBV DNA量会在一定程度上影响本次研究的稳定性。当然,在以后的研究里还可以通过使用定量方法(如qPCR)测试EBV相关基因的表达来获得额外的信息和对患者病情的更好评估[16]。除此之外,本研究还进一步发现,胃腺癌患者在实施肿瘤切除及化疗后,饮食功能、消化功能也相继明显下降,继而导致免疫功能进一步下降,患者也较易发生急性呼吸道感染,而该类患者的EBA DNA表达也有较为明显的波动。我们知道,TME是通过募集和分化免疫抑制和/或抗炎细胞[如调节性T细胞(Tregs)、Th17细胞、树突状细胞(DC)、M2肿瘤相关巨噬细胞(TAM)和髓源性抑制细胞(MDSC)]以及抑制免疫效应细胞(如NK细胞和CD8 T淋巴细胞)发挥核心作用[17],而急性呼吸道感染可能会影响体内TME,然目前暂未发现有此类相关研究。这个情况对于本实验研究也会有些许影响。然而,此类情况虽不可避免,但是经实验室及影像学检查显示的肿瘤进展尚未见到明显影响。
