血清外泌体中GP1BA 的表达水平与动脉粥样硬化的相关性分析
2023-11-08张洪钦陈子凌何文慧郑伯仁
张洪钦 江 裕 陈子凌 何文慧 郑伯仁
福州市第二医院药剂科(福建福州 350007)
动脉粥样硬化(atherosclerosis,AS)是世界上最常见的死亡原因之一,患病率为万分之二。AS主要由低密度脂蛋白胆固醇升高引起,其主要症状是内皮损伤、平滑肌细胞过度增殖和淋巴细胞浸润导致的内膜增生[1],使管腔变窄并减少流向靶组织的血流量[2]。外泌体在细胞间通信中非常有效,因为它们能够以保护性方式传输可生物降解的分子。新出现的证据表明,不同细胞分泌的旁分泌外泌体通过其蛋白质和非编码RNA成分在AS中起着至关重要的作用,这可能成为AS的治疗方法[3]。最近研究发现,心肌梗死后受损心肌细胞释放高表达糖蛋白 Ib 血小板亚基α(glycoprotein Ib platelet subunit alpha,GP1BA)的外泌体,触发了血管生成。GP1BA是GPIb-Ⅸ-V复合物最重要的亚基,充当内皮细胞损伤及功能障碍标志物血管性血友病因子(von Willebrand factor,vWF)和凝血酶受体,通过与磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)、蛋白激酶C(protein kinase C,PKC)、活性氧(reactive oxygen species,ROS)等信号途径相互作用,诱导血小板黏附和活化,加速血栓形成[5]。敲除GPIBA基因则能减轻小鼠AS。GPIBA被认为是血栓治疗靶点之一,并研发了相关抗血小板制剂。既往对免疫细胞、干细胞外泌体调节和治疗心血管疾病进行了大量研究[4]。但是,外泌体携带及运输GP1BA对AS的调节作用尚不清楚。
1 资料与方法
1.1 一般资料
经本院伦理委员会批准(伦理批件号:2021023),纳入本院2022年1月—2023年1月收治的选取30例心电图提示ST-T改变及冠状动脉造影显示有AS斑块的患者为动脉粥样硬化组,其中男19例、女11例,年龄(65.3±10.8)岁。入选标准:①有完整、详实病例资料,如出入院记录及所需检查资料等:②具有血脂基线数据资料;③年龄≥18岁。排除标准:①肝功能不全;②入院前1个月发生过心肌梗死,心功能分级大于Ⅲ级者;③患有肾病综合征或慢性肾脏病≥4期;④患有甲状腺功能亢进或减退;⑤感染性疾病急性期;⑥恶性肿瘤、结核等全身消耗性疾病;⑦可引起脂质代谢异常的疾病,如库欣病等;⑧长期采用糖皮质激素治疗者。收集同期体检无上述异常的志愿者30例为对照组,其中男19名、女11名,年龄(59.0±13.8)岁。对照组纳入标准:无心脑血管疾病史且临床三大常规检查均正常。排除标准:有精神意识障碍、不愿配合本研究或意识交流等困难者。2组一般资料比较差异均无统计学意义(P>0.05),具有可比性。本研究均经患者或家属同意并自愿签署知情同意书。
1.2 外泌体提取与鉴定
收集血清样本,500×g离心10 min后,用0.22 μm无菌过滤器过滤细胞碎片和大囊泡;转移至装有超滤膜的超滤仪,氮气加压过滤;100 000×g离心40 min,收集沉淀。透射电镜观察外泌体形态:外泌体置于pH 7.4的2%甲醛+ 1.5%戊二醛磷酸钠,4 ℃固定2 h,蛋白质印迹杂交膜清洗液(Tris-buffered saline,TBS)漂洗;1%锇酸-1.5%亚铁氰化钾固定2.5 h,TBS漂洗。梯度乙醇脱水,环氧树脂包埋,半薄切片定位,超薄切片。3%醋酸铀、柠檬酸铅染色,电镜观察。外泌体粒径分析:ZetaView纳米颗粒跟踪分析仪检测外泌体浓度粒径,ZetaView 8.04.02 SP2软件获取外泌体粒径直径及浓度。蛋白质提取,加入载样缓冲液,95 ℃水浴加热5 min;双吡啶甲酸(bicinchoninic acid,BCA)法定量;上样,SDSPAGE凝胶电泳,转膜,封闭,4 ℃孵育一抗(标志蛋白跨膜四蛋白-29(the cluster of differentiation 9,tetraspanin-29,CD9)、跨膜四蛋白-28(the cluster of differentiation 81,tetraspanin-28,CD81)、钙连接蛋白(Calnexin)和肿瘤易感基因101(tumor susceptibility gene101,TSG101)(均购于北京索莱宝科技有限公司),稀释倍数均为1∶1 000),过夜,TBST洗膜3次,二抗孵育2 h,TBST洗膜3次,化学发光成像,凝胶图像分析。
1.3 实时荧光定量(real time quantitative,RTqPCR)
样本中加入NucleoZol提取总RNA,cDNA合成,PCR扩增,GAPDH为内参基因,根据2-ΔΔCt法分析GP1BA相对表达量。引物序列见表1。

表1 引物序列
1.4 蛋白免疫印迹
提取样本中的外泌体后,BCA法定量;上样,十二烷基硫酸钠聚丙烯酰胺(sodium dodecyl sulphate-polyacrylamide gel electrophoresis,SDSPAGE)凝胶电泳,转膜,封闭,4 ℃孵育一抗(β-actin,购于艾博抗(上海)贸易有限公司)],1∶1 000,GP1BA (购于北京索莱宝科技有限公司),1∶500)过夜,TBST洗膜3次,二抗孵育2 h,TBST洗膜3次,化学发光成像,凝胶图像分析。
1.5 酶联免疫吸附试验
根据试剂盒(均购于武汉博士德生物工程有限公司)说明书操作,绘制标准曲线后,检测血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(interleukin-1β,IL-1β)、干扰素-γ(interferon-γ,IFN-γ)、高敏肌钙蛋白(high sensitivity cardiac troponin T,hs-cTnT)、血管性血友病因子(von Willebrand factor,vWF)水平。
1.6 统计学分析
实验数据采用SPSS 20.0统计软件分析,正态性分布的计量数据以()表示。数据,组间比较采用t检验;不符合正态性分布,采用非参数检验。计数资料采用χ2检验和Pearson分析相关性。P<0.05表示为差异有统计学意义。
2 结 果
2.1 外泌体提取与鉴定
纳入30例动脉粥样硬化患者为动脉粥样硬化组和30例健康者为对照组。电镜结果和粒径检测结果显示,血清外泌体平均粒径大小在100 nm,符合外泌体质量标准(图1A、B)。蛋白免疫印迹检测标志蛋白CD9、CD81和TSG101结果显示均检测到外泌体标志蛋白,Calnexin为外泌体阴性标志蛋白,均检测不到,表明外泌体提取成功(图1C)。
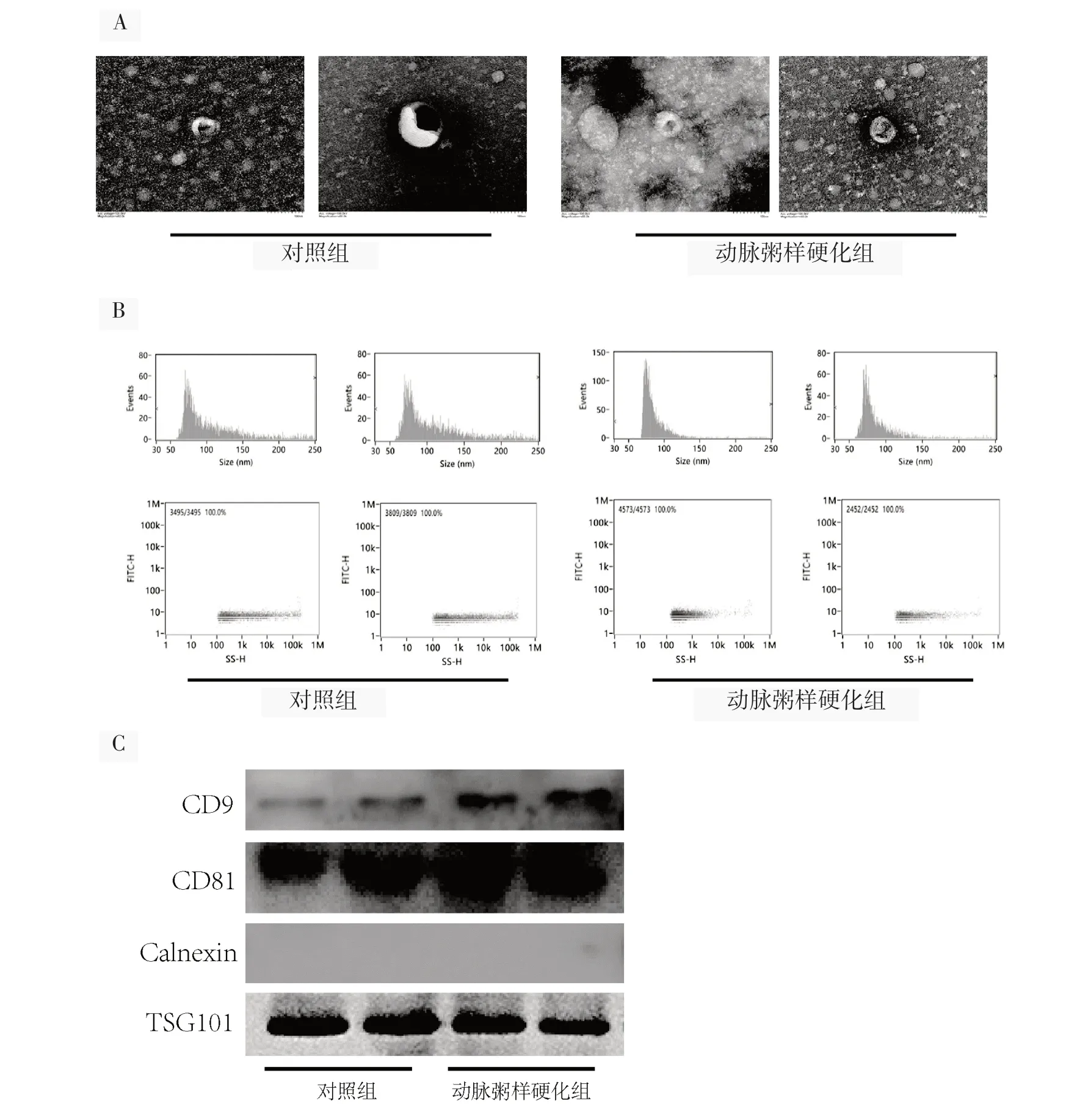
图1 外泌体鉴定
2.2 外泌体中GP1BA表达量检测
根据RT-qPCR结果可得在动脉粥样硬化组中的GP1BA的表达量高于对照组(图2A,P<0.05),蛋白免疫印迹结果表明动脉粥样硬化组中的GP1BA的蛋白水平高于对照组(图2B,P<0.05)。
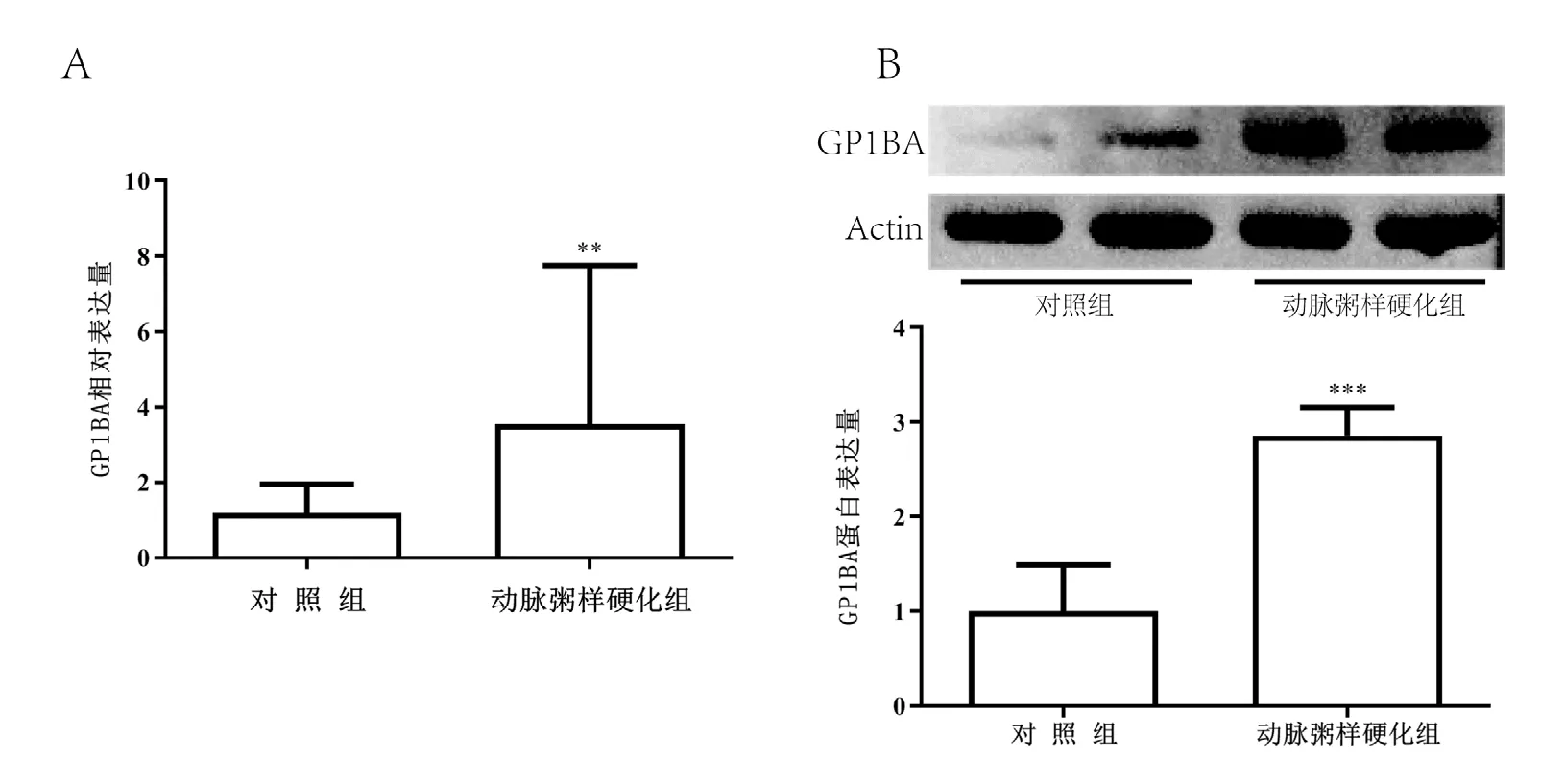
图2 外泌体GP1BA 表达量检测
2.3 血清中TNF-α、IL-1β、IFN-γ、hscTnT、vWF含量检测
通过ELISA法检测2组受试者血清中的炎症因子TNF-α、IL-1β、IFN-γ及血管和心肌损伤标志物hs-cTnT、vWF含量发现,动脉粥样硬化组炎症因子TNF-α、IL-1β、IFN-γ含量及血管和心肌损伤标志物hs-cTnT、vWF含量均高于对照组(图3,P<0.05)。
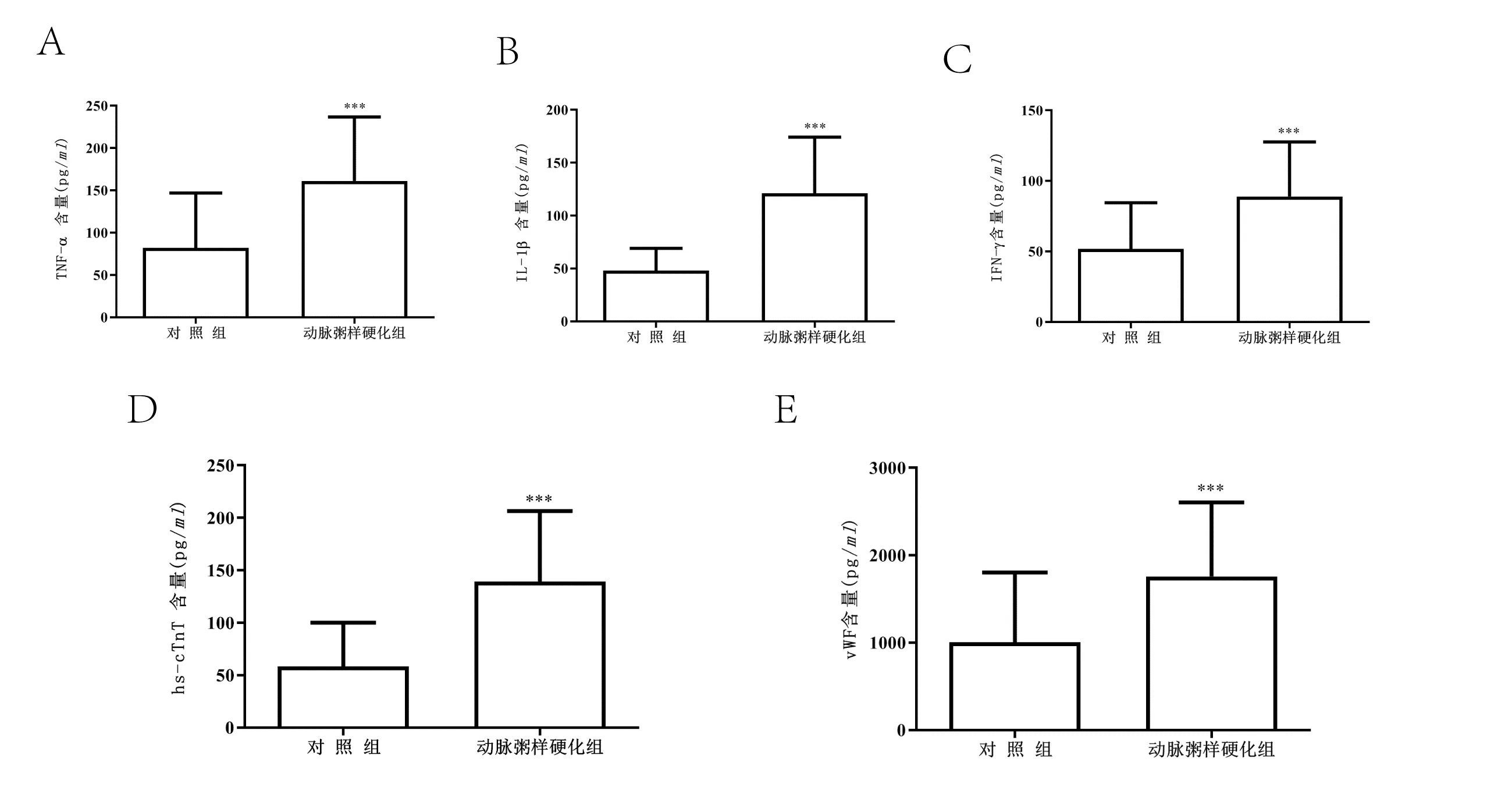
图3 ELisa 检测血清中TNF-α、IL-1β、IFN-γ、hs-cTnT、vWF 含量
2.4 GP1BA与血清中TNF-α、IL-1β、IFN-γ、hs-cTnT、vWF的相关性
对外泌体中的G P 1 B A 的表达量与血清中TNF-α、IL-1β、IFN-γ、hs-cTnT、vWF的相关性发现,GP1BA与TNF-α(r=0.632)、IL-1β(r=0.549)、IFN-γ(r=0.572)、hs-cTnT(r=0.533)、vWF(r=0.597)均存在相关性(均P<0.05)(图4)。
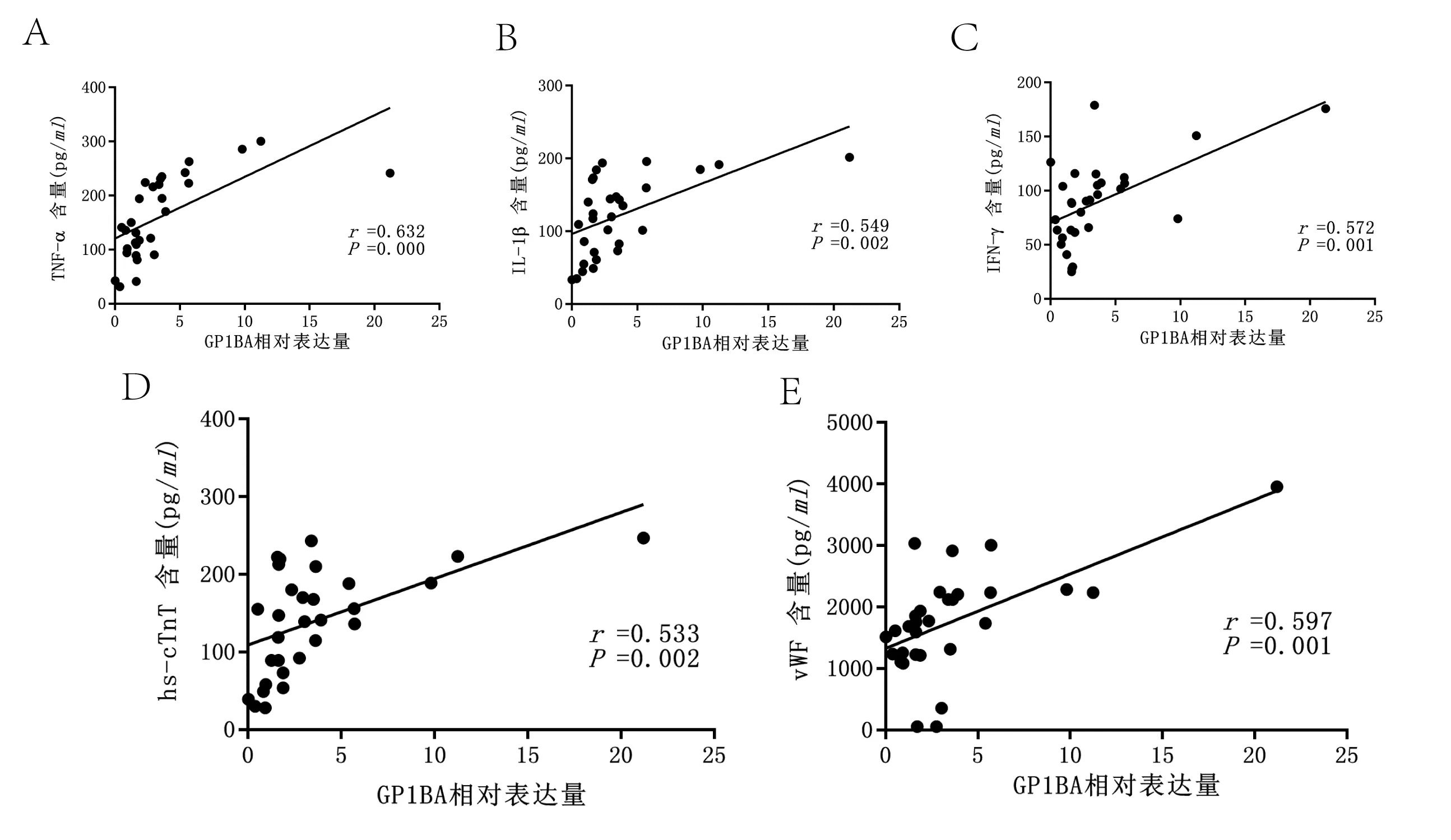
图4 GP1BA 与TNF-α、IL-1β、IFN-γ、hs-cTnT、vWF 含量的相关性分析
3 讨 论
动脉粥样硬化涉及动脉壁中纤维脂肪病变或斑块的形成。动脉粥样硬化的病理过程包括内皮损伤、脂质沉积、炎性细胞浸润、泡沫细胞形成和斑块形成。本研究收集动脉粥样硬化患者与健康志愿者检测炎症因子发现动脉粥样硬化患者血清中的炎症因子水平升高。有研究表明在动脉粥样硬化发生中,动脉内膜中的脂质积聚是炎症性动脉粥样硬化病变形成的根本原因。同时,血管和心肌损伤标志物hs-cTnT、vWF也升高,表明动脉粥样硬化患者的血管和心肌受到胁迫。而在动脉粥样硬化部位的脆弱斑块破裂导致原位血栓形成和壁内出血,导致缺血和中风[6]。这与hscTnT、vWF表达量升高与动脉粥样硬化可造成血管损伤的结论相吻合。
细胞通信对于几乎所有生理和病理过程都是必不可少的,包括动脉粥样硬化。除了广泛接受的神经传递和内分泌信号传导外,细胞外囊泡还被认为是细胞间通信的新参与者[7],分为外泌体、凋亡体、微囊泡和其他囊泡。外泌体(直径40~160 nm)[8]由几乎所有细胞类型分泌,并携带生物分子,如DNA、RNA、蛋白质、脂质和代谢物。我们提取的外泌体从电镜结果看出是双层膜结构,且直径约为70 nm,大小形态均符合外泌体特征,鉴定为外泌体。外泌体在跨越生物屏障方面也显示出巨大的优势,并参与短距离和长距离的细胞间通讯[9]。因此,外泌体作为诊断和治疗应用的生物标志物和药物载体已被深入研究。在梗死后外泌体蛋白质组中富集的功能,包括蛋白质代谢,蛋白酶抑制剂活性,细胞骨架蛋白结合和细胞通信、生长、维持,以及血小板脱颗粒、止血和血液凝固的途径。先前研究已经表明,血小板是梗死心肌内最早积累的炎症细胞群之一[10],在心肌梗死血浆外泌体中,发现GP1BA蛋白含量升高9.18倍,而在本研究中,动脉粥样硬化组的血清外泌体中的GP1BA含量也高于对照组,这可能与血管损伤相关。GP1BA能与vWF和纤维蛋白原有效结合,形成复合物并参与血小板聚集,动脉粥样硬化与血小板、巨噬细胞以及这些细胞释放的物质(包括生长因子)之间的相互作用有关。动脉粥样硬化预防的方法也包括:保护内皮,特别是与维持其非血栓形成特征有关:抑制血小板相互作用[11]。通过相关性分析,我们结果也表明二者呈正相关,且相关性较强。血小板还可以释放促炎介质并形成促进动脉粥样硬化的血小板-白细胞复合物[12-13],研究结果TNF-α、IL-1β、IFN-γ炎症因子显著升高与前人研究结果相似。由此猜测,TNF-α、IL-1β、IFN-γ炎症因子增多促进GP1BA与vWF形成复合体,加快动脉粥样硬化进程。
综上所述,血清外泌体中的GP1BA的表达水平与动脉粥样硬化存在相关性,可作为动脉粥样硬化的潜在标志物。
