人眼表微生物群与眼表疾病研究进展
2023-11-08杨瑞波
王 丹,杨瑞波
0 引言
近年来,干眼、过敏性结膜炎等非感染性眼表疾病的发病率越来越高,而疾病的确切病因及病理生理机制尚有待阐明。2014年,随着人类微生物组计划的实施,对包括皮肤、胃肠道和泌尿生殖道等身体许多部位进行微生物特征分析,并评估其在人类健康和疾病中的作用,眼表微生物群在眼表疾病中作用的探索也逐渐进入研究者们的视野[1]。眼表黏膜暴露于外部环境,有特定的微生物群定植于眼表,与眼表组织、细胞及细胞因子共同构成稳定的眼部微环境[2]。正常情况下,眼表中各种微生物处于相对平衡状态,组成正常微生物群的细菌种类可通过竞争机制抑制致病菌生长[3],但当眼表屏障的防御功能损伤时会引起微生物失调,使致病菌过度繁殖,加重眼表损害。因此,了解眼表微生物群的组成、疾病中微生物的变化将有助于更好地了解眼表疾病的致病机制。
1 正常眼表核心微生物群
回顾国内外基于传统细菌培养技术对眼表微生物群的研究[4-8],发现正常眼表分离出来的细菌主要是凝固酶阴性葡萄球菌、金黄色葡萄球菌、痤疮丙酸杆菌、棒状杆菌等。随着人类微生物组学研究的进展,对于眼表是否与人体其他部分一样存在核心微生物群的疑问被研究者们提出[1]。但是细菌培养的结果并不能包含眼表所有的微生物群,高通量测序技术的应用逐渐解决了该问题(表1[4,7-15])。
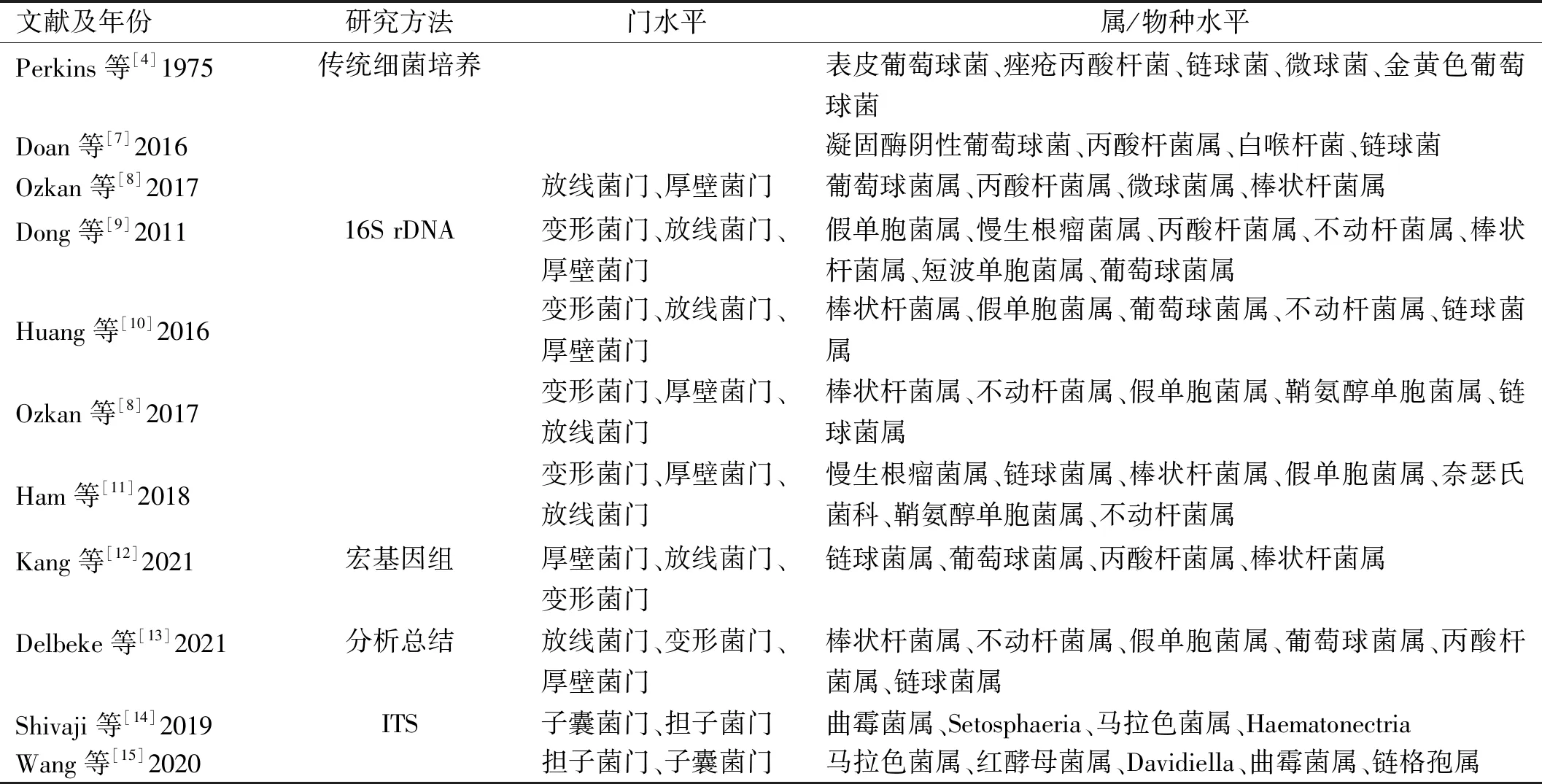
表1 正常眼表核心微生物
2011年,Dong等[9]第一次采用16S rDNA高通量测序技术对4位受试者的结膜囊细菌进行测序分析,发现了变形菌门、放线菌门、厚壁菌门3个主要菌门和假单胞菌属、慢生根瘤菌属、丙酸杆菌属、不动杆菌属、棒状杆菌属5个主要菌属,但由于样本量太小,未表明其稳定性就直接定义“核心”微生物群还为时尚早。为了更好地确定眼表核心微生物群及眼表微生物的稳定性,Ozkan等[8]对45位健康受试者在3mo内的3个时间点进行结膜采样,发现每个时间节点的主要菌属是棒状杆菌属、不动杆菌属、假单胞菌属、鞘氨醇单胞菌属、链球菌属,并且由于存在1位或多位受试者受检的所有时间点均出现的菌属,分析认为可能存在针对个体的微小核心微生物群。与上述研究一致,2021年,Kang等[12]采用宏基因组测序技术对健康人眼表微生物组分析,发现属水平主要有链球菌属、葡萄球菌属、丙酸杆菌属、棒状杆菌属,而个体在物种水平上存在菌株异质性,这进一步验证了个体微小核心微生物群的存在。
同年Delbeke等[13]对已发表的11篇文献中的可用原始数据进行分析,将至少在5个已发表队列研究中存在且相对丰度大于1%的菌属定义为健康成年人的核心微生物群——棒状杆菌属、不动杆菌属、假单胞菌属、葡萄球菌属、丙酸杆菌属、链球菌属。
目前对于眼表核心微生物群的研究主要集中在细菌方面,但眼表微生物群并不是只有细菌,还包括真菌、病毒[12]。Wang等[15]使用内源转录间隔区(internal transcribed spacer,ITS)测序的方法对健康人眼表的真菌进行分析,发现担子菌门和子囊菌门2个主要门类及马拉色菌属、红酵母菌属、Davidiella、曲霉菌属和链格孢属5个主要属类,并且这些微生物在80%以上的样本中发现,与Shivaji等[14]研究发现的马拉色菌属和曲霉菌属在所有检测到真菌的样本中均存在的结果一致。真菌微生物的确定将有助于更全面地定义正常眼表核心微生物群,但相关研究还较少,未来应加强对眼表真菌、病毒等的鉴定以更好地了解疾病的发病机制。
2 眼部及全身性疾病与眼表微生物群的变化
2.1干眼与眼表微生物群的变化干眼为多因素引起的慢性眼表疾病,是由泪液的质、量及动力学异常导致的泪膜不稳定或眼表微环境失衡,可伴有眼表炎性反应、组织损伤及神经异常,造成眼部多种不适症状和(或)视功能障碍[16],主要分为水液缺乏型、脂质异常型、黏蛋白异常型、泪液动力学异常型及混合型干眼。
在干眼的发病及病理损伤机制研究中,眼表微生物失调近年来备受关注。基于传统细菌培养方式在干眼中检测出的细菌主要为凝固酶阴性葡萄球菌[17]。2007年,Graham等[18]通过PCR技术检测出了相当数量的非典型的红平红球菌、产酸克雷伯氏菌、欧文氏菌属,这些细菌菌群的检出表明干眼患者眼表微生物群构成的变化。2019年,Li等[19]使用16S rDNA测序技术对35例干眼患者和睑板腺功能障碍(meibomian gland dysfunction, MGD)是脂质异常型干眼的主要类型。通过传统细菌培养方式在MGD患者眼表中检测到的主要细菌与健康人眼表一致,均是凝固酶阴性葡萄球菌,但MGD患者的细菌分离率及检测出的细菌种类却显著高于健康人[21],提示MGD患者存在微生物的失调主要反映在细菌的量及种类的变化。随后研究者基于更精确的16S rDNA测序技术对MGD患者眼表微生物的变化进行分析,试图寻找出对疾病的发生发展具有重要意义的微生物群。2019年,Dong等[22]利用16S rDNA测序技术分析发现葡萄球菌属和鞘氨醇单胞菌属为MGD中的标志性微生物,且睑板腺的萎缩程度随葡萄球菌属的相对丰度增加而加重,这表明葡萄球菌属在MGD的发病过程中有着重要作用:(1)睑板腺分泌过多的胆固醇酯和游离脂肪酸酯,刺激金黄色葡萄球菌生长,导致眼表菌群紊乱;(2)葡萄球菌属产生的酯酶可显著改变眼表及睑板腺周围游离脂肪酸的分布,使泪膜不稳定,加重眼表不适症状[23]。 2020年,Zhao等[24]采用宏基因测序技术对代谢途径进行分析,发现在MGD样本中微生物参与碳水化合物和脂质代谢的酶丰度增加,这种改变似乎降低了微生物对环境中能量的要求,使其在低能量的环境中也可以更好地生存。
54例非干眼患者结膜囊拭子进行分析,发现干眼患者的α、β多样性与非干眼患者存在显著差异,并且非干眼患者微生物群落聚集性更好且优势物种更多。与此研究一致,Andersson等[20]对于水液缺乏型干眼的研究表明干眼患者的α多样性显著降低,β多样性与健康人之间存在显著差异。
上述研究表明,干眼患者存在眼表微生物群的失衡,并且在不同类型干眼中对疾病有影响的微生物群可能存在差异,但具体微生物的改变及具体的作用机制还需要更多的样本及更加精准的研究方法来确定。
2.2过敏性结膜炎与眼表微生物群的变化过敏性结膜炎(allergic conjunctivitis,AC)是最常见的眼表疾病之一,包括以抗原特异性免疫球蛋白E(IgE)和辅助型T细胞2(Th2)介导的超敏反应为特征的一系列疾病。
越来越多的证据表明,皮肤、肠道和呼吸道的微生物群在过敏性疾病(如特应性皮炎、食物过敏和哮喘)中起着重要作用[25]。近年来对AC中结膜微生物群变化的研究逐渐增多。2015年,Al-Hakami等[26]通过常规细菌培养的方法发现在春季角结膜炎患者眼表可分离出更多的金黄色葡萄球菌,而性别、年龄匹配的健康对照组眼表可分离出更多的表皮葡萄球菌,认为金黄色葡萄球菌定植在春季角结膜炎发生中具有潜在加重作用。2021年,Vishwakarma等[27]发现,虽然春季角结膜炎患者和健康对照组眼表细菌组成上相似,但春季角结膜炎患者的细菌负荷增加且金黄色葡萄球菌的分离率较高。既往认为金黄色葡萄球菌来源的外毒素对于特应性皮炎具有促进作用,其是否在AC的发生发展中也有类似的作用还需要未来更多的研究探索。通过16S rDNA测序发现,AC患者存在结膜囊微生物失调,其中卡他莫拉氏菌在AC中富集,并且对于不同类型的AC患者,其眼表微生物群组成存在显著差异[28],提示与研究不同类型干眼的发病机制一样,对AC的不同类型也要进行细分,或许能从微生物群组成的角度进一步挖掘其发病机制。多项关于AC的研究采用了ITS测序技术对真菌的组成变化进行分析,几乎均发现马拉色菌的相对丰度显著增高[27-28]。这种真菌还可以产生多种免疫球蛋白引起特异性IgE抗体的产生,并可以诱导促炎因子释放及T细胞反应,从而促进特应性皮炎的发生[29]。值得注意的是,季节和常年AC主要是由IgE介导的反应,因此这种真菌在其中的作用机制值得进一步研究。
2.3全身性疾病与眼表微生物群的变化近年研究发现,眼表微生物群的变化不仅与眼表疾病有关,全身性疾病也可通过一定的机制途径影响眼表微生态,进而导致眼表微生物失调。
Sjögren综合征(Sjögren’s syndrome,SS)是一种自身免疫性疾病,肠道微生物失调在该病中的作用已被证实。2020年,Moon等[30]发现原发性Sjögren综合征(primary Sjögren’s syndrome,pSS)患者肠道微生物中厚壁菌门/拟杆菌门比值下降,这一比例的偏移被认为是微生态失调,厚壁菌门/拟杆菌门比值降低与肠道的炎症状态有关,而该比值增加与肥胖症有关[31]。2022年,Yang等[32]比较了30例pSS患者和20例健康人的肠道微生物群,发现pSS患者肠道中促炎微生物丰度升高,而抗炎微生物丰度降低。SS除了肠道微生物群的失调,在局部如口腔[33]、阴道[34]微生物群也有变化,因该病在眼部也有相应干眼表现,研究者对眼表微生物群的失调也进行了研究,发现SS患者眼表微生物的多样性下降,门属层面上也存在细菌的显著性差异,其中厚壁菌门/拟杆菌门的比值升高,这与在肠道中的比值相反,而两个方向的比值变化均是微生物失调的标志,因此推测被扰乱的微生物组成可能会激活不同的免疫调节和炎症途径,从而导致或加重泪膜不稳定和眼部损伤[31,35]。
3 微生物失调引起疾病的可能机制
眼表微生物防御屏障主要由生理防御、生化防御、免疫防御三部分组成,能够将眼内组织与一些有害微生物、炎症因子等分隔开[36]。生理防御主要包括睫毛机械性遮挡和瞬目动作,防止异物进入眼内并使泪液中的微生物通过泪道排入鼻腔,此外还包括眼表上皮细胞的屏障作用[36]。生化防御主要是泪液中的抗菌物质[37]——溶菌酶(水解革兰氏阳性菌的细胞壁)、乳铁蛋白(结合Fe2+,剥夺细菌营养物质)、泪液脂联素(保护眼睛不受细菌半胱氨酸蛋白酶影响)等。免疫防御主要包括免疫细胞[38],如中性粒细胞、淋巴细胞及分泌型IgA、补体C3等,可以防御微生物侵入眼表。但在感染、配戴隐形眼镜等一系列风险因素的作用下,微生物防御系统被破坏,这可能进一步导致微生物在眼表的增殖,造成眼表微生物群构成改变,破坏原有正常微生物群的保护作用[39]。
基于16S rDNA技术,研究者对细菌性角膜炎患者的结膜拭子和角膜刮片进行分析,发现眼表微生物群发生显著变化,α多样性与健康人存在显著差异,且一些致病菌属如链球菌属、葡萄球菌属、棒状杆菌属、甲基杆菌属相对丰度显著升高[40]。配戴隐形眼镜已被认为是干眼、巨乳头型结膜炎等眼部疾病的危险因素。Shin等[41]通过对隐形眼镜配戴者的眼部微生物群检测,发现甲基杆菌属、乳酸杆菌属、不动杆菌属、假单胞菌属丰度较高,而这些菌属往往是感染性角结膜炎的致病菌。
虽然眼表微生物失调引起疾病的具体机制目前尚不明了,但肠道微生物失调引起炎性肠病[42]等疾病的机制已有可喜发现。在肠道微生物失调时,导致某些细菌相对丰度的增加或减少,随之这些细菌的代谢产物也会发生相应变化。一些重要的代谢产物在维持免疫系统的平衡方面具有重要作用,如短链脂肪酸(short-chain fatty acids,SCFA)[43],其作为一类菌群的代谢产物,可与Ffar2编码的GPR43受体结合,通过组蛋白去乙酰化酶抑制剂的作用,影响结肠Treg细胞(调节性T细胞)。Treg细胞是抑制肠道炎症的关键细胞,其可抑制异常激活的免疫反应并维持肠道免疫耐受,但在炎性肠病患者中,Treg细胞水平明显下降[44]。同样的细菌代谢物也在肥胖症的发生发展中具有重要作用[40]。此外,肠道微生物可以影响B细胞、巨噬细胞及树突状细胞而参与疾病进程[38]。
虽然眼表疾病中发生失调的微生物类型与上述研究不同,但对于微生物失调如何导致疾病的机制或许在两者中存在类似之处。因此未来对于眼表微生物失调的机制研究或许可以借鉴对肠道微生物的研究思路。
4 结语
健康眼表的微生物群有助于预防感染,具有刺激和调节先天和适应性免疫的能力,并为免疫系统提供了一种指示,使免疫屏障不断得到加强,为维持自身新陈代谢和阻止病原体的入侵提供了必要环境。虽然目前已有相当多的研究对正常及各种眼表疾病中眼表微生物群的变化进行描述,但仍有很多问题需要继续探索。目前多数研究仍主要集中在细菌菌群的变化,对于眼表真菌菌群的研究只在AC中有部分体现;同时,对微生物失调与疾病发生发展之间关系的机制研究还远远不够。为了揭示这些科学问题,今后仍需进行包括更大样本受试者、相对标准化的实验技术与评价体系的多中心研究,从而推动该领域研究以获得更有价值的发现。
