基于二代测序技术的玉米内标准基因扩增子的筛选与评估
2023-11-07陈利红周俊飞梁晋刚李甜甜王颢潜方治伟
陈利红,周俊飞,梁晋刚,李甜甜,王颢潜,方治伟,陈 红,*,彭 海,*
(1.江汉大学生命科学学院,湖北 武汉 430056;2.农业农村部科技发展中心,北京 100176)
玉米(Zea mays)是世界三大粮食作物之一,也是重要的饲料作物,是世界农业生产中的重中之重。玉米产业的健康发展对保障国家粮食安全和农产品有效供给具有重要意义[1]。目前玉米已成为我国面积最大、总产最多的作物,但是玉米生长过程中极易受到外界环境及各种病虫害的干扰,严重影响其品质和产量[3];而传统的杂交育种技术因耗时长、效率低、需要大量人力物力,已经难以满足玉米产业快速发展过程中对优良品种的迫切需求[2]。因此人们开始利用基因工程手段将外源基因导入玉米中,以提高玉米对环境与病虫害的耐受性。然而转基因技术在生产中产生巨大经济效益与社会效应的同时,其安全问题也引起了人们的广泛关注[3-4]。为了充分保障消费者的知情权,各个国家与组织机构要求企业对生产的转基因产品进行标识[5]。目前国际上对于转基因标识的管理主要分为四大类:一是如美国、加拿大、阿根廷等国家采取自愿标识;二是如欧盟[6]、巴西等国家实行定量全面强制标识[7],即对所有产品只要其转基因成分含量超过一定的阈值就必须标识;三是如日本采取定量部分强制性标识,即对特定类别产品实行超过规定的阈值就必须标识,四是如我国是采取定性按目录强制标识,即凡是列入目录的产品,只要含有转基因成分就必须标识。
转基因产品“标识阈值”的实施尤其需要对样品中的转基因成分进行定量检测[8]。在转基因定量检测过程中,需要对样品基因组DNA含量或拷贝数目、转入外源基因的拷贝数目进行计算,进而获得样品的转基因含量,这个过程需要对植物的内标准基因与转入的外源基因进行有效扩增。因此内标准基因对样品转基因成分的定性定量检测显得尤为重要,其扩增区域、扩增效果将直接影响转基因成分检测的准确性[9]。对于转基因农产品的检测,内标准基因是指植物中具有种内非特异性、种间特异性与基因组上拷贝数低且拷贝数恒定的一类基因,这类基因在不同品种(品系)之间异质性低[9]。转基因植物及其相关农产品的成分来源、实验系统的可靠性与稳定性、混合样品中的转基因含量的计算均需通过对内标准基因的检验实现[10-12],因此内标准基因及其扩增区域的筛选对于获得可靠的实验结果至关重要。
目前,已有多个内标准基因用于转基因植物的实时聚合酶链式反应(real-time polymerase chain reaction,realtime PCR)检测系统中,如水稻(Oryza sativa)的蔗糖磷酸合成酶基因(sucrose phosphate synthase,SPS)[13]、根部表达基因(rice root-specific gene,gos9)[14]、磷脂酶D基因(phospholipase D,PLD)[8]、磷酸果糖激酶基因(ppi phosphofructokinase,ppi-PPF)[9],玉米的转化酶基因(invertase,IVR)[15]、醇溶蛋白基因(zein)[16]、玉米淀粉合成酶II(Zea maysstarch synthase isoform zSTSII-2,zSSIIb)[17]、乙醇脱氢酶基因(alcohol dehydrogenase,ADH1)[15]、高迁移率族蛋白基因(high mobility group protein,HMG)[18],大豆(Glycine max)的凝集素基因(lectin)[19]、热休克蛋白基因(heat shock proteins,HSP)[20],小麦(Triticum aestivum)的乙酰辅酶A羧化酶基因(acetyl-CoA carboxylase,ACC1)[21],还有其他物种的泛素结合酶基因(ubiquitin-protein ligase,E3-UBI)[22]等。近年来全球范围内转基因生物(genetically modified organisms,GMO)和未授权的GMO数量日益增多,特征也越来越多样化,给现在转基因检测金标准real-time PCR检测技术带来了巨大的挑战。如传统的real-time PCR技术一次只能实现检测一个靶标,需要多次扩增和检测才能满足多靶标转基因成分检测的需求,而新兴的二代测序技术弥补了该传统技术的缺陷[22-27],显著提高了检测效率。目前尚鲜见基于二代测序技术的玉米内标准基因扩增子筛选、评估方面的研究与报道。本研究基于现有文献中报道的玉米、水稻、大豆等植物中的内标准基因及其定义,从玉米基因组中选择7 个候选内标准基因,共设计13 个扩增区域(扩增子),利用二代测序技术对这些内标准基因的扩增子进行种内一致性、种间特异性等系统性评估,进而为后续利用二代测序技术对转基因玉米的定量检测提供合适的内标准基因扩增子。
1 材料与方法
1.1 材料与试剂
供试的208 个常规玉米品种或品系(表1)由农业农村部科技发展中心提供。其他非玉米物种水稻(5 个样品)、棉花(Gossypiumspp.,3 个样品)、大豆(4 个样品)、花生(Arachis hypogaea,1 个样品)、西瓜(Citrullus lanatus,2 个样品)、黄瓜(Cucumis sativusL.,2 个样品)、甜瓜(Cucumis melo,2 个样品)、番茄(Lycopersicon esculentum,2 个样品)、辣椒(Capsicum annuumL.,2 个样品)、白菜(Brassica pekinensis,2 个样品)的DNA为本实验室保存。

表1 常规玉米品种(品系)信息Table 1 Information about common maize varieties (lines) tested in this study
多重扩增建库试剂盒(GP000505)石家庄博瑞迪生物技术有限公司;植物D N A 提取试剂盒(DP320)、λDNA/HindIII Marker、DNA Marker I、D2000 DNA Marker 北京Tiangen生化科技有限公司;Qubit dsDNA检测试剂盒(Q33230)美国Thermo Fisher公司;所有分离用有机溶剂均为国产分析纯。
1.2 仪器与设备
Nanodrop 2000微量紫外分光光度计、Qubit 4.0核酸定量仪、Qubit 2.0荧光计 美国Thermo Fisher公司。
1.3 方法
1.3.1 DNA提取与定量
待检样品叶片用液氮充分研磨后,用天根植物DNA提取试剂盒(DP320)按照其说明书进行基因组DNA提取。用Qubit 4.0核酸定量仪检测DNA浓度,用1%琼脂糖凝胶检测DNA质量。
1.3.2 内标准基因的选择与引物设计
根据文献中或者国家标准中报道的常用内标准基因、内标准基因的定义及玉米基因组序列,本研究共选择7 个候选基因用于后续研究。引物设计与合成由博瑞迪生物技术有限公司完成。引物信息见表2。

表2 研究所用的引物及其相关信息Table 2 Information about primers used in this study
1.3.3 扩增子文库构建与测序
按照石家庄博瑞迪生物技术有限公司的建库试剂盒GenoPlexs Multiplex-PCR Library Prep Kit for MGI说明书(GP000505)进行建库,具体过程如下:取50~200 ng基因组DNA(稳定性和检出丰度比较分析所用的样品DNA起始量均是200 ng/样品,其他的样品若DNA量足够的话,也尽量使每个样品的起始DNA量为200 ng),用设计的多重引物对样品中目标序列进行第1轮PCR扩增。扩增体系为30 μL,多重扩增引物(每条引物0.2 μmol/L):4 μL,基因组DNA:50~200 ng,GenoPlexs 3×T Master Mix:10 μL,用ddH2O补足到30 μL,然后按照表3进行PCR扩增。其扩增产物用磁珠法进行目标片段筛选后再进行第2轮PCR扩增,第2轮扩增时为每个样品加上不同的测序条形码(Barcode)。扩增体系为30 μL,GenoPlexs 3xT Enzyme mix:10 μL,P5 Barcode:2 μL,P7 Barcode:2 μL,ddH2O:16 μL,按照表4进行扩增。最后纯化获得扩增子建库文库,该建库过程经过适当调整以匹配Illumina平台,文库经质检合格后进行测序。文库质检首先用2%琼脂糖凝胶电泳检测,然后用Qubit对文库浓度进行检测,符合文库片段大小及文库质量浓度在10 ng/μL以上由南京诺禾致源生物信息科技有限公司进行PE150测序(NovaSeq 6000)。

表3 文库构建的第1轮PCR扩增条件Table 3 Conditions of first round of PCR amplification for library construction

表4 文库构建的第2轮PCR扩增条件Table 4 Conditions of second round of PCR amplification for library construction
1.3.4 普通PCR验证
对zSSIIb-1扩增子检出reads数目高低不一的8 个样品(M000265、M019298、M019325、M019314、M000036、M016228、M019142和M019143)进行普通P C R 验证,P C R 产物用1%琼脂糖凝胶电泳进行检测。PCR扩增体系20 μL,zSSIIb-1上下游引物(10 μmol/L)各0.5 μL、基因组DNA 20 ng,2×Prime Star GC Buffer 10 μL、2.5 mmol/L的dNTP mix 2 μL、TaKaRa Prime StarTaq酶0.2 μL用ddH2O补足到20 μL,然后按照表5进行PCR扩增。大豆lectin基因是以大豆4 个样品文库构建的第1轮PCR产物为模板(0.5 μL),利用文献[19]报道的大豆lectin内标准基因的引物(F:TGGGACAAAGAAACCGGTAG,R:GTCAAACTCAACAGCGACGA,扩增长度201 bp)及PCR扩增条件进行扩增与电泳检测。其中,zSSIIb-1扩增子与lectin内标准基因的PCR验证均以H2O作为空白对照。

表5 zSSIIb-1基因普通定性PCR条件Table 5 Conditions for qualitative PCR amplification of the zSSIIb-1 gene
1.3.5 测序数据分析
下机的测序数据经过以下几个步骤分析进而获得归一化的内标准基因扩增子测序序列数目,1)根据Barcode序列和各扩增子引物序列从下机数据中拆分出各样品数据,Illumina接头序列使用Cutadapt v1.8.1去除;2)使用FLASH(V1.2.7,http://ccb.jhu.edu/software/FLASH/)对每个样品的reads进行拼接,得到拼接序列,其中拼接成功与未拼接成功的序列统称为原始Tags数据(Raw Tags);3)将这些原始的Raw Tags,利用FASTXtoolkit v0.014(http://hannonlab.cshi.edu/fastx_toolkit)去除低质量的序列(序列质量Q20值<20),得到高质量的Tags数据(Clean Tags);4)将Clean Tags比对到玉米参考基因组序列上,并确定每个扩增子的原始reads数目;5)最后把所有样品按照测序1000000 条reads,每个内标准基因200 bp长度进行归一化处理,进而获得每个样品中每个扩增子的测序reads数目,即为每个扩增子的检出丰度。单个样品中每个扩增子若有一条测序read检出,则认为该扩增子在此样品中被检出,每个扩增子的检出率为该扩增子检出样品的数目占所有样品中的百分比。
1.3.6 内标准基因扩增子的种内一致性、种间特异性、保守性、稳定性与动态检测范围分析
分别用208 个常规玉米样品与10 个非玉米物种进行内标准基因扩增子的种内一致性与种间特异性评估。种内保守性是通过分析这些内标准基因扩增子在所测试的208 个常规玉米样品中的拷贝数目及单核苷酸多态性(single nucleotide polymorphism,SNP)数目进行评估。然后用建库DNA起始量相等的25 个常规玉米测试所选内标准基因扩增子的稳定性,利用geNorm[28]和NormFinder[29]分析软件并参考相关文献[30-31]对这些扩增子进行评估,其中,最优内标准基因扩增子数量采用geNorm软件对配对扩增子变异系数进行分析完成。内标准基因扩增子的动态检测范围分析按照以下步骤进行,将5 个常规玉米品种(未知1、四单154、承单15、铁D9125和未知2)的DNA(每个样品起始DNA量为200 ng),依次稀释1、50、100、500 倍和1000 倍进行文库构建与测序分析以获得每个内标准基因各扩增子的检出丰度,进而确定所筛选的内标准基因各扩增子的动态检测范围。
2 结果与分析
2.1 所选内标准基因的引物设计与拷贝数分析
根据文献中或者国家标准中报道内标准基因及其定义,共筛选7 个内标准基因,分别为zSSIIb、zein、ADH1、IVR、HMG、E3-UBI和HSP70。为了确定同一个内标准基因不同的扩增区域是否对其检出有影响,每个内标准基因拟计划设计2 对引物。设计结果显示除了IVR只设计出 1对引物外(该基因设计的另外一对引物和引物组的其他引物容易形成二聚体),其他基因均设计出2 对引物,因此共有13 个扩增子区域。利用在线BLAST程序对这7 个内标准基因的13 个扩增子进行拷贝数分析,发现这些内标准基因的13 个扩增子在玉米基因组上均只有1 个拷贝(表2)。
2.2 种内一致性、检出丰度与种间特异性分析
通过对待检的208 个玉米样品进行建库、测序与分析,发现IVR(京BD123096、京BD122945)与HSP70-1扩增子(雅玉98和增玉1572)均只有两个样品没有被检出(图1),检出率为99.0%;zein-2扩增子在11 个样品中(伟科7、京BD123096、京BD122314、京BD121602、京BD124360、京H113417、京H101662、京BD122945、锦华336、冀植选3和高诱2号)没有被检出,检出率为94.7%;而剩余的10 个扩增子在所有样品中均有不同丰度的检出,检出率为100%;说明这些扩增子在玉米种内的一致性均较好。

图1 13 个扩增子在208 个样品中的检出率(A)与检出丰度(B)Fig.1 Detection rates (A) and abundance (B) of 13 amplicons in 208 samples
此外用建库起始DNA量相等(200 ng)的25 个玉米品种对所选7 个内标准基因的13 个扩增子进行检出丰度分析。结果显示每个内标准基因的各扩增子在所有样品中均被检出(图2),同一个内标准基因,除了ADH1内标准基因的两个扩增子ADH1-1和ADH1-2检出丰度相对比较接近外,其他5 个内标准基因的2 个扩增子检出丰度均有一定差异,说明同一个内标准基因的不同扩增子检出丰度有差异。在13 个扩增子中,zSSIIb-1检出丰度最高,其次为E3-UBI-1、HSP70-2和zein-1,它们检出丰度均变异较大,而zein-2、ADH1-1、ADH1-2、HMG-2、E3-UBI-2与HSP70-1的变异较小(标准偏差均在100以内)。从检出率及检出丰度高低看,zSSIIb-1作为内标准基因相对较好,但其在各样品的检出丰度变异较大。为了验证丰度变异较大的zSSIIb-1扩增子在普通琼脂糖电泳图上的目标条带亮度是否差异较大,用zSSIIb-1引物对检出丰度高低不一的8 个样品进行普通PCR验证,发现zSSIIb-1检出丰度在2000~3000 条reads的样品,其PCR产物在琼脂糖凝胶上的条带亮度差异并不大(图3),因此直接通过琼脂糖电泳图无法精准确定各扩增子的检出丰度。

图2 13 个扩增子在建库DNA起始量相等的25 个样品中的检出丰度箱线图及散点图Fig.2 Boxplot and scatter plot of the detected abundance of the 13 amplicons in 25 samples with equal initial amount of DNA for library construction
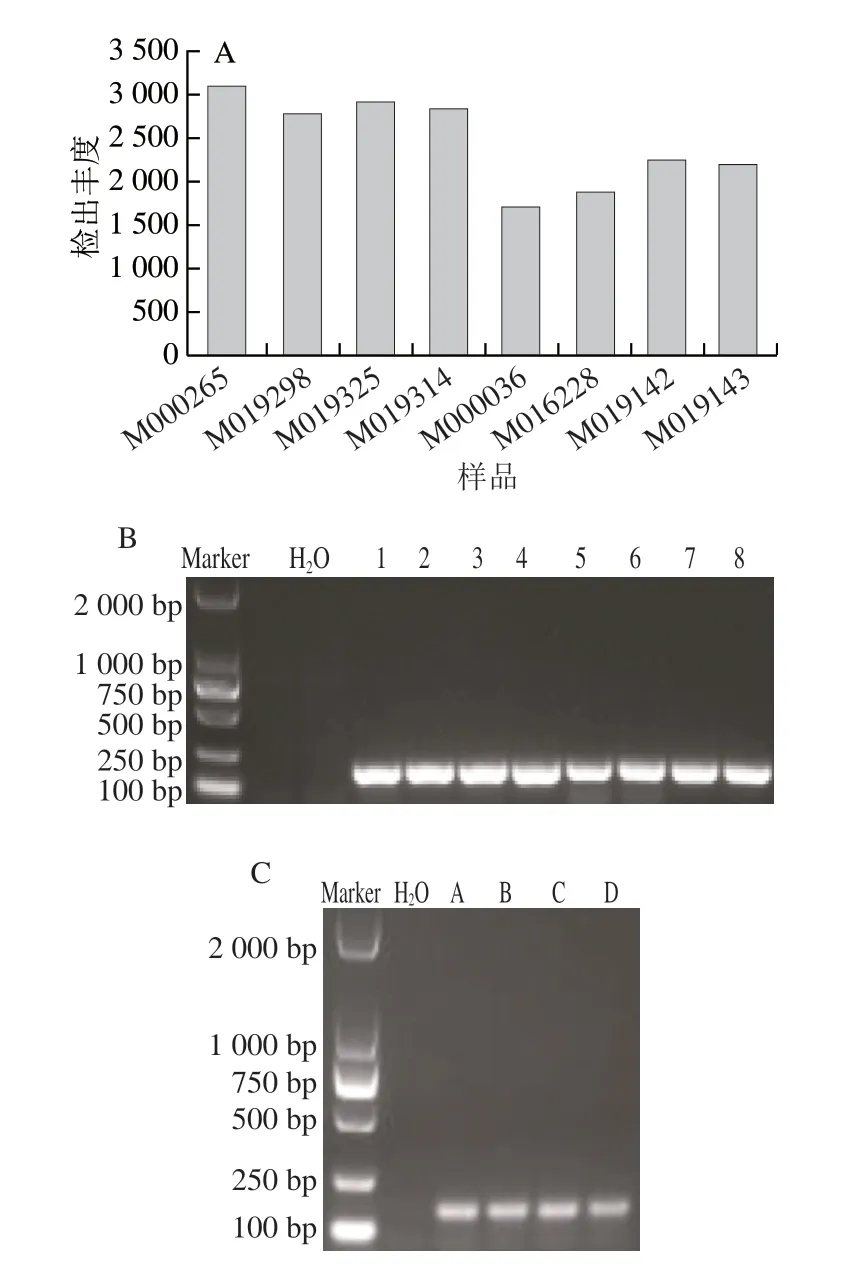
图3 玉米zSSIIb-1扩增子在8 个样品中的检出丰度(A)及定性PCR验证(B)和大豆lectin基因的PCR验证(C)Fig.3 Detected abundance of zSSIIb-1 amplicon (A) and qualitative PCR validation (B) in eight samples,and PCR validation of soybean endogenous reference gene lectin (C)
利用其他非玉米样品如水稻(5 个样品)、棉花(3 个样品)、大豆(4 个样品)、花生(1 个样品)、西瓜(2 个样品)、黄瓜(2 个样品)、甜瓜(2 个样品)、番茄(2 个样品)、辣椒(2 个样品)、白菜(2 个样品)10 个非玉米物种的25 个样品,对这些内标准基因的扩增子进行种间特异性评估,结果发现这25 个样品均未建库成功,理论上来讲这是由于建库所用的引物是针对玉米内标准基因特异设计而造成。为了排除建库的问题,以大豆4 个样品的第一轮PCR产物为模板,利用文献报道的大豆内标准基因引物进行PCR扩增与电泳检测,结果发现大豆的4 个样品均能扩增出lectin基因的目标条带,排除了建库的问题,充分说明了所选内标准基因扩增子的种间特异性。
2.3 种内保守性分析
通过测序分析每个内标准基因的扩增子序列,可以获得每个扩增子在各样品中的拷贝数目是否和理论值一致,同时确定其是否含有SNP或者插入缺失序列(insertion-deletion,InDel)。分析结果显示:这7 个内标准基因的13 个扩增子在各样品中的拷贝数目确实和理论值一致,均只有一个拷贝。zein-1与IVR既含有SNP也含有InDel,而E3-UBI-1与之相反,两者均无,HMG-2只含有1 个InDel,剩余的其他扩增子序列均含有1~11 个SNP(表6)。内标准基因应选择种内保守性较好的基因,如本研究E3-UBI内标准基因的E3-UBI-1扩增子。对于含有较密集SNP或者InDel的扩增子,若后续研究用其作为内标准基因并自己设计引物时,不仅要考虑扩增子的长度,还需注意避开这些SNP或者InDel位置,以免影响其扩增效率或检出率。如本研究中的IVR,其扩增长度较长263 bp,内部又含有SNP和InDel,可能是导致其检出丰度较低、稳定性差的原因。

表6 内标准基因扩增子保守性分析的相关参数Table 6 Parameters of intraspecies conservation of amplicons of endogenous reference genes
2.4 稳定性分析
2.4.1 geNorm分析内标准基因扩增子的稳定性
geNorm软件通过计算每个内标准基因在不同样品中检出丰度的稳定性值(M值)确定其稳定性,M值越小说明内标准基因的稳定性越高,反之则越低。geNorm软件通常会将稳定性M值低于1.5的基因作为内标准基因。利用geNorm软件对所筛选的7 个内标准基因的13 个扩增子的稳定性进行分析。结果显示这7 个内标准基因的13 个扩增子的M值均小于1.5,说明它们均可选为内标准基因(图4),其中最稳定的是扩增子ADH1-1与ADH1-2,最差的是IVR。

图4 geNorm分析13 个扩增子的稳定性(A)及其最佳配对数目(B)Fig.4 Analysis of stability (A) and optimal pair number (B) of 13 amplicons using geNorm
geNorm软件还可通过计算内标准基因的配对变异系数(pairwise variation value,Vn/Vn+1)确定内标准基因的最佳数目。通常以0.15作为临界值确定内标准基因的最适数量。如果配对变异系数小于0.15,表明n个内标准基因已经稳定,无需引入第(n+1)个内标准基因,即能够满足相对定量的要求,反之亦然。分析结果表明在测试稳定性的扩增子中,最稳定的两个扩增子为ADH1-1与ADH1-2,配对变异系数V2/V3小于0.15,表明选择这2 个扩增子即可满足定量检测的需求。
2.4.2 NormFinder分析内标准基因扩增子的稳定性
NormFinder与geNorm类似,也是通过计算内标准基因检出丰度的M值评价内标准基因的稳定性,M值越小则其稳定性越高。NormFinder分析结果显示,ADH1-2扩增子的稳定性最高,IVR最差(表7),该结果与geNorm软件的分析结果一致。此外这两个软件的分析结果显示,M值排序从第8个开始,后面6 个扩增子的排序都一样。
2.5 内标准基因扩增子的动态检测范围
内标准基因的动态检测范围分析结果显示这些内标准基因的扩增子除HSP70-1在1 个样品(M000036的1000 倍稀释,DNA总量0.2 ng)中没有检出外,其余扩增子在DNA量检测下限为0.2 ng时,均能被检出,说明所选内标准基因的检测灵敏度较高(图5)。具体地,在所测5 个玉米品种(品系)的各稀释梯度,IVR、HSP70-1、E3-UBI-2与HMG-2检出丰度较低(绝大数小于100 条reads),并且这4 个扩增子在各个品种(品系)的不同稀释梯度的检出丰度几乎无差异;与IVR、HSP70-1、E3-UBI-2和HMG-2的相反,zSSIIb-1扩增子的检出丰度较高(最低为337,平均值1640.852),zein-1、zein-2、zSSIIb-2、ADH1-1、ADH1-2、HMG-1、E3-UBI-1与HSP70-2检出丰度相对次之,但这9 个扩增子的检出丰度均不随样品DNA的稀释梯度的变化而成比例变化。这样进行转基因成分定量时,选择不同的内标准基因会呈现不同的检测结果,尤其对混杂不同物种的转基因样品(如食品中混了不同浓度的转基因玉米和大豆)进行检测时,定量检测将变得更复杂,需要联合几个内标准基因,并利用标准品设置矫正系数才能对样品中的DNA含量或转基因成分进行精准定量。
3 结论
转基因玉米非常容易通过非法途径混入我国食品市场,这不仅会对消费者的食用安全造成威胁,还可能会因此扰乱我国在转基因食品上的监管。转基因产品的监管、检测以及作物成分的鉴定均要以内标准基因为基准,因此内标准基因及其扩增区域的筛选与评估显得尤为重要。到目前为止,已开发的玉米内标准基因有ADH1[15]、IVR[15]、zein[16]、zSSIIb[17]、HMG[18]。zSSIIb是我国转基因玉米检测标准中较常用的,而ADH1基因是欧盟转基因玉米检测标准中常用的。本研究利用二代测序技术对上述几个常用的玉米内标准基因及其他植物中报道的两个内标准基因在玉米中同源物(E3-UBI和HSP70)的扩增子进行了种内一致性、保守性、种间特异性、检出丰度及动态检测范围进行评估。
通过对所选的7 个内标准基因13 个目标扩增区域的高通量测序数据分析发现,这13 个扩增子在208 个样品中的检出率为94.7%~100%,而在非玉米的水稻、大豆、棉花、白菜等物种中均无法被有效检出,说明这些内标准基因的种内高度一致性与种间的高度特异性。其中zSSIIb-1检出丰度最高,其次为E3-UBI-1、HSP70-2和zein-1,IVR检出丰度最低,然而zSSIIb-1检出丰度在各个样品中变异较大,这可能与设计的扩增子引物区域的保守性、扩增子长度、引物扩增效率及样品DNA浓度等多种因素有关。其中引物的保守性及扩增子的长度可能对扩增子的检出丰度影响更大,如本实验所选的E3-UBI-1扩增子非常保守,既没有SNP,也没有InDel,其检出丰度相对较高;而IVR与之相反,两者均有,加上测序长度单端只有150 bp,致使IVR在检测的所有样品中的检出丰度均较低,因此建议若后续使用IVR作为内标准基因时,可考虑重新设计引物,并且引物不要设计在含有SNP和InDel的区域,扩增长度短些。
此外,本研究还利用geNorm和NormFinder软件分析了7 个内标准基因13 个扩增子的稳定性,分析结果均表明最稳定的内标准基因扩增子是ADH1-2,最不稳定的是IVR。动态检测范围分析结果显示,检出丰度稳定性最好的ADH1-2与种内最保守的E3-UBI-1扩增子在文库构建的DNA用量检测下限为0.2 ng时,均还能在样品中被稳定检出。因此从种内保守性与检出稳定性综合看,利用扩增子测序法对转基因产品进行检测时,优选E3-UBI-1与ADH1-2这两个扩增子相对较好。但具体这些内标准基因扩增子如何组合才能精准定量玉米产品中的转基因成分,目前研究团队还在攻关中。
