橙皮苷药理作用及机制的研究进展
2023-11-07黄清杰李喜香王雪梅
杨 萍,黄清杰,李喜香,宋 薇,王雪梅
橙皮苷药理作用及机制的研究进展
杨 萍,黄清杰,李喜香,宋 薇,王雪梅
甘肃省中医院,甘肃 兰州 730050
橙皮苷广泛存在于柑橘属、芸香科、茜草科、唇形科、十字花科植物果实或根茎中,是一种二氢黄酮类化合物,也是中药陈皮、枳实、枳壳、款冬花等的主要药效成分,属于维生素P类药,可增强毛细血管的韧性、缩短出血时间,临床多用于心血管系统疾病的辅助治疗,在食品工业中可用作天然抗氧化剂,也可用于化妆品行业。现代药理研究表明橙皮苷具有抗炎、抗氧化、保护心血管系统、抗糖尿病并发症、抗菌、抗肿瘤、提升免疫力、保护神经系统等多种生物学活性,因此,通过对橙皮苷的药理作用及机制进行归纳总结,以期为其临床应用及药物开发提供依据。
橙皮苷;抗炎;抗氧化;心血管系统;抗菌;抗肿瘤
橙皮苷别名陈皮苷、橘皮苷、川陈皮素等,是一种天然酚类化合物,为二氢黄酮衍生物,具有双氢黄酮氧苷结构,呈弱酸性,为白色针状结晶,是中药陈皮、枳实、枳壳、款冬花等的主要有效成分,由于其溶解度低,极大地限制了其在医学、食品领域中的应用[1]。现代研究发现橙皮苷在提高人体免疫力、抗炎、抗菌、抗病毒、保护心血管系统等方面具有重要作用[2],已成为一种新的潜在治疗剂。目前,橙皮苷在医药食品行业有一定的应用,但效果并不显著,这主要与其难溶于水,不溶于脂溶性溶剂的特性有关[3],口服后需经肠道微生物发酵转化为单糖苷或苷元等成分发挥药效,存在生物利用度低等问题[4],因此,通过查阅文献,对橙皮苷的药理作用及机制进行梳理总结,为其后续进一步开发利用提供理论依据。
1 抗炎
炎症在多种疾病的发病机制中具有重要作用,包括慢性炎症性疾病,如类风湿性关节炎、炎症性肠病、过敏和哮喘,此外,还涉及心血管疾病、代谢疾病、神经退行性疾病和认知能力下降[5]。橙皮苷可减少关节炎大鼠足趾肿胀和关节炎评分,改善红细胞和血小板计数及血红蛋白和血细胞的比值,显著降低血清γ干扰素和白细胞介素-4(interleukin-4,IL-4)水平[6]。Heo等[7]发现橙皮苷100 mg/kg可减少脊髓损伤大鼠神经病理学变化及促炎因子肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)、IL-1β表达,可能通过核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)/血红素加氧酶-1通路发挥抗炎作用。Xiao等[8]发现橙皮苷改善人间充质干细胞(mesenchymal stem cell,MSC)的自我更新能力和软骨形成,调节炎症因子γ干扰素、IL-2、IL-4和IL-10分泌,表明橙皮苷可作为治疗剂通过抑制炎症促进软骨组织修复来有效促进MSC的软骨形成。橙皮苷可减轻炎症细胞向气道的募集,减少二氯甲烷和IL-12的产生,可通过调节炎症反应来保护机械通气小鼠的肺部[9]。Adefegha等[10]发现橙皮苷40、80 mg/kg可减轻关节炎大鼠的炎症,降低血浆髓过氧化酶(myeloperoxidase,MPO)活性及血清硝酸盐、亚硝酸盐水平,调节血小板外泌酶活性和血清嘌呤水平,减轻细胞内活性氧,调节腺苷核苷酸和核苷水解酶表达,减弱细胞凋亡过程并激活细胞周期阻滞,表明橙皮苷可能是一种天然抗炎化合物,可用于治疗关节炎。橙皮苷20 mg/kg可显著抑制脂多糖诱导的炎症介质基因表达,缓解抗原诱导的关节炎,降低成纤维细胞样滑膜细胞中基质金属蛋白酶3(matrix metalloproteinase 3,MMP3)、MMP9和MMP13水平,并抑制巨噬细胞向M1的极化,表明橙皮苷具有显著的抗炎活性,可能通过抑制磷脂酰肌醇3-激酶/蛋白激酶B信号通路治疗类风湿性关节炎[11]。综上,橙皮苷抗炎作用显著,其作用机制可能是抑制促炎因子分泌,减轻炎症反应,抑制炎症信号通路等。
2 抗氧化
自由基与有机底物如脂质、蛋白质和DNA发生反应,通过氧化破坏这些分子,扰乱其正常功能,因此可能导致各种疾病[12]。橙皮苷显著提高应激剂H2O2或百草枯处理的酿酒酵母超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)及其缺陷菌株的真核细胞中自由基1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)水平,其功效与奎诺二甲基丙烯酸酯(trolox)相似,可提供强大的细胞抗氧化保护作用[13]。Elavarasan等[14]发现橙皮苷100 mg/kg可增强老年大鼠SOD、CAT、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷胱甘肽还原酶(gluathione reductase,GR)和6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenease,G6PD)活性,恢复心脏中的非酶抗氧化剂(谷胱甘肽、抗坏血酸、α-生育酚)水平,降低过氧化脂质(lipid peroxidation,LPO)及蛋白质羰基化合物水平,上调心肌组织SOD、CAT及Nrf2表达,下调Kelch样ECH关联蛋白1(Kelch-like ECH-associated protein 1,Keap1)表达,表明橙皮苷可用于保护心肌细胞免受Nrf2上调介导的与年龄相关的氧化应激增加,提高细胞抗氧化状态。橙皮苷10 μg/mL表现出比抗坏血酸和trolox等更大的自由基清除活性,不同浓度H2O2处理后发现橙皮苷2.5 mmol/L可将pBR322 DNA的开放环状形式(oc)转化为超卷曲(ccc)形式,10 μg/mL可防止膜损伤,表明橙皮苷是一种有价值的抗氧化剂,可保护pBR322 DNA和红细胞膜免受自由基诱导的氧化损伤[15]。Ali等[16]发现橙皮苷10 mg/kg可显著减轻紫杉醇引起的雄性Wistar大鼠氧化应激,降低肾脏和心脏脂质过氧化水平,增加谷胱甘肽含量及SOD和GSH-Px活性,表明橙皮苷可能通过抑制氧化应激和增强抗氧化防御来对抗肾脏和心脏功能障碍及组织病理学变化。橙皮苷200 mg/kg可减弱CCl4诱导的大鼠肝脏和肾脏脂质过氧化水平,显著改善谷胱甘肽消耗,提高SOD及CAT水平,表明橙皮苷对CCl4诱导的大鼠肝脏和肾脏氧化应激的保护作用与其直接的抗氧化作用有关[17]。综上,橙皮苷抗氧化机制可能为上调SOD、CAT、GSH-Px、GR、DPPH水平,减轻氧化应激,增强抗氧化防御等。
3 对心血管系统的保护作用
心血管疾病是世界上首位死亡原因,约占全世界所有死亡人数的31%[18]。其病因复杂且涉及遗传、疾病状况和生活方式等因素[19]。橙皮苷在心血管疾病模型中显示出预防血脂异常和动脉粥样硬化(atherosclerosis,AS)的作用,在高血压模型中显示出抗高血压和抗氧化作用[20],然其临床报道资料较少,仍需进一步完善。
3.1 降血压
高血压以动脉压升高为特征,主要表现为肌层增厚和内膜增生,并伴有动脉壁的透明质状样改变和弹性层增生[21]。给予雄性高血压大鼠橙皮苷20、40 mg/kg 4周,发现橙皮苷可呈剂量相关性降低血压,下调主动脉组织中受体蛋白表达,抑制氧化应激标志物和酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase,NOX),恢复血浆一氧化氮代谢物水平,其抗高血压作用可能与减少肾素-血管紧张素系统级联诱导的NOX2过度表达和交感神经兴奋有关[22]。给予自发性高血压大鼠橙皮苷8周可显著预防高血压并抑制主动脉中NOX亚基和血栓烷A2合酶mRNA表达,其代谢物橙皮素可减少主动脉中血栓素B2的释放,表明橙皮苷可通过调节与血管张力相关的基因表达来预防高血压[23]。橙皮苷可通过抗氧化作用调节一氧化氮的失活,保护内皮功能免受活性氧的影响,显著抑制自发性高血压大鼠的血压升高,表明橙皮苷可能通过增加一氧化氮的生物利用度改善内皮功能防治高血压[24]。橙皮苷可抑制-硝基--精氨酸甲酯盐酸盐诱导的大鼠高血压和血管障碍,降低血清血管紧张素转换酶活性和血浆转化生长因子-β1(transforming growth factor-β1,TGF-β1)水平,可能与抑制肾素-血管紧张素系统的激活,减少氧化应激有关[25]。综上,橙皮苷可能通过调节血管张力,减轻氧化应激,改善内皮功能,抑制肾素-血管紧张素系统的激活防治高血压。
3.2 调节血脂
高脂血症直接影响心脏的收缩功能和心脏电生理反应,是AS和心血管疾病的主要原因之一[26]。Kumar等[27]给予高脂血症模型大鼠橙皮苷100 mg/kg,持续30 d,结果发现血脂应激和氧化还原失衡减轻,表明橙皮苷对高血脂大鼠具有保护作用。橙皮苷可显著增加正常血脂大鼠和高脂血症大鼠高密度脂蛋白(high density lipoprotein,HDL)含量,下调血浆总胆固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、总脂质和三酰甘油(triglyceride,TG)水平,具有调节血脂活性的作用[28]。橙皮苷50 mg/kg可显著恢复大鼠体内升高的胆固醇/磷脂的值,改善高胆固醇血症,其机制可能与稳定高胆固醇血症大鼠肝脏中的溶酶体有关[29]。综上,橙皮苷对正常血脂及高脂血症均有调节血脂作用,其作用机制可能为减轻氧化应激,调控DL、TC、总脂质及TG水平等。
3.3 抗AS
AS是导致心血管疾病发病率和死亡率升高的主要原因。脂蛋白水平的变化,尤其是LDL或其变体,及炎症标志物的变化是AS的危险因素[30]。橙皮苷改善高脂饮食引起的体质量增加和胰岛素抵抗及高脂血症,抑制肝脂肪变性、AS斑块面积和巨噬细胞泡沫细胞形成,下调乙酰辅酶A羧化酶α(acetyl CoA carboxylase,ACCα)和脂肪酸合成酶(fatty acid synthase,FAS)表达,上调肝ATP结合盒转运蛋白G8(ATP binding cassette transporter G8,ABCG8)、巨噬细胞ABCA1和ABCG1表达,调控抗氧化酶活性和炎症因子表达,表明橙皮苷通过改善胰岛素抵抗及脂质分布、抑制巨噬细胞泡沫细胞形成、抗氧化、抗炎减少AS[31]。Koga等[32]指出橙皮苷抑制伐尼克兰对载脂蛋白E敲除小鼠的整个主动脉、主动脉弓和主动脉根部的加重作用,通过上调小鼠单核巨噬RAW264.7细胞中ABCA1和ABCG1胆固醇流出转运蛋白表达,下调清道夫受体CD36和血凝素样氧化低密度脂蛋白受体-1(lectin-like oxidized low density lipoprotein receptor-1,LOX-1)表达,减少巨噬细胞中氧化低密度脂蛋白(oxygenized low density lipoprotein,oxLDL)净摄取,表明橙皮苷通过下调oxLDL阻断AS斑块形成。综上,橙皮苷抗AS机制可能为抑制巨噬细胞泡沫细胞形成、抗氧化、抗炎、下调巨噬细胞中oxLDL等。
4 抗糖尿病并发症
糖尿病是一种代谢性疾病,以高血糖为特征,可导致多种并发症[33]。Visnagri等[34]发现橙皮苷50、100 mg/kg与胰岛素联合使用,可减轻实验性糖尿病性神经病变,通过控制高血糖和高脂血症下调自由基的产生、促炎因子的释放及膜结合酶的升高,从而逆转神经性疼痛。Syed等[35]发现橙皮苷100 mg/kg显著缓解实验性糖尿病性神经病变大鼠的葡萄糖和胰岛素抵抗,通过上调沉默调节蛋白1来抑制NOX4介导的氧化应激和炎症,具有抗糖尿病和神经保护作用。何伟等[36]通过研究橙皮苷对链脲佐菌素(streptozotocin,STZ)诱导的糖尿病肾病大鼠模型的影响,发现橙皮苷可抑制糖尿病肾病大鼠肾组织中Wnt4和β-catenin表达,进而改善肾功能,减轻蛋白尿,最终起到对肾脏的保护作用。Kandemir等[37]指出橙皮苷可降低STZ诱导的糖尿病肾病大鼠血清尿素、肌酐和丙二醛水平,升高抗氧化酶活性,减少TGF-β1表达及DNA氧化损伤,减轻肾组织病理组织学改变。Shi等[38]发现橙皮苷100、200 mg/kg显著抑制STZ诱导的糖尿病大鼠血-视网膜屏障分解并增加视网膜厚度、降低血糖、醛糖还原酶(aldose reductase,AR)活性和视网膜TNF-α、细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、IL-1β和晚期糖基化终末产物(advanced glycation end products,AGEs)水平,降低血浆丙二醛含量并增加SOD活性,表明橙皮苷通过抗血管生成、抗炎和抗氧化作用及对多元醇途径和AGEs积累的抑制作用减轻视网膜和血浆异常。Shehata等[39]发现橙皮苷200 mg/kg与胰岛素联合使用可显著改善糖尿病视网膜并发症,减轻糖尿病大鼠视网膜组织形态学变化,降低丙二醛和升高血清抗氧化标志物,减少GSH-Px表达。综上,橙皮苷可防治糖尿病并发症,作用机制可能为改善胰岛素抵抗,调控葡萄糖代谢相关酶及基因表达,减轻氧化应激损伤,下调炎症因子表达等。
因此,橙皮苷保护心血管系统、抗糖尿病并发症均与其抗炎、抗氧化作用密切相关,可能通过调节炎症因子表达、减轻氧化应激损伤发挥防治心血管疾病及糖尿病并发症的作用,见图1。
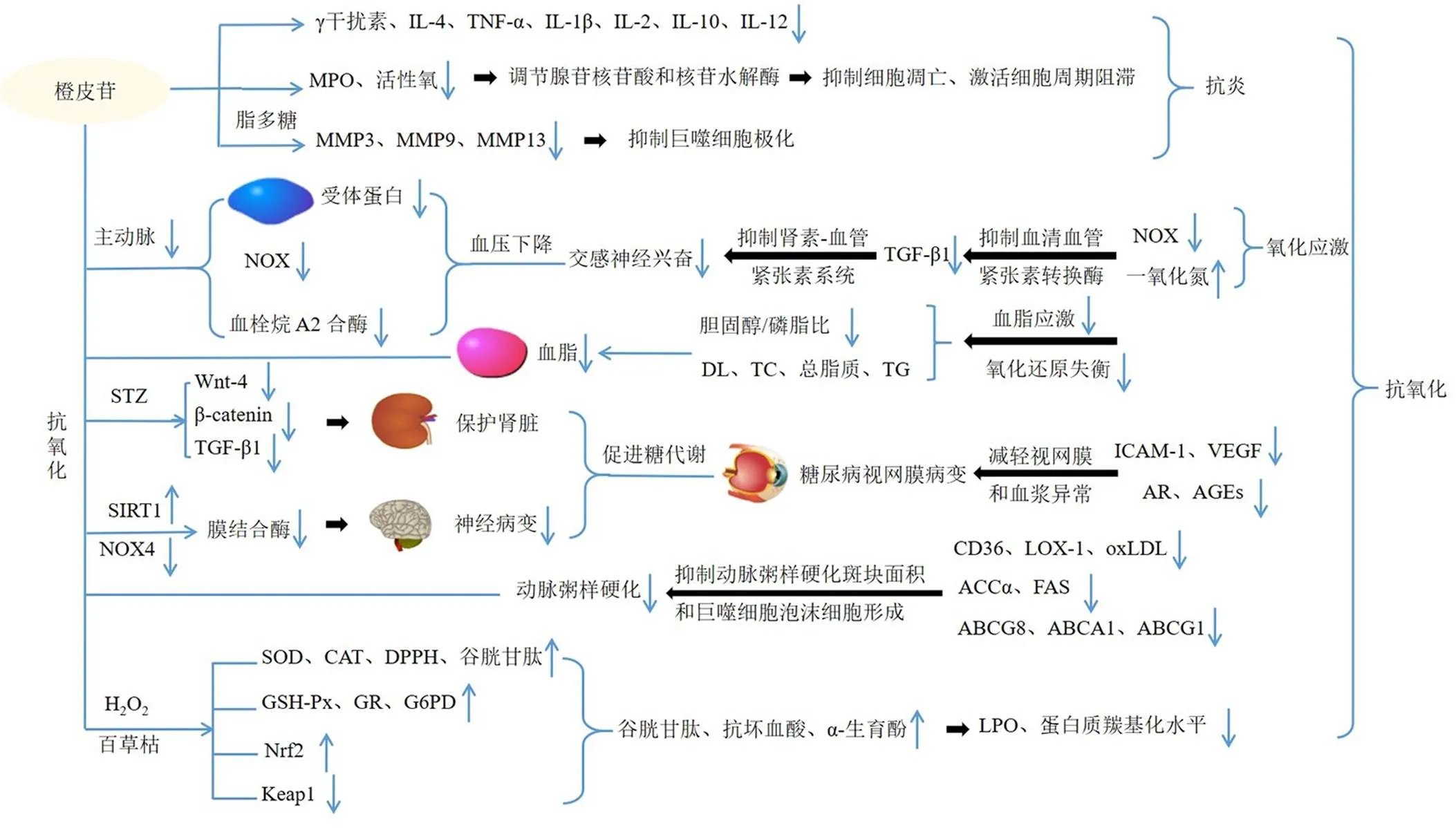
“↑”升高 “↓”降低,下图同
5 抗菌
致病菌引起的感染严重者可危及生命,通过对细菌毒力的作用机制研究,发现其对大多数抗生素具有耐药性,遏制细菌耐药性是目前亟待解决的问题,其中来源于植物的抗菌剂引起了研究者的广泛关注[40]。Vijayakumar等[41]发现橙皮苷可显著抑制脂肪酶、溶血素、自溶素、自聚集和葡萄黄素的产生,增加耐甲氧西林金黄色葡萄球菌对H2O2氧化应激条件的易感性,下调生物膜相关基因、多糖细胞内黏附基因、自溶素、纤连蛋白结合蛋白和葡萄黄素生成,抑制耐甲氧西林金黄色葡萄球菌的生物膜形成及毒力。橙皮苷对革兰阳性菌的抗菌作用高于对革兰阴性菌的抗菌作用,能有效抑制细菌生长,对金黄色葡萄球菌、蜡样芽孢杆菌、大肠杆菌和铜绿假单胞菌的最小抑菌浓度分别为1000、2000、2000、2000 μg/mL,最低杀菌浓度大于2000 μg/mL[42]。Pyrzynska[43]发现橙皮苷可直接抑制细菌生长或通过调节毒力因子的表达间接起作用,这2种方式都降低了微生物的致病性。体内外研究结果表明橙皮苷对嗜水气单胞菌具有抗菌活性,显著增加抗脂多糖免疫球蛋白M(immunoglobulin M,IgM)水平,并将抗脂多糖和抗嗜酸性粒细胞阳离子蛋白IgA水平降低至正常值,具有抗鼠类嗜水气单胞菌感染的抗菌活性[44]。张启焕等[45]发现0.15%~0.50%的橙皮苷对金黄色葡萄球菌和大肠杆菌均具有较好抑菌效果,能够作为一种广谱抗菌药物开发。综上,橙皮苷的抗菌机制可能为下调细菌生物膜相关基因、多糖细胞内黏附基因、自溶素、纤连蛋白结合蛋白和葡萄黄素生成,抑制细菌毒力及生长等,见图2。
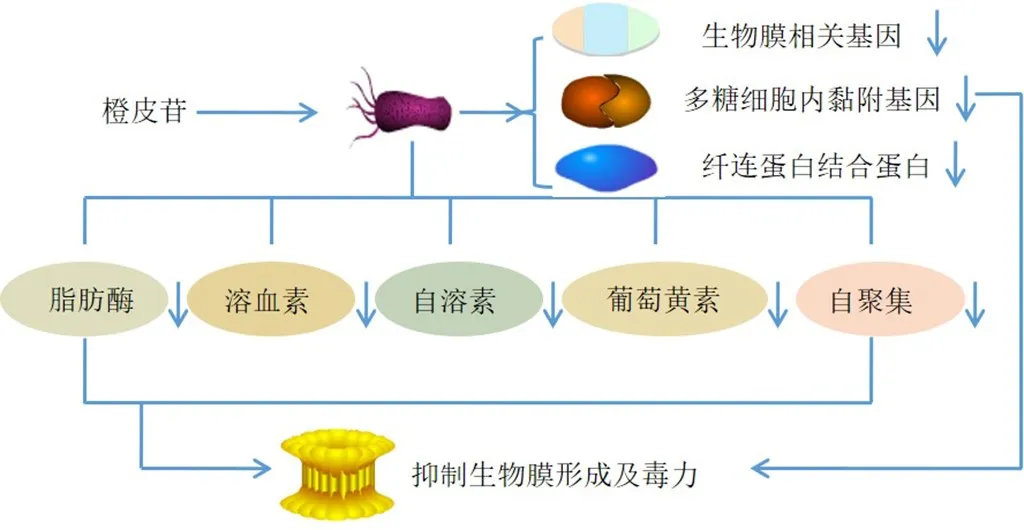
图2 橙皮苷抗菌作用机制
6 抗肿瘤
橙皮苷被认为是一种抗癌剂,在多种类型癌细胞中表现出促细胞凋亡和抗增殖作用,然而其诱导生长停滞和细胞凋亡的潜在机制尚不清楚[46]。橙皮苷的抗癌作用与其抗氧化和抗炎活性有关,通过与细胞靶标相互作用,诱导细胞凋亡和细胞周期阻滞抑制癌细胞增殖,具有抑制肿瘤细胞迁移和血管生成的潜在作用,还可逆转癌细胞的耐药性,这使其成为与现有抗癌药物联用的候选药物之一[47]。Xia等[48]发现橙皮苷通过介导基质细胞衍生因子-1/ CXC趋化因子受体4(stromal cell-derived factor-1/ CXC chemokine receptor 4,SDF-1/CXCR4)信号级联抑制人肺癌A549细胞的迁移和侵袭能力,是一种安全、有效的抗癌药物。橙皮苷可呈剂量和时间相关性抑制人宫颈癌HeLa细胞增殖,促进活性氧形成、细胞内Ca2+激活及线粒体膜电位损失,增加细胞色素C和线粒体凋亡诱导因子释放,并促进半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)激活,下调细胞周期蛋白D1(Cyclin D1)、cyclin E1和Cyclin依赖性激酶2表达,使HeLa细胞阻滞在细胞周期的G0/G1期,表明橙皮苷通过内质网应激通路介导的细胞凋亡和细胞周期阻滞抑制HeLa细胞增殖[49]。橙皮苷通过核因子抑制蛋白信号通路抑制人肝癌细胞中核因子-κB(nuclear factor-κB,NF-κB)易位进入细胞核及抑制p38激酶磷酸化和c-Jun氨基末端激酶(c-Jun-terminal kinase,JNK)信号通路下调激活蛋白-1(activator protein-1,AP-1)表达,减少MMP9转录,从而抑制肿瘤细胞侵袭和迁移,是一种有效的抗侵袭剂[50]。橙皮苷通过抑制人口腔癌HN6和HN15细胞中磷酸化转录激活因子1(signal transducer and activator of transcription 1,STAT1)和STAT3显著下调γ干扰素诱导的程序性死亡配体1(programmed death-ligand 1,PD-L1)表达,降低这2种细胞系的活力、增殖、迁移和侵袭[51]。王振东等[52]研究表明橙皮苷对人胃癌AGS细胞具有良好的杀伤作用,并通过提高AGS细胞内活性氧水平,进而调控MAPK信号通路来诱导AGS细胞发生线粒体依赖性凋亡。综上,橙皮苷抗肿瘤作用广泛,可抗肺癌、宫颈癌、肝癌、口腔癌、胃癌等,作用机制可能为抑制肿瘤细胞增殖、迁移和侵袭,阻滞细胞周期,介导凋亡信号通路等,见图3。
7 提升免疫力
免疫系统是机体抵御外来病原体(如细菌、病毒和真菌等致病性病原微生物)侵袭的第1道固有防线[53]。橙皮苷对环磷酰胺诱导的免疫抑制大鼠具有保护作用,增加体液抗体产生、定量溶血、巨噬细胞吞噬作用、脾淋巴细胞增殖、抗氧化标记物和自然杀伤细胞的细胞毒性水平,降低促炎因子水平,减少脂质过氧化标志物及肝脏、脾脏和骨髓中的组织损伤,表明橙皮苷可通过增强先天性和适应性免疫反应来降低环磷酰胺的免疫抑制作用[54]。Ruiz-Iglesias等[55]发现橙皮苷200 mg/kg可增强疲劳大鼠自然杀伤细胞的细胞毒性和吞噬单核细胞比例,减少巨噬细胞分泌细胞因子,防止疲劳引起的白细胞增多,增加胸腺、血液和脾脏中T辅助细胞(CD4+)比例,表明橙皮苷可防止疲劳运动引起的免疫改变。橙皮苷可提高免疫低下小鼠的脏器指数、碳廓清指数K和吞噬指数α,改善脾淋巴细胞增殖反应,恢复小鼠迟发型变态反应,提高CD4+、细胞毒性T细胞(CD8+)细胞数,对特异性血清溶血素IgM、IgG和脾溶血空斑形成细胞无影响,表明橙皮苷对小鼠的非特异性免疫和特异性细胞免疫反应均有促进作用,对特异性体液免疫反应无影响[56]。Camps-Bossacoma等[57]发现橙皮苷100、200 mg/kg可改变腹膜内免疫大鼠的肠系膜淋巴结淋巴细胞组成,增加T细胞受体(T cell receptor,TCR)αβ+细胞百分比,并降低B淋巴细胞比例,0.5%的橙皮苷可改变口服致敏模型大鼠肠上皮细胞和固有层中的淋巴细胞组成。综上,橙皮苷提升免疫力机制可能为增强先天性和适应性免疫反应,增强自然杀伤细胞的细胞毒性和吞噬单核细胞比例,提高碳廓清指数K和吞噬指数α,改善脾淋巴细胞增殖反应,恢复迟发型变态反应,提高CD4+和CD8+细胞数,改变淋巴细胞组成等,见图4。
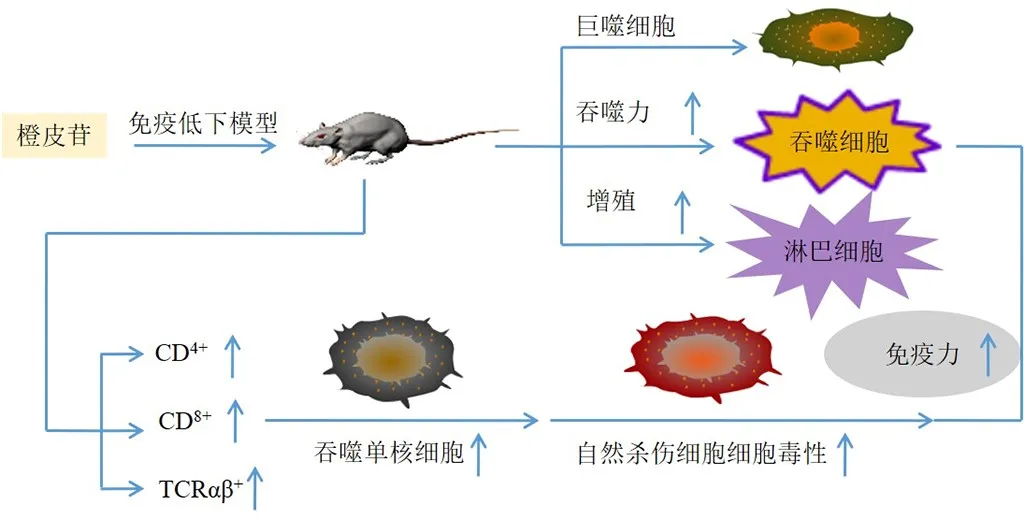
图4 橙皮苷提升免疫力作用机制
8 对神经系统保护作用
常见的神经系统疾病包括神经退行性疾病、精神障碍、脱髓鞘疾病、缺血再灌注损伤和神经炎症,大量研究表明橙皮苷会阻碍神经系统疾病的发展[58]。在各种临床前研究中,橙皮苷对阿尔茨海默病、癫痫、帕金森病、多发性硬化症、抑郁症、神经性疼痛等多种脑部疾病具有显著的保护作用,可能是通过调节抗氧化防御活动和神经生长因子、减少细胞凋亡和神经炎症通路来介导的[59]。Chang等[60]发现橙皮苷10、50 mg/kg可减弱红藻氨酸诱导的海马神经元死亡,可能通过螯合细胞外Ca2+并阻断N型和P/Q型通道或蛋白激酶C的活性抑制谷氨酸释放和由4-氨基吡啶(4-aminopyridine,4-AP)诱发的细胞游离Ca2+浓度升高,但不改变4-AP介导的去极化,表明橙皮苷具有神经保护作用。Welbat等[61]采用甲氨蝶呤诱导成年大鼠,发现橙皮苷可减少海马齿状回亚颗粒区的p21阳性细胞数量,上调海马双皮质素(doublecortin,DCX)、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、Nrf2、SOD、GSH-Px和CAT表达,下调海马体和前额皮质中的丙二醛水平,可能通过减少氧化应激和增强海马体的神经发生来预防甲氨蝶呤的神经毒性,从而保护神经。橙皮苷可恢复七氟醚诱导大鼠的认知功能损害,降低IL-1β、S100β、剪切型Caspase-3(cleaved Caspase-3)、Bax、高迁移率族蛋白B1(high-mobility group box-1,HMGB1)、NOD样受体蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、cleaved-Caspase-1表达,上调神经生长因子(nerve growth factor,NGF)、BDNF、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)表达,增加神经元细胞数量,降低细胞凋亡率,使用NLRP3激活剂Nigericin发现橙皮苷对新生大鼠的神经保护作用明显减弱,表明橙皮苷可能通过抑制HMGB1/NLRP3轴发挥神经保护作用[62]。综上,橙皮苷保护神经系统机制可能为调节抗氧化防御活动和神经生长因子、抑制细胞凋亡和神经炎症通路,减少氧化应激,减轻海马组织损伤,降低促炎因子表达,提高神经营养因子表达等,见图5。
9 其他
研究表明橙皮苷具有抗破骨作用,抑制破骨细胞标志物表达,增加前成骨细胞的成骨潜能并诱导成骨标记物的过度表达,促进骨缺损的再生,减少骨质流失并增加骨矿物质密度[63]。Li等[64]发现橙皮苷100 mg/kg可部分减轻十溴二苯醚(PBDE-209)诱导的小鼠睾丸组织病理学损伤和细胞凋亡,表明橙皮苷可部分保护青春期小鼠免受PBDE诱导的生殖毒性。Han等[65]发现橙皮苷可减轻博来霉素诱导的小鼠肺纤维化,下调衰老标记蛋白p53、p21和p16表达及肌成纤维细胞标记物α-SMA,减少衰老相关β-半乳糖苷酶阳性细胞数量,可能通过介导IL-6/STAT3信号通路抑制肺成纤维细胞衰老发挥抗肺纤维化作用。橙皮苷增加结肠组织中5-羟色胺受体4的荧光强度和细胞内游离钙离子,增强环磷酸腺苷(cyclic adenosine monophosphate,cAMP)/蛋白激酶A通路相关蛋白和p-cAMP反应成分结合蛋白表达,显著改善洛哌丁胺诱导的慢传输便秘模型大鼠的胃肠传输功能[66]。综上,橙皮苷药理作用广泛,对多种疾病均有治疗作用,然其发挥作用的机制尚不明确,仍需进一步研究。
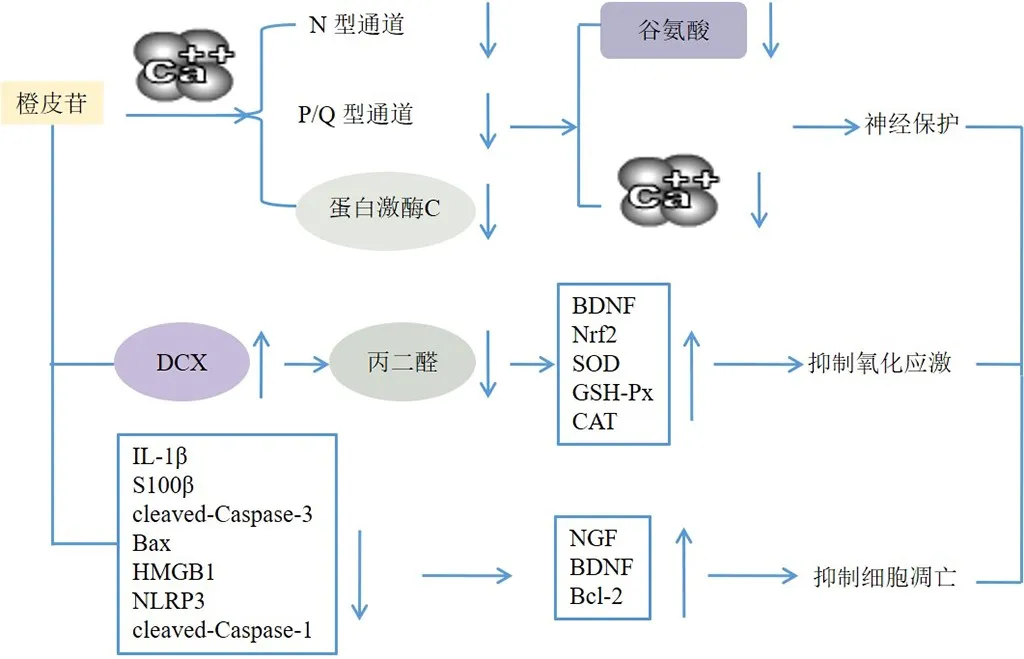
图5 橙皮苷保护神经系统作用机制
10 结语与展望
橙皮苷来源广泛,在柑橘属、芸香科、茜草科、唇形科等药用植物中普遍存在,是多种中药的药效成分,在保护心血管系统、抗菌、抗炎、抗氧化、抗肿瘤、提升免疫力、保护神经系统等方面药理作用显著,具有很强的生物活性,已开展的动物及细胞实验对其有效靶点和通路进行了深入研究,文献资料报道详实,具有开发成新药的潜力。
橙皮苷在水中溶解度仅为(6.32±0.12)µg/mL,脂溶性也较差,在体内容易受到各种代谢酶、肠道菌群等影响,口服吸收生物利用度仅为3.51%[67],因此,对其进行结构修饰改良以增加药物溶解度,促进药物吸收,提高临床疗效具有重要意义。目前,对橙皮苷进行结构改良应用的制剂新技术主要有脂质体[68-69]、纳米混悬剂[70]、纳米乳液[71]、微丸[72]、固体分散体[73-74]、包合物[75]、自微乳[76]等,从而改善橙皮苷口服吸收差、生物利用度低的问题。
橙皮苷在骨代谢、抗生殖毒性、改善便秘等方面也具有显著活性,但其具体作用机制尚不完善,需在今后的研究中加强,为充分发挥橙皮苷的临床疗效及其新药开发提供更加有利的证据。综上,橙皮苷在多种疾病模型中均表现出显著活性,具有广阔的开发应用前景,采用现代制剂技术对其提取分离纯化并进行结构修饰改良,有望成为治疗心血管疾病及肿瘤等相关疾病的候选药物。
利益冲突 所有作者均声明不存在利益冲突
[1]杨凯丽, 郭子硕, 张翼, 等. 甘草酸凝胶的流变学性质及其对橙皮苷的增溶作用研究 [J]. 中草药, 2023, 54(11): 3468-3479.
[2]张东霞, 张火旺. 高效液相色谱法测定复方半夏片中橙皮苷含量 [J]. 中国药业, 2023, 32(3): 84-86.
[3]陈平, 樊瑞胜, 聂芊. 水溶性橙皮苷的合成及结构表征 [J]. 食品科学, 2007(8): 143-147.
[4]杨元丰, 黎艳刚, 罗小泉, 等. 橙皮苷与陈皮酶转化工艺研究及其对正常小鼠小肠推进作用的比较 [J]. 中国新药杂志, 2022, 31(18): 1831-1837.
[5]Miles E A, Calder P C. Effects offruit juices and their bioactive components on inflammation and immunity: A narrative review [J]., 2021, 12: 712608.
[6]Adefegha S A, Bottari N B, Leal D B,. Interferon gamma/interleukin-4 modulation, anti-inflammatory and antioxidant effects of hesperidin in complete Freund’s adjuvant (CFA)-induced arthritis model of rats [J]., 2020, 42(5): 509-520.
[7]Heo S D, Kim J, Choi Y,. Hesperidin improves motor disability in rat spinal cord injury through anti-inflammatory and antioxidant mechanism via Nrf-2/HO-1 pathway [J]., 2020, 715: 134619.
[8]Xiao S P, Liu W G, Bi J Q,. Anti-inflammatory effect of hesperidin enhances chondrogenesis of human mesenchymal stem cells for cartilage tissue repair [J]., 2018, 15: 14.
[9]de Souza A B F, de Matos N A, Castro T F,. Effectsandof hesperidin administration in an experimental model of acute lung inflammation [J]., 2022, 180: 253-262.
[10]Adefegha S A, Saccol R D S P, Jantsch M H,. Hesperidin mitigates inflammation and modulates ectoenzymes activity and some cellular processes in complete Freund’s adjuvant-induced arthritic rats [J]., 2021, 73(11): 1547-1561.
[11]Qi W Z, Lin C X, Fan K,. Hesperidin inhibits synovial cell inflammation and macrophage polarization through suppression of the PI3K/Akt pathway in complete Freund’s adjuvant-induced arthritis in mice [J]., 2019, 306: 19-28.
[12]Somogyi A, Rosta K, Pusztai P,. Antioxidant measurements [J]., 2007, 28(4): R41-R55.
[13]Wilmsen P K, Spada D S, Salvador M. Antioxidant activity of the flavonoid hesperidin in chemical and biological systems [J]., 2005, 53(12): 4757-4761.
[14]Elavarasan J, Velusamy P, Ganesan T,. Hesperidin-mediated expression of Nrf2 and upregulation of antioxidant status in senescent rat heart [J]., 2012, 64(10): 1472-1482.
[15]Kalpana K B, Srinivasan M, Menon V P. Evaluation of antioxidant activity of hesperidin and its protective effect on H2O2induced oxidative damage on pBR322 DNA and RBC cellular membrane [J]., 2009, 323(1/2): 21-29.
[16]Ali Y A, Ahmed O M, Soliman H A,. Rutin and hesperidin alleviate paclitaxel-induced nephrocardiotoxicity in Wistar rats via suppressing the oxidative stress and enhancing the antioxidant defense mechanisms [J]., 2023, 2023: 5068304.
[17]Tirkey N, Pilkhwal S, Kuhad A,. Hesperidin, a citrus bioflavonoid, decreases the oxidative stress produced by carbon tetrachloride in rat liver and kidney [J]., 2005, 5: 2.
[18]Mas-Capdevila A, Teichenne J, Domenech-Coca C,. Effect of hesperidin on cardiovascular disease risk factors: The role of intestinal microbiota on hesperidin bioavailability [J]., 2020, 12(5): 1488.
[19]Gao C. Favourable lifestyle reduces cardiovascular disease risks in hypertensive patients [J]., 2022, 29(16): 2099-2100.
[20]乔伟珅, 侯静波. 橙皮苷对心血管疾病危险因素影响研究的进展 [J]. 心血管康复医学杂志, 2022, 31(6): 757-759.
[21]Doyle A E. Hypertension and vascular disease [J]., 1991, 4(2 Pt 2): 103S-106S.
[22]Wunpathe C, Potue P, Maneesai P,. Hesperidin suppresses renin-angiotensin system mediated NOX2 over-expression and sympathoexcitation in 2K-1C hypertensive rats [J]., 2018, 46(4): 751-767.
[23]Yamamoto M, Jokura H, Suzuki A,. Effects of continuous ingestion of hesperidin and glucosyl hesperidin on vascular gene expression in spontaneously hypertensive rats [J]., 2013, 59(5): 470-473.
[24]Ikemura M, Sasaki Y, Giddings J C,. Preventive effects of hesperidin, glucosyl hesperidin and naringin on hypertension and cerebral thrombosis in stroke-prone spontaneously hypertensive rats [J]., 2012, 26(9): 1272-1277.
[25]Bunbupha S, Apaijit K, Potue P,. Hesperidin inhibits L-NAME-induced vascular and renal alterations in rats by suppressing the renin-angiotensin system, transforming growth factor-β1, and oxidative stress [J]., 2021, 48(3): 412-421.
[26]Yao Y S, Li T D, Zeng Z H. Mechanisms underlying direct actions of hyperlipidemia on myocardium: An updated review [J]., 2020, 19(1): 23.
[27]Kumar R, Akhtar F, Rizvi S I. Protective effect of hesperidin in poloxamer-407 induced hyperlipidemic experimental rats [J]., 2021, 72(2): 201-210.
[28]Monforte M T, Trovato A, Kirjavainen S,. Biological effects of hesperidin, aflavonoid. (note II): Hypolipidemic activity on experimental hypercholesterolemia in rat [J]., 1995, 50(9): 595-599.
[29]Rathi A B, Nath N, Chari S N. Action of vitamin P like compounds on lysosomal status in hypercholesterolemic rats [J]., 1983, 5(4): 255-261.
[30]Ahmad S, Alam K, Hossain M M,. Anti-arthritogenic and cardioprotective action of hesperidin and daidzein in collagen-induced rheumatoid arthritis [J]., 2016, 423(1/2): 115-127.
[31]Sun Y Z, Chen J F, Shen L M,. Anti-atherosclerotic effect of hesperidin inLDLrmice and its possible mechanism [J]., 2017, 815: 109-117.
[32]Koga M, Kanaoka Y, Inada K,. Hesperidin blocks varenicline-aggravated atherosclerotic plaque formation in apolipoprotein E knockout mice by downregulating net uptake of oxidized low-density lipoprotein in macrophages [J]., 2020, 143(2): 106-111.
[33]Dokumacioglu E, Iskender H, Sen T M,. The effects of hesperidin and quercetin on serum tumor necrosis factor-alpha and interleukin-6 levels in streptozotocin-induced diabetes model [J]., 2018, 14(54): 167-173.
[34]Visnagri A, Kandhare A D, Chakravarty S,. Hesperidin, a flavanoglycone attenuates experimental diabetic neuropathy via modulation of cellular and biochemical marker to improve nerve functions [J]., 2014, 52(7): 814-828.
[35]Syed A A, Reza M I, Yadav H,. Hesperidin inhibits NOX4 mediated oxidative stress and inflammation by upregulating SIRT1 in experimental diabetic neuropathy [J]., 2023, 172: 112064.
[36]何伟, 胡爱霞, 成鑫, 等. 橙皮苷对糖尿病肾病大鼠Wnt/β-catenin信号通路的调节作用研究 [J]. 湖北中医药大学学报, 2018, 20(1): 28-33.
[37]Kandemir F M, Ozkaraca M, Küçükler S,. Preventive effects of hesperidin on diabetic nephropathy induced by streptozotocin via modulating TGF-β1 and oxidative DNA damage [J]., 2018, 37(4): 287-293.
[38]Shi X P, Liao S, Mi H J,. Hesperidin prevents retinal and plasma abnormalities in streptozotocin-induced diabetic rats [J]., 2012, 17(11): 12868-12881.
[39]Shehata A S, Mohamed D A, Hagras S M,. The role of hesperidin in ameliorating retinal changes in rats with experimentally induced type 1 diabetes mellitus and the active role of vascular endothelial growth factor and glial fibrillary acidic protein [J]., 2021, 54(4): 465-478.
[40]Verma A K, Ahmed S F, Hossain M S,. Molecular docking and simulation studies of flavonoid compounds against PBP-2a of methicillin-resistant[J]., 2022, 40(21): 10561-10577.
[41]Vijayakumar K, Muhilvannan S, Arun Vignesh M. Hesperidin inhibits biofilm formation, virulence and staphyloxanthin synthesis in methicillin resistantby targeting SarA and CrtM: Anandapproach [J]., 2022, 38(3): 44.
[42]Choi S S, Lee S H, Lee K A. A comparative study of hesperetin, hesperidin and hesperidin glucoside: Antioxidant, anti-inflammatory, and antibacterial activities[J]., 2022, 11(8): 1618.
[43]Pyrzynska K. Hesperidin: A review on extraction methods, stability and biological activities [J]., 2022, 14(12): 2387.
[44]Abuelsaad A S, Mohamed I, Allam G,. Antimicrobial and immunomodulating activities of hesperidin and ellagic acid against diarrheicin a murine model [J]., 2013, 93(20): 714-722.
[45]张启焕, 严新, 许伟, 等. 超声波辅助醇溶剂法提取橙皮苷及体外抑菌活性分析 [J]. 安徽农业科学, 2015, 43(31): 33-34.
[46]Birsu Cincin Z, Unlu M, Kiran B,. Anti-proliferative, apoptotic and signal transduction effects of hesperidin in non-small cell lung cancer cells [J]., 2015, 38(3): 195-204.
[47]Aggarwal V, Tuli H S, Thakral F,. Molecular mechanisms of action of hesperidin in cancer: Recent trends and advancements [J]., 2020, 245(5): 486-497.
[48]Xia R M, Xu G, Huang Y,. Hesperidin suppresses the migration and invasion of non-small cell lung cancer cells by inhibiting the SDF-1/CXCR-4 pathway [J]., 2018, 201: 111-120.
[49]Wang Y X, Yu H, Zhang J,. Hesperidin inhibits HeLa cell proliferation through apoptosis mediated by endoplasmic reticulum stress pathways and cell cycle arrest [J]., 2015, 15: 682.
[50]Lee K H, Yeh M H, Kao S T,. The inhibitory effect of hesperidin on tumor cell invasiveness occurs via suppression of activator protein 1 and nuclear factor-kappaB in human hepatocellular carcinoma cells [J]., 2010, 194(1/2): 42-49.
[51]Wudtiwai B, Makeudom A, Krisanaprakornkit S,. Anticancer activities of hesperidin via suppression of up-regulated programmed death-ligand 1 expression in oral cancer cells [J]., 2021, 26(17): 5345.
[52]王振东, 巩会杰, 马俊文. 橙皮苷诱导人胃癌AGS细胞凋亡机制的研究 [J]. 中草药, 2019, 50(22): 5484-5491.
[53]李赛, 朱晨晨, 田雪飞, 等. 应用网络药理学探讨人参促白虎汤解热作用的免疫学机制 [J]. 中草药, 2018, 49(10): 2460-2468.
[54]Berköz M, Yalın S, Özkan-Yılmaz F,. Protective effect of myricetin, apigenin, and hesperidin pretreatments on cyclophosphamide-induced immunosuppression [J]., 2021, 43(3): 353-369.
[55]Ruiz-Iglesias P, Estruel-Amades S, Camps-Bossacoma M,. Influence of hesperidin on systemic immunity of rats following an intensive training and exhausting exercise [J]., 2020, 12(5): 1291.
[56]李荣, 李俊, 胡成穆, 等. 橙皮苷对免疫功能低下小鼠免疫调节作用的实验研究 [J]. 中国药理学通报, 2007, 23(2): 169-172.
[57]Camps-Bossacoma M, Franch À, Pérez-Cano F J,. Influence of hesperidin on the systemic and intestinal rat immune response [J]., 2017, 9(6): 580.
[58]Li X Y, Huang W, Tan R R,. The benefits of hesperidin in central nervous system disorders, based on the neuroprotective effect [J]., 2023, 159: 114222.
[59]Bansal K, Singh V, Singh S,. Neuroprotective potential of hesperidin as therapeutic agent in the treatment of brain disorders: Preclinical evidence-based review [J]., 2023, doi: 10.2174/156652402366623032 0144722.
[60]Chang C Y, Lin T Y, Lu C W,. Hesperidin inhibits glutamate release and exerts neuroprotection against excitotoxicity induced by kainic acid in the hippocampus of rats [J]., 2015, 50: 157-169.
[61]Welbat J U, Naewla S, Pannangrong W,. Neuroprotective effects of hesperidin against methotrexate-induced changes in neurogenesis and oxidative stress in the adult rat [J]., 2020, 178: 114083.
[62]张贵星, 祁星, 曹雪, 等. 橙皮苷抑制HMGB1/NLRP3轴对七氟醚诱导的新生大鼠的神经保护作用研究 [J]. 中国优生与遗传杂志, 2023, 31(3): 453-459.
[63]Ortiz A C, Fideles S O M, Reis C H B,. Therapeutic effects offlavonoids neohesperidin, hesperidin and its aglycone, hesperetin on bone health [J]., 2022, 12(5): 626.
[64]Li S Q, Che S Y, Chen S N,. Hesperidin partly ameliorates the decabromodiphenyl ether-induced reproductive toxicity in pubertal mice [J]., 2022, 29(60): 90391-90403.
[65]Han D, Gong H Y, Wei Y,. Hesperidin inhibits lung fibroblast senescence via IL-6/STAT3 signaling pathway to suppress pulmonary fibrosis [J]., 2023, 112: 154680.
[66]Wu M N, Li Y R, Gu Y F. Hesperidin improves colonic motility in loeramide-induced constipation rat model via 5-hydroxytryptamine 4R/cAMP signaling pathway [J]., 2020, 101(6): 692-705.
[67]李茜, 张文周, 郝海军. 橙皮苷磷脂复合物纳米混悬剂的制备、表征及口服药动学研究 [J]. 中草药, 2022, 53(24): 7740-7750.
[68]禹瑞, 吕东霞, 谈秀凤. 橙皮苷脂质体的制备及其体内药动学研究 [J]. 中成药, 2022, 44(8): 2443-2449.
[69]熊传爽, 田黎明, 洪怡, 等. 橙皮苷脂质体凝胶的制备及其透皮吸收研究 [J]. 中国医院药学杂志, 2022, 42(5): 511-518.
[70]龙家英, 李小芳, 王娴, 等. 茶皂素用于稳定橙皮苷纳米混悬剂及其机制研究 [J]. 药学学报, 2021, 56(11): 3159-3165.
[71]廖艳梅, 李小芳, 刘罗娜, 等. 橙皮苷纳米乳液的制备及其稳定性研究 [J]. 中草药, 2019, 50(10): 2312-2318.
[72]刘谦鸿. 橙皮苷缓释微丸的制备及药效研究 [D]. 长沙: 中南林业科技大学, 2021.
[73]宋佳文, 李小芳, 龙家英, 等. 橙皮苷固体分散体的制备及其表征 [J]. 中药与临床, 2021, 12(1): 10-14.
[74]牛晓磊, 贾润霞, 谈秀凤. 橙皮苷磷脂复合物固体分散体的制备、表征及其体内药动学研究 [J]. 中成药, 2020, 42(9): 2255-2259.
[75]Wdowiak K, Rosiak N, Tykarska E,. Amorphous inclusion complexes: Molecular interactions of hesperidin and hesperetin with HP-Β-CD and their biological effects [J]., 2022, 23(7): 4000.
[76]凡小燕. 橙皮苷自微乳的制备与评价 [D]. 合肥: 安徽医科大学, 2011.
Research progress on pharmacological action and mechanism of hesperidin
YANG Ping, HUANG Qing-jie, LI Xi-xiang, SONG Wei, WANG Xue-mei
Gansu Provincial Hospital of Traditional Chinese Medicine, Lanzhou 730050, China
Hesperidin is widely found in the fruits or roots of, Rutaceae, Rubiaceae, Labiaceae and Cruciferae plants. It is a dihydroflavonoid compound, and it is also the main pharmacodynamic component of Chenpi (), Zhishi (), Zhiqiao () and Kuandonghua (). It belongs to the class of vitamin P drugs, which can enhance the toughness of capillaries and shorten the bleeding time. It is often used in the auxiliary treatment of cardiovascular system diseases. It can be used as a natural antioxidant in the food industry and also in the cosmetics industry. Modern pharmacological studies have shown that hesperidin has many biological activities such as anti-inflammatory, antioxidant, protection of cardiovascular system, anti-diabetic complications, antibacterial, antitumor, enhancement of immunity, protection of nervous system, etc. Therefore, the summarization of the pharmacological effects and mechanisms of hesperidin provide a basis for its clinical application and drug development.
hesperidin; anti-inflammation; anti-oxidation; cardiovascular system; antibacterial; antitumor
R285
A
0253 - 2670(2023)21 - 7222 - 10
10.7501/j.issn.0253-2670.2023.21.031
2023-04-25
兰州市科技计划项目资助(2022-3-35);中医药人才培养重点学科项目(2022)
杨 萍(1989—),女,硕士,主管中药师,从事中药复方及配伍药效机制研究。E-mail: yangping151@126.com
[责任编辑 赵慧亮]
