猪传染性胃肠炎病毒(TGEV)S 蛋白的原核表达与纯化
2023-11-06刘之睿黄嘉瑶苏荣陈濛濛彭春婷唐青海唐斯萍
刘之睿,黄嘉瑶,苏荣,陈濛濛,彭春婷,唐青海,唐斯萍
(衡阳师范学院化学与材料科学学院,生命科学学院,南岳山区生物资源保护与利用湖南省重点实验室,动物微生物新型检测技术及生物制剂衡阳市重点实验室,湖南 衡阳 421008)
猪传染性胃肠炎是由猪传染性胃肠炎病毒(Transmissible gastroenteritis virus,TGEV)引起的高度传染性消化道疾病。该病以引发2 周龄内的仔猪呕吐、严重腹泻、剧烈脱水为主要特征,感染后仔猪体重迅速减轻、脱水,1 周内死亡[1],死亡率高达100%。TGEV 属于冠状病毒科α 冠状病毒(Coronavirus),基因组为不分段的单股正链RNA,其大小为2.86×104bp,线性结构顺序为5'-ORF1a-ORF1b-S-ORF3a-ORF3b-E-M-N-ORF7-3'[2]。共编码4 个结构蛋白(S、M、N、E)和三种非结构蛋白ORF1a/1b、ORF3a/3b 和ORF7[3]。其中S 蛋白是典型的I 型病毒融合膜蛋白[4],可以与宿主细胞受体特异性结合,介导病毒入侵易感细胞,确定病毒的组织亲嗜性和侵染宿主细胞的范围,是病毒的毒力蛋白。其C 端区域高度保守,N 端区域能与红细胞表面唾液酸作用,具有血凝活性[5],膜外区上分布着A、B、C、D 四个主要的抗原位点[6]。S 蛋白在肠道中复制的能力与毒力直接相关[7],并且是唯一能诱导机体产生中和抗体的主要结构蛋白[8]。因此,TGEV菌株的差异及其感染潜力高度依赖于S 蛋白[9]。S蛋白不仅是研究TGEV 基因工程疫苗的主要抗原,对病毒病原的检测也具有重要意义。
本试验对TGEV 毒株编码的S 蛋白进行原核表达,通过各项条件优化得到一株高效表达菌株,表达的重组蛋白具有良好的反应原性,并采用试剂盒纯化,为进一步研究相应的抗体检测试剂盒和基因工程亚单位疫苗奠定了基础。
1 材料和方法
1.1 材料
1.1.1 基因、感受态细胞、载体
重组菌株Rosetta(DE3)-pET28a-TGEV-S2/3由衡阳师范学院南岳山区生物资源保护与利用湖南省重点实验室、生物药物校企联合研发实验室构建并保存;BL21(DE3)感受态细胞购自天根生化科技(北京)有限公司;pET28a(+)载体为Novagen 公司产品。
1.1.2 主要试剂、材料
IPTG、内切酶(BamH Ⅰ、Hind Ⅲ)购自TaKaRa公司;一抗His-Tag、二抗Goat-Anti-Mouse,均购于武汉三鹰生物技术有限公司;PVDF 膜于Millipore公司购得;Bacterial Protein Extraction Kit(细菌蛋白提取试剂盒)购于北京康为世纪生物科技有限公司;His 标签蛋白纯化试剂盒购于碧云天生物技术有限公司;Axyprep 质粒DNA 小剂量提取试剂盒购于爱思进生物技术(杭州)有限公司;DAB 显色试剂盒购自北京中杉金桥公司。
1.2 方法
1.2.1 TGEV S2、S3 基因原核表达载体的构建与鉴定
取重组菌株Rosetta(DE3)-pET28a-TGEV-S2/3 进行首次活化,将带有目的基因TGEV S2、S3 的质粒转化到感受态细胞BL21(DE3),构建出BL21(DE3)-pET28a-TGEV-S2、BL21(DE3)-pET28a-TGEV-S3 两个菌种,次日抗性筛选阳性克隆,在恒温培养箱中培养16~20 h 后挑取单菌落,保菌,提取质粒进行双酶切和琼脂糖凝胶电泳鉴定,拍照记录电泳结果。
1.2.2 重组蛋白的诱导表达及SDS-PAGE 和Western blot 检测
取阳性重组表达菌株进行首次活化,按照1∶200的比例将菌液分别接种于两管含有Kana(终浓度为200 μg·mL-1)的4 mL LB 液体培养基中,放入37 ℃摇床,220 r·min-1震荡培养16~18 h。次日,按1 ∶4 的比例进行二次活化,分别将首次活化后的1 mL 菌液接种于两管4 mL 含Kana(终浓度为200 μg·mL-1)的LB 液体培养基中,放入37 ℃摇床,220 r·min-1震荡培养2.5 h。其后取1 组诱导,剩余的1 组培养基不加诱导剂IPTG 作为对照组,37 ℃,加入IPTG(终浓度为1.0 mmol·L-1)220 r·min-1诱导4 h,收集菌体,经过PBS 洗涤后用细菌蛋白提取试剂盒裂解蛋白,离心10 min,包涵体用200 μL 包涵体溶解液悬起,进行SDS-PAGE 电泳检测。
取样品进行SDS-PAGE 检测,转膜,2%脱脂奶粉-PBS 封闭,PBST 洗涤;进行一抗孵育(1 ∶3000稀释);PBST 洗涤;进行二抗孵育(1 ∶5000 稀释);PBST 洗涤,用DBA 显色液显色。
1.2.3 表达条件的优化
最佳诱导温度实验:按二次活化总量20 mL 活化培养细菌,当菌液OD600nm= 0.6~0.8 时,每管加入终浓度为1.0 mmol·L-1IPTG,分别置于15 ℃、28 ℃、37 ℃,220 r·min-1诱导4 h 后,收集菌体,将得到的菌体经过PBS 溶解冰浴超声,功率60%,超2 s,停5 s,每管合计30 min,离心取沉淀加包涵体溶解液溶解,放置于-20 ℃保存。取蛋白样品进行SDSPAGE 电泳检测。
最佳诱导剂浓度实验:方法同上,当菌液OD600nm= 0.6~0.8 时,选择最佳诱导温度,不同IPTG 浓度(0、0.001、0.01、0.1、1.0 mmol·L-1IPTG),220 r·min-1诱导4 h,进行SDS-PAGE 电泳检测。
最佳诱导时间实验:方法同上,当菌液OD600nm=0.6~0.8 时,选择最佳诱导温度、最佳诱导剂浓度分别诱导不同时间(2 h、4 h、8 h、16 h),进行SDSPAGE 电泳检测。
1.2.4 重组蛋白的纯化
对重组菌株BL21(DE3)-pET28a-TGEV-S2 和BL21(DE3)-pET28a-TGEV-S3 按照按1 ∶2 的比例进行二次活化。取1 组加入IPTG(终浓度为1.0mmol·L-1)诱导,剩余的1 组培养基中不加诱导剂IPTG 作为对照组,菌液经PBS 洗涤后使用PBS 进行第一次冰上超声,功率60%,超5 s,停10 s,每管合计50 min,离心后取沉淀再加包涵体洗涤缓冲液(在包涵体洗涤液中加入终浓度为1%的Triton X-100)将菌体溶解,进行第二次冰上超声,功率60%,超5 s,停10 s,每管合计30 min,离心后沉淀用包涵体溶解液溶解,置于-20 ℃保存,按照碧云天His标签蛋白纯化试剂盒说明书进行纯化后,取纯化蛋白样品进行SDS-PAGE 电泳检测。
2 结果
2.1 重组TGEV S 表达载体的鉴定
结果显示S2、S3 双酶切结果均出现了两个显色条带,第2、4 泳道在5369 bp 与750 bp 各有一条带;其中大小为750 bp 的条带代表目的基因TGEV-S 片段,5000 bp 左右为载体pET28a(5 369 bp)条带,表明挑取的BL21(DE3)-pET28a-TGEVS2、BL21(DE3)-pET28a-TGEV-S3 重组菌株均为阳性,重组质粒pET28a-TGEV-S 已成功转化到感受态细胞BL21(DE3)中(图1)。

图1 pET28a-TGEV-S2、pET28a-TGEV-S3 质粒及双酶切电泳鉴定
2.2 重组TGEV S 蛋白的诱导表达与鉴定
2.2.1 pET28a-TGEV-S 的诱导表达
在诱导温度为37℃,IPTG 浓度为1.0 mmol·L-1时,诱导4 h,目的蛋白在包涵体中表达,且上清中不存在目的蛋白,目的蛋白S2、S3 条带分别约为28 kDa 与30 kDa,未诱导对照组无明显蛋白条带(图2),表明TGEV S 基因诱导表达成功。

图2 重组蛋白TGEV-S2、TGEV-S3 的SDS-PAGE 检测
2.2.2 重组TGEV S 蛋白的Western blot 鉴定
将与2.2.1 中的SDS-PAGE 试验中相同的蛋白胶经转膜后采用一抗His-Tag,二抗Goat-Anti-Mouse 进行孵育,结果显示,pET28a-TGEV-S 包涵体蛋白分别在28 kDa、30 kDa 处有目的条带(图3),说明包涵体形式的重组蛋白能与一抗发生特异性结合。

图3 重组蛋白TGEV-S2、TGEV-S3 的Western blot 鉴定(His 单克隆抗体)
2.3 诱导条件的优化
2.3.1 最佳诱导温度
温度分别为15 ℃、28 ℃、37 ℃,IPTG 浓度为1.0 mmol·L-1下诱导4 h。结果显示,诱导温度为15 ℃时的蛋白表达量明显低于28 ℃和37 ℃,当诱导温度为28 ℃时,蛋白表达量最高,且只以包涵体形式存在,在上清中未见有目的蛋白表达(图4、图5)。M:Marker;1~8 依次为:BL21(DE3)-pET28a-TGEV-S2 37℃诱导上清、诱导包涵体、28℃诱导上清、诱导包涵体、15℃对照上清、对照包涵体、诱导上清、诱导包涵体;9~16 依次为:BL21(DE3)-pET28a-TGEV-S3 37℃诱导上清、诱导包涵体、28℃诱导上清、诱导包涵体、15℃对照上清、对照包涵体、诱导上清、诱导包涵体。

图4 TGEV-S2、TGEV-S3 诱导温度表达条件优化SDS-PAGE 检测

图5 TGEV-S2、TGEV-S3 诱导温度表达条件优化Western blot 鉴定
2.3.2 最佳IPTG 诱导浓度
诱导温度为28 ℃,IPTG 浓度分别为0、0.001、0.01、0.1、1.0 mmol·L-1,诱导4 h。结果表明IPTG 浓度为1.0 mmol·L-1时,S 蛋白表达量最高,且仅以包涵体形式表达,0.1 mmol·L-1IPTG 诱导时,目的蛋白疑似在上清有表达(图6)。
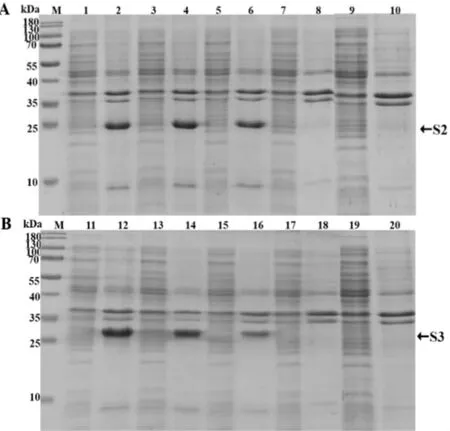
图6 TGEV-S2、TGEV-S3 诱导剂浓度表达条件优化SDS-PAGE 检测
2.3.3 最佳诱导时间
诱导温度为28 ℃,IPTG 浓度为1.0 mmol·L-1,诱导时间分别为2 h、4 h、8 h 和16 h。结果显示,改变诱导时间,目的蛋白在诱导4 h 时表达量最高,且只存在于包涵体中(图7、图8)。由2. 3. 2 中可知,在0.1 mmol·L-1IPTG 浓度下,TGEV S 蛋白疑似有在上清中的可溶性表达,经Western blot 鉴定表明,在上清中没有目的蛋白与抗体的特异性结合,说明在0.1 mmol·L-1IPTG 条件下诱导时,上清中无目的蛋白的表达(图9、图10)。

图7 诱导时间表达条件优化的SDS-PAGE 检测(1.0mmol·L-1 IPTG)

图8 诱导时间表达条件优化的Western blot 鉴定(1.0mmol·L-1 IPTG)

图9 诱导时间表达条件优化的SDS-PAGE 检测(0.1mmol·L-1 IPTG)

图10 诱导时间表达条件优化的Western blot 鉴定(0.1mmol·L-1 IPTG)
2.4 重组TGEV S 蛋白的纯化
诱导温度为37 ℃,IPTG 浓度为1.0 mmol·L-1,诱导时间分别为4 h,培养结束后使用His 标签蛋白纯化试剂盒纯化。结果显示,菌体沉淀溶解液在28 kDa 与30 kDa 处均出现目的蛋白且浓度较高,后续洗脱液的条带在均在28 kDa 与30 kDa 附近,且目的蛋白含量较少,判断目的蛋白纯化已经成功(图11)。
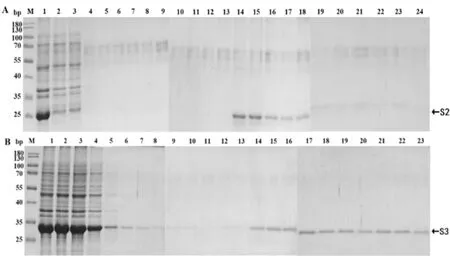
图11 TGEV-S2、S3 大量纯化的SDS-PAGE 检测
3 讨论
本试验扩增构建了TGEV-S2、TGEV-S3 重组原核表达载体,并进行了表达条件的优化与纯化。结果显示,重组菌株酶切产物均存在5369 bp 与750 bp 两条带,表明成功获得了BL21(DE3)-pET28a-TGEV-S2S3 阳性克隆菌株,SDS-PAGE 检测TGEV-S2、TGEV-S3 分别在28 kDa、30 kDa 处附近存在目的条带,符合预期分子量大小。Western blot 鉴定表明,目的蛋白仅在诱导后的包涵体中出现了表达,上清均未在预期蛋白分子量处出现特异性印迹,因此希望通过诱导表达条件的优化,探究TGEV-S2 蛋白的可溶性表达。
综合考虑耗材、时间以及蛋白表达量等因素,得出目的蛋白最佳诱导表达条件为在28 ℃下,以1.0 mmol·L-1IPTG 浓度,诱导4 h。在15 ℃条件下诱导时的蛋白表达量明显低于28 ℃和37 ℃,当诱导温度为28 ℃时,蛋白表达量较37 ℃时略有提高,且其的表达形式不随温度变化而改变;同时,增减IPTG 浓度无助于目的蛋白表达量的提高,但是在0.1 mmol·L-1IPTG 浓度下,TGEV-S2 蛋白疑似有在上清中的可溶性表达;在1.0 mmol·L-1IPTG浓度条件下,诱导4 h 时目的蛋白的表达量最高,如果再将诱导时间延长为8 h 乃至更长,蛋白量表达仍无明显增加,而在0.1 mmol·L-1IPTG 浓度下,经Western blot 鉴定表明TGEV-S 蛋白仍无在上清中的可溶性表达。
现研究已表明,TGEV 的免疫属于获得自母猪母乳的被动免疫,而仔猪由于免疫系统还未发育完全导致了病死率的大幅上升。自1946 年美国出现后,在亚欧多国猪群间相继爆发,TGEV 的有效种群规模在1960—1970 年间快速增长[10]。尽管针对猪传染性胃肠炎疾病的研究已经取得了许多进展,近年来仍有调查结果显示,TGEV 在意大利南部坎帕尼亚地区猪群间流行程度仅次于PEDV,是当地第二大猪腹泻致病源[11]。
数年间,人们尝试过针对病毒各个结构蛋白进行检测和免疫,它们各有优势:M 蛋白保守性高,具有启动病毒粒子组装、促使病毒释放的作用[12],张小波等人采用pGEX-6P-1 表达载体转化Rossetta(DE3)感受态细胞重组表达了全长的M 蛋白[13],因含有GST-Tag 的表达系统,便于后续纯化操作,而本研究采用His-Tag 的表达系统,虽然目的产物的表达量高但难以纯化;N 蛋白是一种磷酸化蛋白,影响TGEV 基因组RNA 复制和转录的加工[14],诱导细胞凋亡,由于其同样具有高保守性,郭宏伟等人以pET28a 为载体转化BL21(DE3)感受态细胞在47 kDa 处表达了重组TGEV N 蛋白,以包涵体形式存在,具有良好的免疫原性[15]。而本研究采用相同的原核表达体系成功表达的TGEV S 蛋白同样为包涵体形式。由此可见,TGEV的不同结构蛋白在相同的表达载体中均以包涵体形式表达。已有研究发现TGEV S 蛋白包含139 个磷酸化位点,24 个N-糖基化位点和53 个表位[16],与其他猪肠道冠状病毒相比,糖基化位点含量最高,在原核表达系统中蛋白质糖基化易影响其折叠行为和溶解性产生包涵体蛋白。但不可忽视的是,原核表达系统在蛋白质生产、操作、便利性和生产成本方面具有巨大优势[17]。由于S 蛋白可以诱导宿主的免疫反应,促进病毒与细胞的融合,诱导机体产生中和抗体,所以目前大多仍选择S 蛋白作为TGE 诊断、疫苗研发的目标靶点。近年来,刘娜等针对S 蛋白S1 亚基构建了重组载体pET28a-TGEV-CTD 并将其转化至感受态细胞BL21 中表达,开发了一种小鼠单克隆抗体[18];于天飞等通过将S 基因抗原表位D 与原核表达载体pET-32a 重组表达,对C、D 表位的抗原性进行了比较[19];郑仲华等将截断S 基因与载体pET-32a连接重组转化到BL21 中,同样以包涵体状态表达出了目的蛋白,但His 标签纯化过程中存在目的蛋白部分二聚化的问题[20]。本研究扩增的TGEV 截短S2、S3 片段能较好地适用于His 标签纯化柱,成功纯化出了目的蛋白。因此,本实验纯化出的S蛋白在前人的基础上进行了一定优化,经过实验,异源基因已在原核载体中成功表达,可以用于产生抗体、中和病毒或分析蛋白功能。
综上所述,本试验成功构建了一株高效表达TGEV 毒株S 基因的菌株,重组蛋白TGEV-S以包涵体形式存在,表达量大,纯化方便,为后续基因工程亚单位疫苗、诊断试剂研发奠定了基础。
