不同重建算法对定量CT椎体骨密度测定准确性的影响
2023-11-06郝辉朱书萌赵文哲徐士杰丁宁宁杨健
郝辉,朱书萌,赵文哲,徐士杰,丁宁宁,杨健*
1.西安交通大学生命科学与技术学院生物医学工程系,陕西 西安 710049;2.西安交通大学第一附属医院医学影像科,陕西西安 710061;3.上海联影医疗科技股份有限公司,上海 201800;*通信作者 杨健 yj1118@mail.xjtu.edu.cn
影像学检查和骨密度测定是早期发现和诊断骨质疏松的重要方法,也是观察疗效的主要指标[1-2]。定量CT(quantitative computed tomography,QCT)测定值相对准确,已得到共识推荐应用于骨质疏松诊断和筛查[3-4]。为降低辐射剂量及患者就医成本,QCT可与低剂量胸部CT联合应用实现一站式肺癌与骨质疏松机会性筛查[5-6]。迭代算法重建可以有效改善剂量降低造成的图像噪声增加和分辨率降低[7]。近来,深度学习重建算法在低剂量模式下的图像噪声降低和分辨率提高方面具有显著优势[8-9],但尚无相关研究探索经迭代重建或深度学习重建优化后的图像是否会影响QCT骨密度测定值的准确性。因此,本研究应用欧洲腰椎体模,探索经不同重建算法重建后的图像对QCT骨密度测定准确性的影响。
1 材料与方法
1.1 研究对象 应用ORM-ESP(European spine phantom,编号No.145)体模进行研究。该体模的主体部分由水等效树脂构成,内部嵌入3个椎骨模拟插件,含有数量不等的羟基磷灰石,以兼顾所有年龄组范围内松质骨及皮质骨的生理特点。3个椎骨可定义为L1、L2、L3,骨松质羟基磷灰石含量分别为50 mg/cm3、100 mg/cm3、200 mg/cm3,以上数值可作为标称值应用于QCT骨密度质控。
1.2 扫描及重建方案 采用320排螺旋CT(uCT960+,上海联影医疗科技股份有限公司)。将体模置于检查床上,长轴与床面平行,且L2中心位置对准扫描中心线,连续扫描10次,每次间隔5 min,扫描方案采用常规剂量与低剂量模式,固定管电压120 kVp,管电流调制技术,对应参考管电流200 mAs/30 mAs,对应剂量等级为3级/1级。将原始数据推送至探索者工作平台(uInnovation-CT,R001,上海联影医疗科技股份有限公司)进行重建,重建算法分别为反投影滤波函数(filter background projection,FBP)、混合迭代重建(KARL 3D)和深度学习重建(artificial intelligence iterative reconstruction,AIIR)。KARL 3D算法等级为1~9级,算法核心为B-SHARP-C。AIIR算法等级为1~5级,算法核心为BodySharp。所有图像重建层厚1 mm,重建范围保持一致。
1.3 CT值测定 测定两种剂量条件下所有重建后的图像各个椎体中心层面的CT值,每个椎体节段均选择相同的层面,粘贴复制保证所有层面感兴趣区(ROI)面积一致。ROI勾画避开皮质骨。
1.4 骨密度测定 所有重建后的1 mm图像数据传输至QCT骨密度测定软件。测定前需进行体模校准,系统提示PASS方可测定(图1A)。分别测量3个椎体节段。按照系统操作流程对所选椎体进行测量(图1B),于椎体中心层面勾画ROI,避开骨皮质,定义椎体并核对ROI范围(图1C),得出测量结果(图1D)。

图1 QCT软件椎体骨密度测定流程
1.5 测量精密度及准确度误差 用相对标准偏差(relative standard deviation,RSD)代表精密度;测量相对误差(relative error,RE)代表准确度[10-12]。相对标准偏差计算公式:(SD代表各重建算法下的骨密度测定值的标准差、代表各算法下骨密度测定值的均数),相对误差公式:
1.6 统计学分析 采用SPSS 20.0、Graph Prism 8.0软件。经不同算法重建后各椎体CT值、骨密度值用Shapiro-Wilk检验评估正态性,符合正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t法;采用配对t检验比较两种mAs条件下各个算法重建后所测得骨密度值差异。P<0.05为差异有统计学意义。
2 结果
2.1 不同重建算法对ESP各椎体CT值的影响KARL 3D随重建等级增高CT值增高,且高于AIIR算法。AIIR算法各等级间CT值相对稳定。常规剂量组:L1椎体CT值在不同重建算法组间比较,差异有统计学意义(F=4.726,P<0.01);KARL8与AIIR5,KARL9与AIIR3~5比较,差异有统计学意义(P均<0.05)。L2椎体CT值在不同算法组间比较,差异有统计学意义(F=2.190,P=0.011),KARL9与AIIR5比较,差异有统计学意义(P<0.05)。L3椎体CT值各重建等级组间比较,差异无统计学意义(F=0.755,P=0.715)(图2A~C)。低剂量组:L1椎体CT值在不同重建等级组间比较,差异无统计学意义(F=1.748,P=0.053)。L2、L3椎体CT值在各重建等级组间比较,差异有统计学意义(L2:F=5.144,P<0.01;L3:F=3.626,P<0.01)。L2的KARL7~9与AIIR1~5比较,差异有统计学意义(P均<0.05)。L3的KARL8与AIIR1,KARL9与AIIR1~5比较,差异有统计学意义(P均<0.05)(图2D~F)。
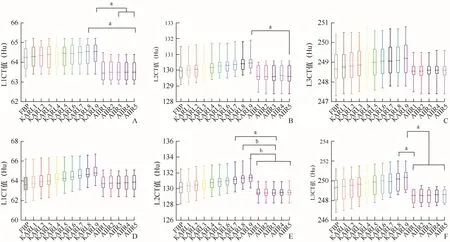
图2 两种剂量模式下经不同重建算法重建后各椎体CT值组间差异。A~C为常规剂量模式;D~F为低剂量模式;aP<0.05,bP<0.01
2.2 不同重建算法对ESP各椎体骨密度测量值的影响各算法测量值均高于标称值。KARL算法随重建等级升高而升高,AIIR算法测定值相对稳定。单因素方差分析可得各椎体骨密度测定值在不同重建算法条件下差异有统计学意义。常规剂量组:(L1:F=9.356,P<0.01;L2:F=6.853,P<0.01;L3:F=5.513,P<0.01),两两比较L1、L2椎体骨密度测定值在KARL6~9与AIIR1~5,差异有统计学意义(P均<0.05);L3椎体骨密度测定值在KARL6、KARL8与AIIR1~3差异有统计学意义(P均<0.05),KARL7、KARL9与AIIR1~5差异有统计学意义(P均<0.05)(图3)。低剂量组:(L1:F=4.358,P<0.01;L2:F=9.309,P<0.01;L3:F=9.292,P<0.01),L1椎体骨密度测定值FBP与KARL7~9差异有统计学意义(P均<0.05),KARL7与AIIR4~5、KARL9与AIIR1~5比较,差异有统计学意义(P均<0.05);L2椎体骨密度测定值FBP与KARL6~9差异有统计学意义(P均<0.05),KARL6~9与AIIR1~5差异有统计学意义(P均<0.05);L3椎体骨密度测定值KARL6、KARL8与AIIR1~3、KARL9与AIIR1~5差异有统计学意义(P均<0.05),见图4。

图3 常规剂量模式下不同算法重建后图像骨密度测定值差异。A~C为L1、L2、L3椎体所测得骨密度值;aP<0.05
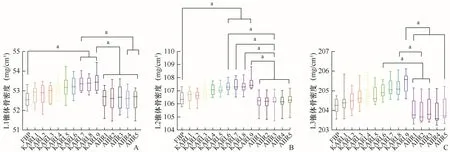
图4 低剂量模式下不同算法重建后图像骨密度测定值差异。A~C为L1、L2、L3椎体所测得骨密度值;aP<0.05
2.3 两种剂量模式下各椎体不同算法重建后所测骨密度值差异 FBP算法条件下L1、L2椎体骨密度测定值高剂量组高于低剂量组(高剂量组比低剂量组,L1:52.953±0.285比52.550±0.428,t=2.394,P=0.040;L2:106.836±0.211比106.427±0.556,t=2.398,P=0.040)。KARL算法仅在L3椎体骨密度测定值存在差异,高级别(KARL7~9)低剂量组比高剂量组测定值高,差异有统计学意义(高剂量组比低剂量组,KARL7:204.769±0.315比205.162±0.453,t=-2.392,P=0.040;KARL8:204.680±0.342比205.170±0.459,t=-3.884,P=0.004;KARL9:204.876±0.406比205.434±0.498,t=-3.073,P=0.013)。低剂量组与高剂量组在不同等级的AIIR算法下测定值差异无统计学意义。
2.4 不同重建算法对ESP骨密度测定的精密度及准确度 基于AIIR算法重建的图像在进行骨密度测量时误差更小(表1、2)。各算法测量RE与RSD在高密度椎体相对较低。两种剂量模式下AIIR算法所测骨密度的测量RE更低;RSD相对较高,但较为稳定。
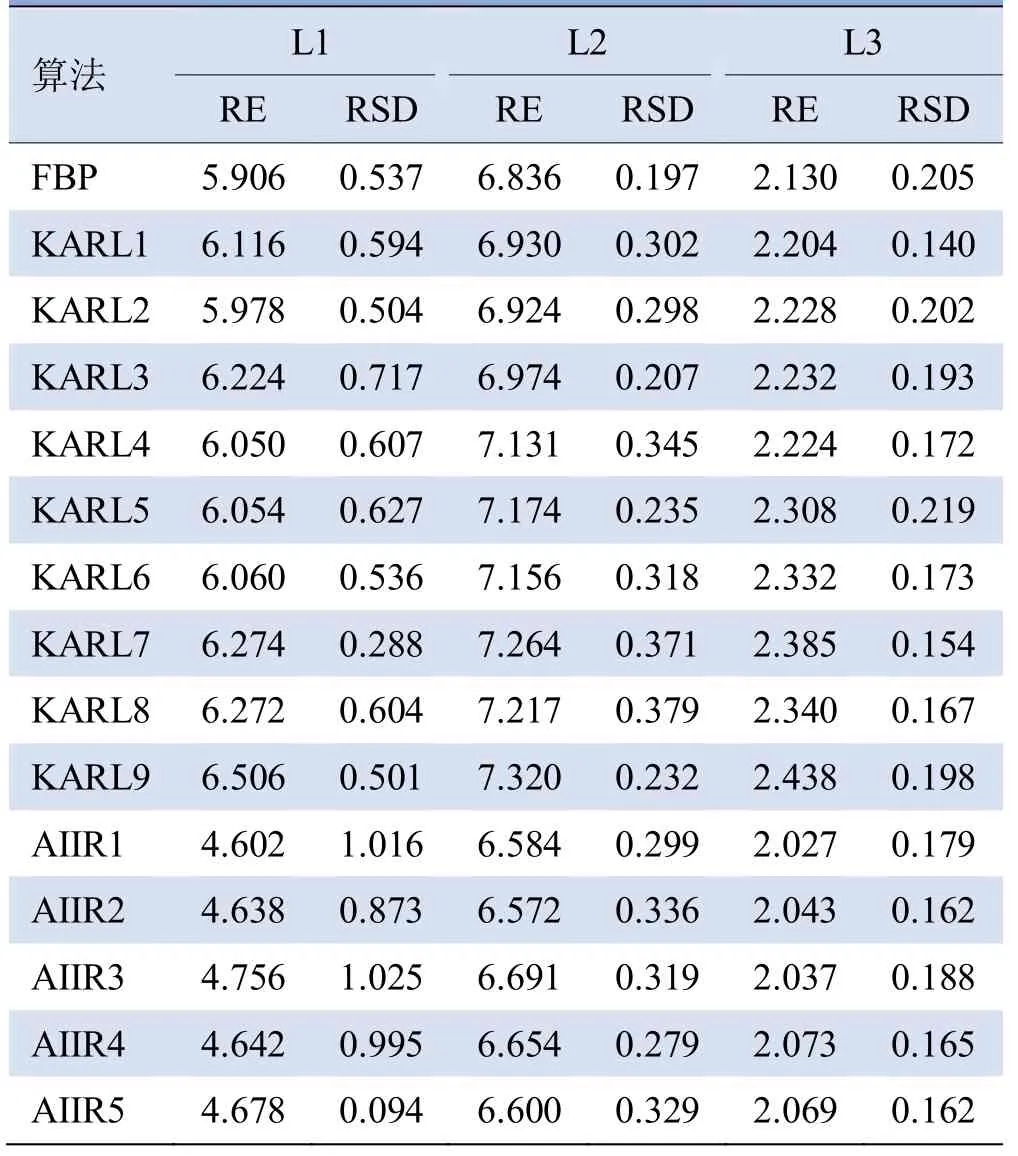
表1 常规剂量模式下的RSD和RE(%)

表2 低剂量模式下的RSD和RE(%)
3 讨论
本研究应用欧洲腰椎标准体模探讨了不同重建算法对QCT骨密度值测定准确性的影响。通过常规剂量与低剂量两种模式对比验证,表明不同算法重建后的体模图像均可进行骨密度测定,基于深度学习重建算法图像测得的骨密度值更接近真实值,相对误差更小。为深度学习重建算法在低剂量模式下得应用提供更多可行性经验。
3.1 不同重建算法对QCT骨密度测定值的影响 本研究的校准体模已被多数研究应用于对骨密度测定结果准确性与精密度的校准[10-12]。QCT测定原理是基于水与空气CT值的线性回归将松质骨CT值转化为体积骨密度[10],因此CT值是影响QCT骨密度测定值的因素之一。既往研究多聚焦于低剂量条件下应用迭代算法重建后图像对骨密度测定值的影响[13-14],而本研究在高、低剂量下均进行了探索,同时综合对比FBP、混合迭代重建、深度学习重建3种算法,得出不同算法重建后的椎体所测得骨密度值均大于体模标称值。
本研究发现深度学习重建后的图像可行QCT骨密度测定。迭代重建算法与深度学习重建算法可以有效改善低剂量条件下的图像噪声,已有很好的临床应用[15-18]。本研究在上述研究基础上的拓展应用,得到FBP算法所得骨密度值较接近体模标称值。随着迭代算法重建等级增高,椎体CT值增高,测得骨密度值也增高。本研究显示高级别迭代重建算法在不同mAs条件下同一椎体测定值也存在差异,这与迭代重建等级增加其迭代运算次数增加引起CT值增高有关[19]。深度学习重建算法测得骨密度值更接近标称值且较迭代算法低,不同重建等级间不存在差异。本研究应用的深度学习重建算法融合深度学习降噪算法和模型迭代重建算法,借助深度学习算法优化迭代过程,保留图像细节,提高了图像对比度,算法本源是高质量的模型迭代算法,与前述研究并不一致[13]。为避免高级别迭代重建算法所引起的蜡像样图像表现,常将中等级别迭代重建算法应用于临床诊断[20-22]。基于本研究结果,为保证图像重建效果及骨密度测定值的准确性,混合迭代重建算法可选择中等级别;深度学习重建算法可根据临床需求选择重建等级。
3.2 不同重建算法对QCT骨密度测定准确性的影响QCT的测量误差主要由骨髓脂肪的干扰、部分容积效应和线性回归的阈值水平不同等因素引起,可接受的变化范围为5%~15%[10],本研究两种剂量条件下所有重建算法骨密度测量值的误差均在可接受范围内,且深度学习算法下的误差更低。相关研究显示不同mAs、不同迭代算法对QCT测定结果影响无显著差异[13-14]。本研究基于迭代算法的结果与上述研究一致,同时进一步证实深度学习重建算法不会因mAs改变而影响QCT骨密度测定值。本研究得到高密度椎体测量误差小、偏差小,深度学习重建后的值更加稳定,提示深度学习算法重建后的图像对正常骨量骨密度测定结果影响最小。而低密度椎体虽测量误差较高,但纵向对比深度学习算法更优,提示深度学习算法重建后的图像对骨量减少骨密度测定结果较迭代算法更准确,从而为深度学习重建算法在低剂量CT的应用提出更多可能,既可实现图像优化,又可为临床提供较为精确的骨密度测定值。
3.3 本研究的局限性 尚未对基于其他原理的深度学习重建算法的CT数据行QCT验证测定的准确性;是基于体模的研究,后续可基于患者行相关研究。
总之,不同重建算法对QCT椎体骨密度值测定结果存在差异,但均在允许误差范围内。深度学习重建算法图像可在低剂量条件下与图像质量优化联合应用获得较准确且稳定的骨密度值,具有较好的应用前景。
