臭氧水对人牙龈成纤维细胞的细胞毒性
2023-11-06徐超何亚兰张娜娜陈新民
徐超 何亚兰 张娜娜 陈新民
牙科综合治疗台水路系统(dental unit waterlines,DUWLs)由于内部管道系统复杂,难以拆卸,清洁和消毒效率受到限制,普遍存在严重的微生物污染[1]。有报道显示:在未经处理的DUWLs水样中每毫升细菌含量可高达数万个[2],已分离出铜绿假单细胞菌、肺炎军团菌、大肠埃希菌、阿米巴原虫、真菌、分枝杆菌等具有较强致病力的病原菌。因此,如何控制 DUWLs 中的微生物,成为牙科诊疗中消毒和感染控制的重点。化学消毒法是目前对 DUWLs进行消毒与感染控制的主要方法。有报道采用低浓度的含氯消毒剂可以有效杀灭 DUWLs 中的浮游菌,去除生物膜[3]。由于氯气在使用时会生成致癌物质(如三氯甲烷),因此被誉为绿色高氧化剂的臭氧目前被视为最佳的水处理选项[4]。臭氧的抗菌强度是氯化物的1.5 倍[5],能够杀灭诸如金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌、乙肝病毒等病原体[6]。然而,臭氧也是一种潜在的致癌或促癌因子[7],易对呼吸道,皮肤黏膜及角膜等组织造成损伤,使得这一临床应用存在争议。
臭氧易溶于水,臭氧水(ozone water,OW)的优点之一是在不损失臭氧消毒作用的前提下降低气体毒性。李云恺等[8]报告认为OW可以替代含酒精的手部消毒剂,用于有皮肤问题的人。有研究[9]显示OW可诱导牙髓细胞增殖,具有很好的生物相容性。已有研究将OW用于口腔综合治疗水系统中,2 mg/L的OW能在1 min内100%杀灭水循环系统中包括细菌、病毒、芽孢等所有病原微生物[10]。然而OW对口腔黏膜正常细胞的影响鲜有评价。因此,在OW应用于牙科综合治疗台水路系统消毒之前,验证其对人类口腔黏膜细胞的细胞毒性是很重要的。人牙龈成纤维细胞(human gingival fibroblast,HGF)是牙龈组织固有层的主要细胞,数量最多,不仅具有活跃的自身更新能力,而且可合成胶原纤维、弹性纤维及基质,在体内具有进一步增殖形成牙龈组织的潜力,是口腔黏膜中最重要的细胞之一[11]。此外,比起口腔黏膜上皮细胞,牙龈成纤维细胞更易于从组织中游离出贴壁,体外培养成活率高,老化速度慢。因此,体外建立牙龈成纤维细胞模型有利于实验的顺利开展。本研究旨在探讨不同浓度OW对体外培养的HGF的细胞毒性,为臭氧水应用于DUWLs消毒提供有意义的参考。
1 资料与方法
1.1 研究对象
本研究中的HGF来源于原代培养。收集四川大学华西口腔医院牙周科门诊牙冠延长术后患者的健康牙龈,采用改良组织块法和酶消化法相结合培养原代HGF,抗波形丝蛋白抗体和抗角蛋白抗体免疫细胞化学染色鉴定HGF特征,倒置相差显微镜(inverted phase contrast microscope,IPCM)(CK型,Olympus,日本)观察和描绘生长曲线,选取具有稳定性能和增长速度好的第4代至第5代细胞[12]进行实验。该研究得到甘肃省人民医院医学伦理委员会批准(批号: 2023-381)。
1.2 试验步骤
1.2.1 OW的制备及测定方法 根据标准CJ/T3028.2-94规定,OW浓度的测定采用碘量法[13]。在环境温度为25 ℃的实验条件下,使用臭氧发生器(KS-J188型,成都肯格王三氧电器设备有限公司)来产生臭氧气体,并将其通入带塞的三角瓶中,其中盛有250 mL的灭菌蒸馏水。实验设备运行时长为2 h。同时,在500 mL的带塞锥形瓶中加入了20 mL的20%碘化钾溶液。随后吸取200 mL的样本,将其加入另一个500 mL的锥形瓶中,其中已含有20%碘化钾溶液,并添加了5 mL的3 mol/L硫酸溶液。然后封闭瓶口,并让混合液均匀混合后静置5 min。用0.005 mol/L的Na2S2O3标准溶液进行滴定,直至溶液呈现淡黄色。随后,添加了0.5%淀粉指示剂1 mL,并继续滴定,直至蓝色完全消失。记录Na2S2O3标准溶液的总用量,并重复了此实验3 次。最后,根据以下公式计算出臭氧浓度:O3(mg/L)= 0.6×V(V为Na2S2O3消耗的毫升数)。
为减小实验误差,此实验中所涉及的测量步骤均重复3 次,实验结果取3 次的平均值,用蒸馏水迅速配置出实验所需浓度的OW。
1.2.2 臭氧水干预实验 将第四代HGF传代至5 板24 孔培养板(Corning,美国),分为5 组(n=5),实验前小心吸去各孔中培养基,取400 μL 4 种浓度OW分别加入对应孔中,对照组加入含10%FCS的培养基:O31组(1 mg/L)、O32组(2 mg/L)、O34组(4 mg/L)、O36 组(6 mg/L)、空白对照C组,分别作用1、5、10、20 min后进行各指标测定。
1.3 指标测定

1.3.2 MTT比色法测定细胞相对增值率的变化 将第四代HGF传代至5板24孔培养板(Corning),分为5 组(n=5),第3日细胞贴壁牢固,实验前小心吸去各孔中培养基,取400 μL 5 种浓度OW分别加入到各孔中,阴性对照组加入含10%FCS的培养基。分别在作用1、5、10、20 min后,去除药物原液,每孔加入培养基200 μL, 5 mg/L的MTT溶液25 μL。放入CO2孵箱内继续孵育4 h后从孵箱中取出,加入二甲基亚砜(DMSO,分析纯,北京化工厂产品) 20 μL/孔终止培养,再次置入CO2孵箱内30 min后震荡15 min,至所形成的结晶物完全溶解后,以无菌PBS调零, 连续波长多功能读数系统(Varioskan Flash,Thermo Scientific,美国)测定各孔在波长490 nm或570 nm处的A值。按公式(RGR=实验组A值/阴性对照组A值×100%)计算细胞相对增殖率(relative growth rate,RGR)。
1.4 统计学分析

2 结 果
2.1 IPCM下HGF形态
IPCM下观察:HGF呈放射状或漩涡式生长,排列紧密有极性。胞体呈长梭形或星形,有2~4 个不规则细胞突起,有时互相接成网状。胞体丰满,胞浆均匀,透明度大,折光性强,颜色较深的2~3 个圆形或椭圆形的细胞核位于细胞中央,含少量致密颗粒,轮廓清晰光滑,细胞间界清楚(图1)。抗波形丝蛋白染色阳性, 阳性颗粒在细胞质内分布均匀。胞浆内着棕黄色,胞核清晰无染色(图2A)。抗角蛋白染色阴性(图2B),胞浆内几乎不着色,仅见苏木精复染后的核形。

图1 体外培养的HGFs (相差显微镜, ×200)Fig 1 In vitro cultured HGFs (Phase contrast microscope, ×200)
以培养时间为横轴、吸光度值为纵轴绘制出的HGF的生长曲线(图3),曲线呈“S”型。分为滞留期、对数生长期、平台期3 个时期。第1天由于胰酶的损伤,细胞数略微下降,第2天开始明显增长,第3天起细胞增殖迅速,进入对数生长期,第6天达到最高峰,随后慢慢降低,进入平台期,符合细胞的生长规律。其中对数生长期为接种后第3天~第6天。
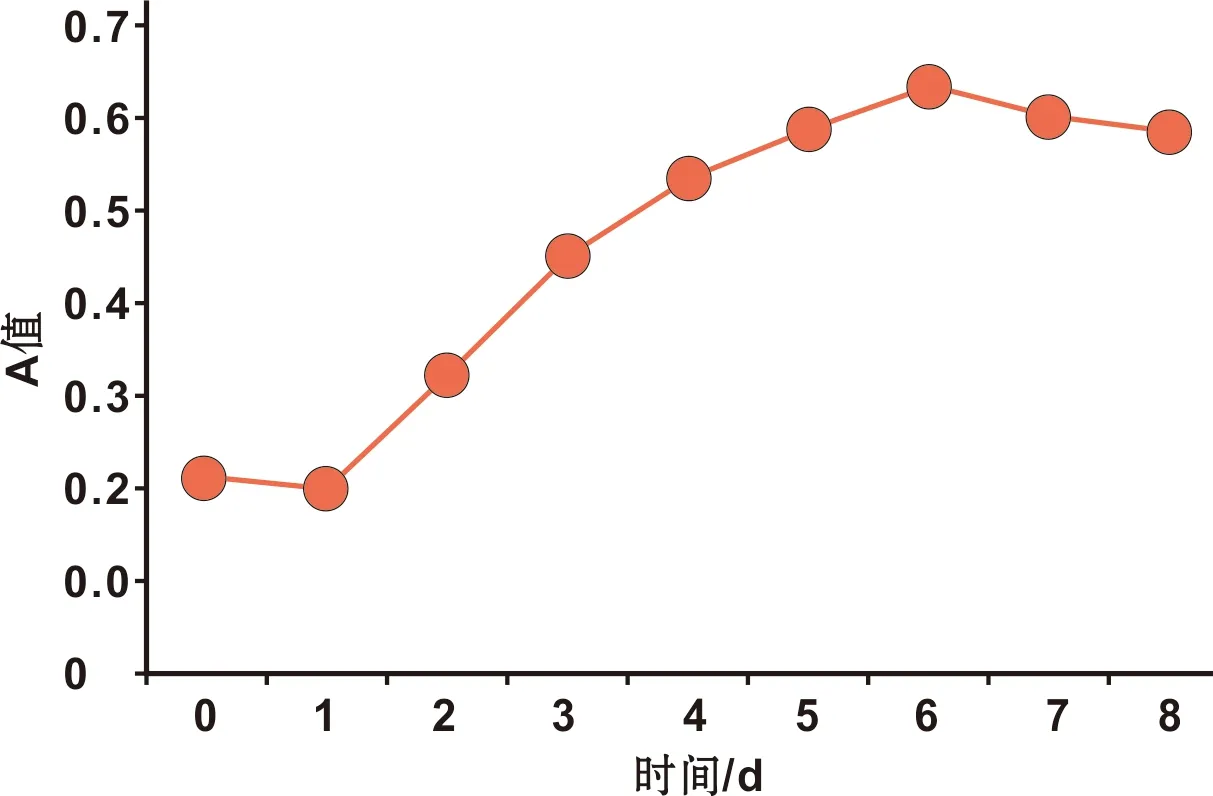
图3 HGF生长曲线 (MTT实验, ×200)Fig 3 Growth curve of HGFs (MTT assay, ×200)
2.2 OW干预后HGF形态变化
对照组细胞(图4A)呈放射状或漩涡式生长,胞体呈长梭形或星形,有2~4 个不规则细胞突起,有时互相接成网状。颜色较深的圆形或椭圆形的细胞核位于细胞中央,胞体丰满,胞浆均匀,透明度大,折光性强,胞浆内无变性颗粒,轮廓清晰,光滑,突起粗大,偶见发亮的固缩脱落的坏死细胞;O31组、O32组在各时间点(图4B)与C组比较无明显差异;O34组在处理1、5 min后与C组相比,没有明显的细胞差异(图4C)。然而,当处理时间延长至10 min和20 min时,观察到细胞的显著变化。细胞胞体变得肥大和肿胀,胞浆扩散变宽,呈现肥胖型态。细胞突起逐渐减少,细胞边界模糊,胞浆内出现了大量颗粒状物质,其中20 min组的情况明显比10 min组更为严重,并伴随着死细胞的增多(图4D)。在O36组中,当细胞经过1 min的臭氧作用后,即出现胞体肥大和肿胀,突起明显减少。在细胞密度较大的区域,细胞突起因细胞肿胀而几乎不可见。而在经过20 min的处理后,细胞折射率明显降低,细胞轮廓更加模糊。在高细胞密度区域,黑色颗粒密集覆盖,几乎没有完整的细胞存在,出现大片细胞固缩脱落,呈现明亮的片状漂浮于培养液中(图4E)。这些结果强烈表明不同处理条件对细胞产生了显著的影响。
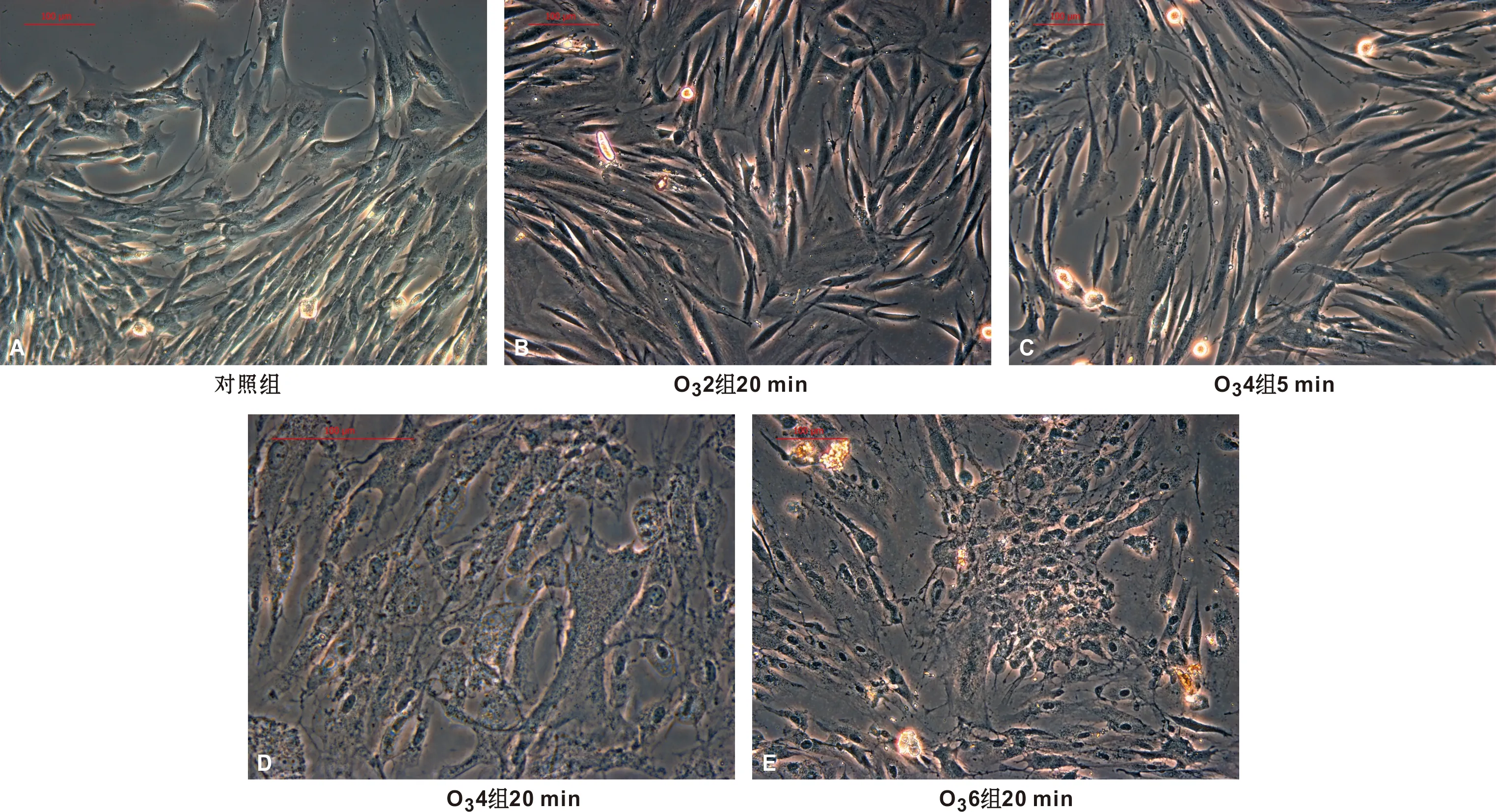
图4 各组细胞形态 (相差显微镜, ×200)Fig 4 Cell morophology of the groups (Phase contrast microscope, ×200)
2.3 MDA变化水平
1 min和5 min时点,与C组比较,O31组、O32几乎没有差异;O34组、O36组均升高(P<0.05),O36组较O34组高(P<0.05);在10 min时点在与C组比较,O31,O32组略有降低(P<0.05),O34,O36组均升高(P<0.01),O36组升高值较O34组的高(P<0.05);20 min时点与C组比较,O31,O32组均有降低(P<0.05),O34,O36组均升高(P<0.01),但与10 min时点相比,均略低于10 min时点的数值(P<0.05)(图5)。

图5 不同时点HGFs中内丙二醛含量Fig 5 MDA content of HGFs in different times
2.4 细胞毒性评价(mosmann's tetrazolium toxicity,MTT)
以C组的A均值作为100% 细胞增殖率,则各浓度组的RGR和细胞毒性按5 级毒性分级法评价[14]。
HGF经过不同浓度,不同时间的OW干预后的MTT检测结果,RGR变化见(图6)。与C组相比,在1、5 min时间组,O31组的臭氧干预后细胞的RGR趋于100%,毒性级别为0;O31组在10、20 min时间段以及O32组在4 个时间段的干预后的RGR均达到90%以上,毒性级别为1;O34组的臭氧除在1 min时段的RGR达到87%,毒性级别达到1,随着时间的延长,其他3 个时间段的臭氧作用后RGR均低于65%,毒性级别均为2;而O36组的臭氧在1、5、10以及20 min时点RGR分别是74%、62%、58%和33%,毒性等级分别为2,2,2,3。

图6 不同时点HGFs的相对增殖率Fig 6 RGR of HGFs in different times
同一时间组内不同浓度OW干预后的A值比较:1 min组:不同浓度OW干预后的A值无明显统计学差异P>0.05,提示短时间内各浓度OW对细胞的毒性差别不大;5 min组、10 min组、20 min 3 组在不同浓度OW干预后的A值均具有明显统计学差异P<0.05,提示5 min、10 min、20 min 3 组随OW浓度的增加对HGF的细胞毒性增加。
不同时间段同一浓度的组间比较, O31组、O32组在OW干预后的A值在不同的时间点均无明显统计学差异P>0.05,提示低浓度OW随着时间的延长不会增加细胞毒性;O34组、O36组的A值在各时间点均具有明显统计学差异P<0.05,提示高浓度OW随着作用时间的延长细胞毒性增加。
3 讨 论
臭氧是一种强氧化剂,可以氧化细胞内不饱和脂肪酸和蛋白质分子,导致细胞膜的通透性增加,细胞质外流,失去活性;细胞膜的破坏,促进了臭氧进一步扩散到细胞内,氧化细胞内酶或RNA、DNA,从而导致细胞的死亡, OW的毒性和温度、浓度以及作用时间有关[15]。本实验结果显示,6 mg/L的OW短时间内就可以对细胞产生不可逆性的损伤,而2 mg/L的OW即使作用长达20 min,对HGF的损伤作用也很小。因此,在将OW应用于临床时,注意保证作用效果的同时,尽量减小作用浓度和作用时间。臭氧因其强烈的不稳定性而不能以传统方式储存或运输,而只能在需要时立即生成和使用。臭氧的稳定性受到多个因素影响,包括初始浓度越低、温度越低以及pH值呈弱酸性时,其稳定性越高,半衰期也越长。这些条件下,臭氧分解为氧气并释放热量的速度较慢。王华然等[16]的研究显示:OW的浓度随放置时间的延长而降低,在室温中(25 ℃)的半衰期约为21 min。臭氧的半衰期取决于其存在的水质和温度条件。在不同水质下,臭氧的半衰期分别为173 min(双蒸水)、177 min(蒸馏水)、和19 min(自来水)。这表明水质越纯,臭氧分解速率越慢,半衰期越长[17]。同时,温度也对臭氧的分解速率产生影响。在不同温度下,臭氧的半衰期分别为132 min(4 ℃)、128 min(10 ℃)、27 min(20 ℃)、和6 min(30 ℃)。温度越高,臭氧分解越快,半衰期越短。这说明高温条件下,臭氧更容易分解为氧气。因此,本研究中的实验均在室温25 ℃的条件下进行,采用蒸馏水制取OW,减少水质、温度变化对OW半衰期的影响。
臭氧分解产生的氧自由基能攻击生物膜中的多不饱和脂肪酸,形成脂质过氧化物。在酸性环境下,过氧化脂质会发生分解,生成一种名为MDA的化合物。接着,MDA会与TBA结合,形成一种红色色素。这种红色色素具有吸收峰值,其波长为532 nm[18]。因此,在此波长下测得的吸光度值可反映出MDA的含量。MDA是脂质过氧化的终产物,具有能够与蛋白质分子中的氨基发生相互作用的特性。这种相互作用会导致多肽链内或链间的交联,结果是蛋白质和酶的失活。这种失活过程会引发细胞代谢异常,甚至导致细胞死亡。因此,通过测试MDA的含量,可以评估机体细胞受自由基攻击后所遭受的损伤程度。同时,这个测试也间接反映了细胞清除氧自由基的能力[19]。因而测试MDA的含量多少可反映机体细胞受自由基攻击后损伤的严重程度,同时又间接地反应了细胞清除氧自由基的能力。本研究中低浓度组(O31,O32组)在短时间OW作用下,与C组的MDA值相似,无明显差异,提示对细胞无损伤。随着干预时间的延长,低浓度组的MDA值逐渐低于C组,推测臭氧的存在可能导致细胞内抗氧化酶的消耗,从而引发细胞内磷酸戊糖代谢途径和糖酵解过程的激活,增加了细胞内ATP、2、3-DPG及NADPH生成[20]。ATP不仅具备能量提供的功能,还在抵御臭氧引起的氧化应激损伤方面发挥着保护细胞的作用。同时,2、3-DPG能够使氧解离曲线向右移动,从而增加细胞的氧供应。另外,NADPH的存在有助于维持细胞膜的完整性。这个过程对细胞的保护起到明显作用。而在20min时间点,尽管O34、O36组的MDA值比C组高,但比10min时间点有略有降低,推测也是OW激活了部分损伤较小的细胞中的抗氧化功能,使损伤逆转的结果。
MTT法是评价细胞毒性最常用的方法之一[17],它根据细胞的线粒体活性来测定细胞毒性,使用方便,重现性高。本研究利用MTT法评估HGF对不同剂量OW的生物反应。结果显示:低于2 mg/L 的OW在各个时间点之间的结果均较稳定,随着时间的推移,对细胞活力的影响没有明显的变化,这与Küçük等[9]的研究结果一致,观察4 mg/L的OW对人牙髓细胞具有良好生物相容性,有促进牙髓细胞增殖的效果。结果显示4 mg/L的OW干预组在4 个时间段内均表现出较高的细胞毒性,且随着与OW作用时间的延长以及接触浓度的增大,细胞毒性呈增大趋势。OW的毒性具有温度、时间和剂量依赖性[21],分析原因可能与实验细胞对臭氧的敏感性差异,OW制备困难,且OW在制备后,其浓度会逐渐衰减,半衰期20~30 min,实验条件不同,故不同文献对OW的毒性研究的结果相差较大。
有一组细胞在不同浓度臭氧干预不同时间后,换含10%胎牛血清的细胞培养基继续培养72 h,结果O31、O32、O34组的HGF生长良好,测得A值均趋近于C组,表明4 mg/L浓度范围内的OW对HGF毒性作用可逆,而6.0 mg/L浓度OW作用过的细胞A值明显低于阴性C组,可能是由于高浓度OW使大量细胞的死亡导致细胞数量的大量减少以及细胞的不可逆性损伤影响了细胞的增殖。
由于OW具有细胞相容性和生物杀灭作用,被认为是控制微生物的一种可行的替代品,将OW用于口腔临床中很有潜力。但应注意保证作用效果的同时,有效控制OW的浓度和作用时间,并对接触区域有效保护,将OW的浓度控制在2 mg/L以内是安全有效地。未来的研究还应关注细胞恢复能力的评价,可以规划更长的实验周期,选择不同的细胞毒性评价方法,为进一步临床应用提供证据。
