大黄素联合左氧氟沙星对脂多糖致大鼠急性肺损伤的影响及机制
2023-11-06曾慈梅郑永先
孙 琼,曾慈梅,郑永先
(中南大学湘雅医学院附属海口医院,海南 海口 570208)
创伤和感染等多种非心源性疾病导致的肺毛细血管内皮细胞或肺泡上皮细胞弥漫性损伤会导致急性肺损伤(acute lung injury,ALI)发生,死亡率较高[1]。ALI 主要表现为肺水肿和肺部炎症反应,出现急性和进行性缺氧性呼吸衰竭[2]。目前,ALI的治疗主要集中在肺保护策略和激素治疗等方法,缺乏特异性疗法及药物。大黄素(emodin)是一种具有生物活性的蒽醌,是中草药大黄的有效成分,具有抗肿瘤、抑炎等多种生物学作用。动物实验结果表明,大黄素可激活自噬并减轻致命性内毒素血症小鼠的炎症性肺损伤[3]。左氧氟沙星(levofloxacin)是一种较为广谱的抗生素,可治疗细菌感染引起的肺部损伤,也可减轻流感病毒引起的肺炎并改善预后[4]。有研究表明,大黄素可增强抗生素的抗菌性[5]。在多重耐药铜绿假单胞菌的抗菌治疗中,大黄素与抗生素(如美罗培南和阿米卡星)联用可降低抗生素的有效抑菌浓度,提高其对多重耐药铜绿假单胞菌的敏感性[6]。而大黄素与左氧氟沙星联合使用效果如何,目前尚不明确。脂多糖(lipopolysaccharide,LPS)是革兰阴性细菌细胞外壁的组成成分,是一种炎症诱导剂,常用来建立ALI模型。本研究旨在探究大黄素联合左氧氟沙星对LPS 诱导的大鼠ALI 的影响,以期为ALI 的临床治疗与研究提供依据。
1 材料与方法
1.1 药物、试剂和仪器
大黄素(货号:E106693,HPLC 纯度≥90%),上海阿拉丁试剂有限公司;左氧氟沙星注射液(国药准字2H0013082),河北智同生物制药股份有限公司;LPS,美国Sigma-Aldrich 公司;4%多聚甲醛、RAPI裂解液、Trizol RNA提取试剂盒、苏木素-伊红染液和瑞氏吉姆萨染液,武汉博士德生物工程有限公司;肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和IL-6 ELISA 试剂盒,美国R&D 公司;丙二醛(malondialdehyde,MDA)、超 氧 化 物 歧 化 酶(superoxide dismutases,SOD)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)和过氧化氢酶(catalase,CAT)试剂盒,南京建成生物工程研究所;兔抗大鼠NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和NF-κB p65 多克隆抗体及山羊抗大鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多 克 隆 抗体,美国Abcam 公司;辣根过氧化物酶标记的山羊抗鼠IgG 抗体,美国Cell Signaling Technology 公司;VEGF,NF-κBp65和GAPDH引物(表1)由上海赛默飞世尔科技有限公司合成。JEM-1210 透射电镜,日本JEOL 公司;TC-XDS-500C 荧光倒置显微镜,日本奥林巴斯公司;DNM-9602 酶标仪,北京普朗新技术有限公司;1645050 双板垂直电泳仪、ChemiDoc XRS+化学发光凝胶成像分析系统和CFX96 实时荧光定量PCR 仪,美国伯乐公司;GelDoc-It2 315 UVP 凝胶成像分析系统,美国UVP公司。

Tab.1 Primer sequence for real time quantitative PCR(RT-qPCR)
1.2 实验动物
135 只SPF 级SD 雄性大鼠,2~3 日龄,体重8.5~9.3 g,购于海南通用三洋药业有限公司,动物许可证号:SCXK(琼)2016-0012,饲养在SPF 级动物房。所有的程序均按照1996 年修订的美国国立卫生研究院(NIH)的《实验动物的饲养和使用指南》(第80-23 号出版物)进行,动物实验经海口市人民医院生物医学伦理委员会批准通过,编号:2017-(伦审)-094。
1.3 ALl模型建立、分组和处理
将大鼠按随机数字表法分为正常对照组、模型组、模型+大黄素组、模型+左氧氟沙星组和模型+大黄素和左氧氟沙星联合给药组,每组各9 只。除正常对照组外,其余各组ip给予LPS 10 mg·kg-1构建ALI 模型,正常对照组ip 给予等量生理盐水,造模后约2 h 大鼠逐渐出现高热、呼吸急促等症状,即模型成功[7]。造模成功后给药组分别单独或联合ip给予大黄素10 mg·kg-1[8]和左氧氟沙星10 mg·kg-1[9];正常对照组和模型组ip 给予等体积生理盐水。药后24 h,ip 给予10%水合氯醛麻醉并处死大鼠。使用无菌剪刀剪开大鼠颈部和胸部的皮肤组织,暴露胸腔。结扎右肺门,沿气管前壁插入注射器针头,注入PBS 0.5 mL,2 min 后吸出冲洗液并再次灌入肺组织,反复灌洗肺组织5次,双层医疗纱布过滤并收集灌洗液,同时分离肺组织,用于后续指标检测。
1.4 肺系数测定和ALl病理评分
取1.3 分组处理大鼠左肺,生理盐水漂洗,滤纸吸干表面水分,称重为肺湿重,肺系数=肺湿重(g)/体重(g)×100。将左肺固定于4%多聚甲醛,石蜡包埋、切片(3 μm)、苏木素-伊红染色,中性树胶封片,显微镜观察。由2名专业病理学老师根据文献[10]方法对以下4 个指标进行评分:①肺泡内充血;②肺间质水肿;③间隙或血管壁中性粒细胞浸润或聚集;④肺泡间隔增厚或透明膜形成。0 分代表无损伤,1 分代表损伤范围在25%以内,2 分代表损伤范围在25%~50%,3 分代表损伤范围在50%~75%,4分代表损伤范围>75%。4项得分之和作为肺组织的ALI病理评分。
1.5 吉姆萨染色法检测肺泡灌洗液中多形核白细胞(polymorphonuclear leukocyte,PMN)比例
将1.3 制备的肺泡灌洗液离心弃上清,加50 μL PBS 重悬,取10 μL 涂片进行瑞氏吉姆萨染色,在100×10 倍显微镜下观察涂片至少300 个细胞并计数,计算PMN 比例。经过瑞氏吉姆萨染色后,PMN中的中性粒细胞呈淡紫色、嗜酸性粒细胞呈粉红色、嗜碱性粒细胞呈紫蓝色。
1.6 ELlSA检测肺泡灌洗液中TNF-α,lL-1β和lL-6水平
收集1.3 分组大鼠给药后24 h 肺泡灌洗液,离心取上清,严格按照各ELISA 试剂盒说明书操作,测定各组肺泡灌洗液中TNF-α,IL-1β 和IL-6 水平。每个样本设置3个平行孔,使用酶标仪读取450 nm的吸光度值。通过样品的吸光度值和标准曲线计算样品浓度,单位为ng·L-1。
1.7 试剂盒检测肺组织MDA含量及SOD,GSH-Px和CAT活性
取1.3 制备的肺组织,研磨至匀浆后3000×g离心取上清,按照试剂盒说明书操作,测定上清液中MDA含量及SOD、GSH-Px和CAT活性。
1.8 Western 印迹法检测肺组织VEGF 和NF-κB p65蛋白表达水平
取1.3 制备的肺组织,加入适量RIPA 裂解液,冰上研磨裂解后提取总蛋白,使用BCA 蛋白浓度测定试剂盒检测蛋白浓度,加入上样缓冲液,沸水煮5 min 使蛋白变性,取30 μg 蛋白电泳分离蛋白,而后将蛋白转移至PVDF 膜上,5%脱脂奶粉室温封闭1 h,加入一抗(VEGF,1∶500;NF-κB p65,1∶1000;GAPDH,1∶1000),4 ℃过夜。TBST 洗膜3次,加二抗(1∶4000)孵育1.5 h,TBST 洗膜3 次后ECL 化学发光显色,采用Image J 图像分析软件分析积分吸光度值,以目标蛋白与GAPDH 积分吸光度比值表示目标蛋白表达水平。
1.9 RT-qPCR 检 测 肺 组 织VEGF 和NF-κB p65 mRNA表达
取1.3 制备的肺组织,Trizol 试剂提取总RNA,用紫外分光光度法检测总RNA 浓度。在逆转录酶催化下合成cDNA,并进行PCR 扩增。根据VEGF和NF-κB p65 的c-DNA 序列,用Primer 5.0 引物设计软件设计引物。PCR 反应体系25 μL:双蒸水17.3 μL,10×缓冲液2.5 μL,dNTP 2 μL,正向引物1 μL,反向引物1 μL,cDNA 模板1 μL,Taq 酶0.2 μL。进行PCR反应,PCR扩增条件:95 ℃5 min,95 ℃10 s,58 ℃30 s,72 ℃30 s,共进行35 个循环。将PCR产物置于琼脂糖凝胶电泳分离扩增片段,UVP凝胶成像分析系统对图片进行分析,以目的基因与GAPDH的积分吸光度值比值反映目的基因表达水平。
1.10 免疫组化检测肺组织中NLRP3表达
取1.3制备的肺组织,石蜡包埋、切片(3 μm),用0.5% H2O2处理5 min 灭活内源性过氧化物酶,用pH 6.0的柠檬酸缓冲液加热10 min进行抗原回收。室温下用1% BSA 封闭30 min 后,将切片与兔抗大鼠NLRP3 多克隆抗体(一抗,1∶1000)室温孵育1 h后,加二抗(1∶2000)孵育2 h。3,3'-二氨基联苯胺(DAB)显色(镜下观察至棕色),苏木素复染,梯度乙醇脱水,二甲苯透化,中性树脂封片。显微镜下观察,每个切片随机选取5个视野,棕黄色为阳性表达,蓝色为细胞核。用Image J 软件分析平均吸光度,平均吸光度=采集图像的吸光度总和/采集图像数。以平均吸光度反映NLRP3表达水平。
1.11 透射电镜观察各组大鼠肺组织自噬小体
取1.3 制备的肺组织,先用2.5%戊二醛预固定,再用1%锇酸固定1 h,乙醇梯度脱水1.5 h。环氧树脂浸透和包埋。Leica 超薄切片机切片,2%醋酸双氧铀和0.65%柠檬酸铅染色。采用透射电镜放大10 000 倍观察自噬小体,随机选取5 个视野观察计数,自噬小体呈双层或多层膜的液泡状结构。
1.12 统计学分析
2 结果
2.1 大黄素联合左氧氟沙星对LPS 所致ALl 大鼠ALl病理评分和肺系数的影响
如图1 所示,正常对照组大鼠肺泡结构清晰完整,肺泡间隔正常,肺泡及肺间质未见明显炎细胞浸润。模型组肺泡结构紊乱,肺泡间隔明显增宽,肺泡及肺间质大量炎症细胞浸润。大黄素单独给药组、左氧氟沙星单独给药组和联合给药组肺组织症状介于正常对照组与模型组之间,其中联合组与正常对照组最为接近。与正常对照组相比,造模后24 h,模型组肺系数和ALI病理评分均显著升高(P<0.01);与模型组相比,大黄素单独给药组、左氧氟沙星单独给药组和联合给药组大鼠肺系数(P<0.05,P<0.01)和ALI 病理评分(P<0.01)均显著降低;与单给大黄素或左氧氟沙星组相比,联合给药组肺系数(P<0.05)和ALI 病理评分(P<0.01)显著降低。
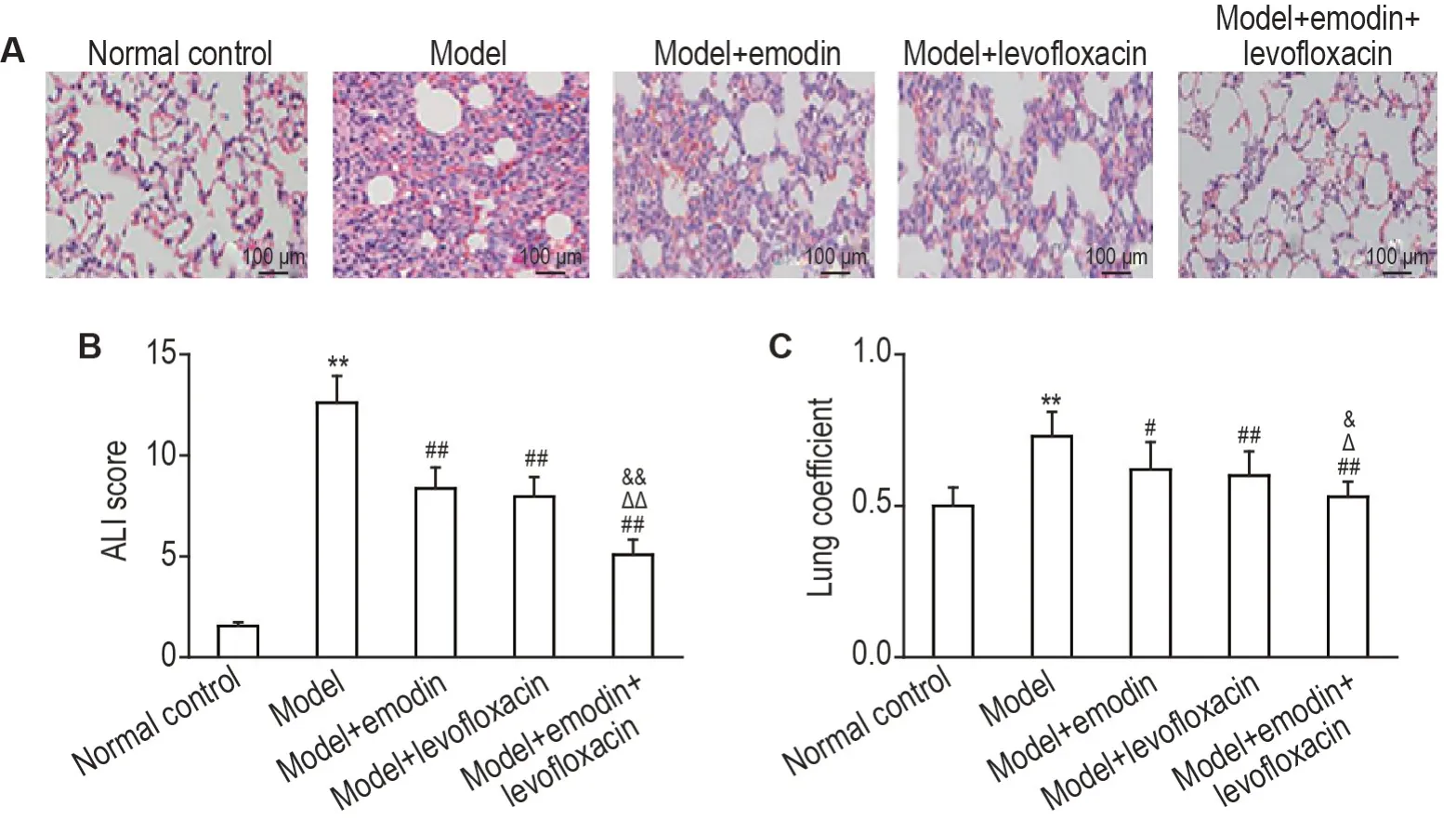
Fig.1 Effects of emodin combined with levofloxacin on acute lung injury(ALl)scores and lung coefficients in lipopolysaccharide(LPS)-induced ALl rats. Except for the normal control group,the rats were intraperitoneally injected with LPS 10 mg·kg-1 to establish an acute lung injury model,and the control group was intraperitoneally injected with the same volume of normal saline. After successful modeling,the model+emodin group was intraperitoneally injected with emodin 10 mg·kg-1 ,while the model+levofloxacin group with levofloxacin 10 mg·kg-1 ,the model+combination group with emodin 10 mg·kg-1 and levofloxacin 10 mg·kg-1,and the normal control group and LPS group with the same volume of normal saline. A:typical HE staining results of lung tissues;B and C:ALI score and lung coefficient of rats. Lung coefficient=wet weight of the lungs(g)/body weight(g)×100. ±s,n=9. **P<0.01,compared with normal control group;#P<0.05,##P<0.01,compared with model group;△P<0.05,△△P<0.01,compared with model+levofloxacin group;&P<0.05,&&P<0.01,compared with model+emodin group.
2.2 大黄素联合左氧氟沙星对LPS 所致ALl 大鼠肺泡灌洗液中PMN比例的影响
如图2 所示,与正常对照组相比,造模后24 h,模型组肺泡灌洗液中PMN 比例显著增加(P<0.01);与模型组相比,各给药组肺泡灌洗液中PMN比例显著降低(P<0.01),与单药给药组相比,联合给药组肺泡灌洗液中PMN 比例显著降低(P<0.05,P<0.01)。
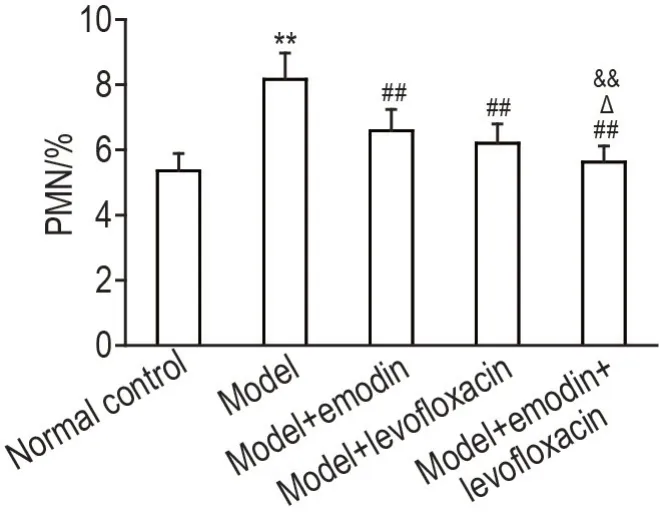
Fig.2 Effects of emodin combined with levofloxacin on polymorphonuclear(PMN)leukocyte counts in alveolar lavage fluid in LPS-induced ALl rats. See Fig.1 for the rat treatment. ±s,n=9. **P<0.01,compared with normal control group;##P<0.01,compared with model group;△P<0.05,compared with model+levofloxacin group;&&P<0.01,compared with model+emodin group.
2.3 大黄素联合左氧氟沙星对LPS 所致ALl 大鼠肺泡灌洗液中TNF-α,lL-1β和lL-6水平的影响
如图3 所示,与正常对照组相比,造模后24 h,模型组肺泡灌洗液中炎症因子TNF-α,IL-1β和IL-6的水平均显著升高(P<0.01);与模型组相比,各给药组肺泡灌洗液中TNF-α,IL-1β和IL-6的水平均显著降低(P<0.01),与单药给药组相比,联合给药组肺泡灌洗液中TNF-α,IL-1β和IL-6的水平显著降低(P<0.01)。
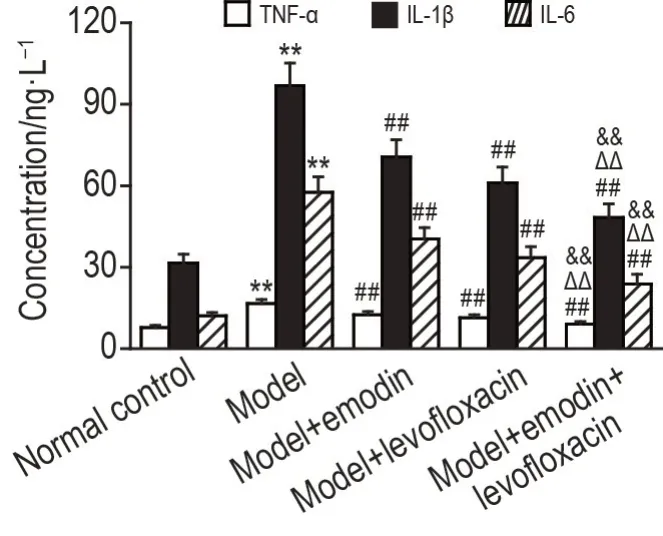
Fig.3 Effects of emodin combined with levofloxacin on levels of tumor necrosis factor-α(TNF-α),interleukin-1β(lL-1β)and lL-6 in the alveolar lavage fluid in LPS-induced ALl rats by ELlSA. See Fig.1 for the rat treatment. ±s,n=9. **P<0.01,compared with normal control group;##P<0.01,compared with model group;△△P<0.01,compared with model+levofloxacin group;&&P<0.01,compared with model+emodin group.
2.4 大黄素联合左氧氟沙星对LPS所致ALl大鼠肺组织MDA含量及SOD,GSH-Px和CAT活性的影响
如图4所示,与正常对照组相比,模型组肺组织中MDA 水平显著上升(P<0.01),SOD,GSH-Px 和CAT 活性均显著降低(P<0.01);与模型组相比,各给药组肺组织中MDA 含量均显著降低(P<0.01),SOD,GSH-Px 和CAT 活性均显著升高(P<0.01);与单药给药组相比,联合给药组肺组织中MDA 含量显著降低(P<0.01),SOD,GSH-Px 和CAT 活性显著升高(P<0.01)。

Fig.4 Effects of emodin combined with levofloxacin on malondialdehyde(MDA)content(A),superoxide dismutase(SOD),glutathione peroxidase(GSH-Px)and catalase(CAT)activities(B)in lung tissue in LPS-induced ALl rats. See Fig.1 for the rat treatment. ±s,n=9. **P<0.01,compared with normal control group;##P<0.01,compared with model group;△△P<0.01,compared with model+levofloxacin group;&&P<0.01,compared with model+emodin group.
2.5 大黄素联合左氧氟沙星对LPS 所致ALl 大鼠肺组织中VEGF 和NF-κB p65 mRNA 和蛋白表达水平的影响
RT-qPCR 和Western 印迹结果显示(图5 和图6),与正常对照组相比,模型组肺组织中VEGF和NF-κB p65 mRNA 和蛋白表达显著升高(P<0.01);与模型组相比,各给药组肺组织中VEGF 和NF-κB p65 mRNA 和蛋白表达均显著降低(P<0.01);与单药给药组相比,联合给药组肺组织中VEGF 和NF-κB p65 mRNA 和蛋白表达显著降低(P<0.01)。
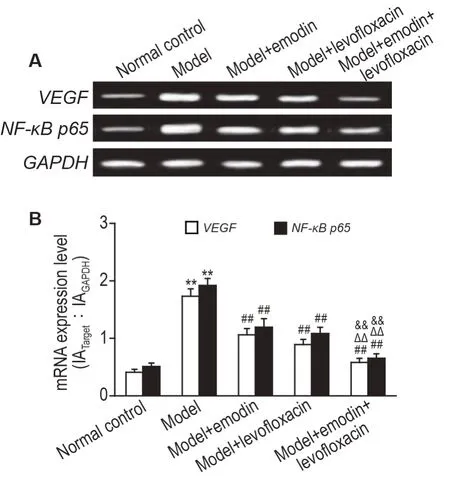
Fig.5 Effects of emodin combined with levofloxacin on mRNA expressions of VEGF and NF-κB p65 in lung tissue in LPS-induced ALl rats by RT-qPCR. See Fig.1 for the rat treatment. B was the semi-qualitative result of A.x ± s,n=9. **P<0.01,compared with normal control group;##P<0.01,compared with model group;△△P<0.01,compared with model+evofloxacin group;&&P<0.01,compared with model+emodin group.
2.6 大黄素联合左氧氟沙星对LPS 所致ALl 大鼠肺组织中NLRP3表达和自噬小体数量的影响
如图7 和图8 所示,与正常对照组相比,模型组大鼠肺组织中NLRP3表达和自噬小体数量明显增加(P<0.01);与模型组相比,各给药组肺组织中NLRP3表达和自噬小体数量明显降低(P<0.01),与单药给药组相比,联合给药组肺组织中NLRP3 表达和自噬小体数量明显降低(P<0.01)。
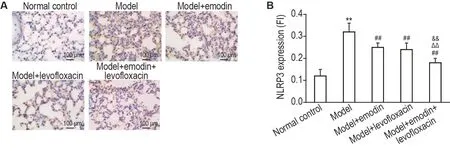
Fig.7 Effects of emodin combined with levofloxacin on expressions of NOD-like receptor thermal protein domain associated protein 3(NLRP3)in lung tissue in LPS-induced ALl rats by lmmunohistochemistry. See Fig.1 for the rat treatment. B was the semi-qualitative result of A. ±s,n=9. **P<0.01,compared with normal control group;##P<0.01,compared with model group;△△P<0.01,compared with model+levofloxacin group;&&P<0.01,compared with model+emodin group.
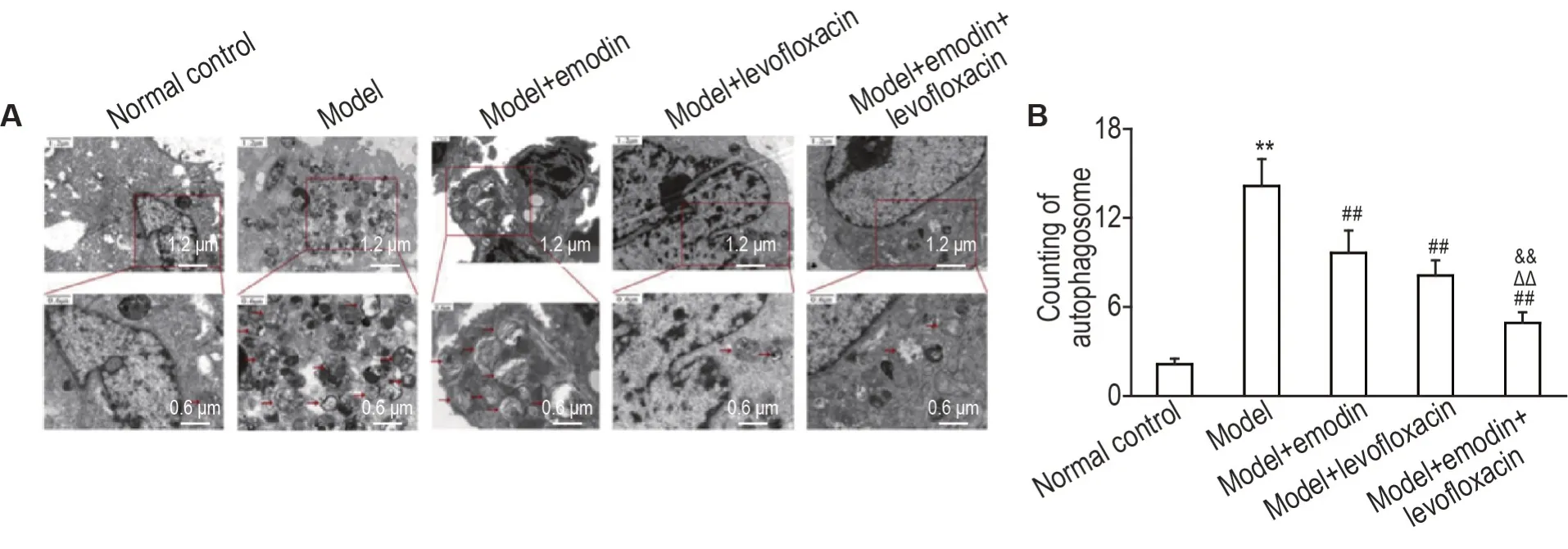
Fig.8 Effects of emodin combined with levofloxacin on number of autophagosome in lung tissue in LPS-induced ALl rats by transmission electron microscope. See Fig.1 for the rat treatment. A:transmission electron microscopy of autophagosome in lung tissue. B was the qualitative results of A. ±s,n=9. **P<0.01,compared with normal control group;##P<0.01,compared with model group;△△P<0.01,compared with model+levofloxacin group;&&P<0.01,compared with model+emodin group.
3 讨论
大黄素在多种病理情况下可发挥抗炎作用,在LPS 诱导的角膜炎、肾炎和肝炎动物模型中,大黄素可抑制炎症反应并减轻组织损伤[3]。在ALI 小鼠中,大黄素可抑制肺组织和外周血中炎症因子TNF-α和IL-6 表达[11]。已有研究发现,左氧氟沙星与中药联合使用不仅安全有效,还可通过调节炎症因子表达,降低炎症复发率[12]。本研究中,与大黄素或左氧氟沙星单独用药相比,大黄素联合左氧氟沙星可大幅降低肺系数和ALI 评分,降低肺泡灌洗液中PMN比例和促炎细胞因子TNF-α,IL-1β 和IL-6 的水平。表明大黄素和左氧氟沙星联用可较好抑制炎症反应,减轻肺损伤。
氧化应激是体内氧化与抗氧化作用失衡,产生大量氧化中间产物的一种状态。氧化应激可参与炎症级联反应,介导炎症细胞浸润和组织损伤,与ALI 的发生发展密切相关[13]。本研究发现,与大黄素或左氧氟沙星单独用药相比,大黄素联合左氧氟沙星可增加肺组织中抗氧化酶SOD,GSH-Px 和CAT活性,降低脂质过氧化产物MDA含量。提示大黄素和左氧氟沙星联用有利于减轻肺组织氧化应激损伤。
近年来研究发现,血管内皮生长因子VEGF 可调节血管通透性,影响组织的损伤和炎症[14]。在结肠炎中VEGF 可诱导结肠微血管内皮细胞通透性增加,加重肠道炎症;VEGF过表达还可增加新生小鼠肺动脉通透性[15],提示VEGF 可能参与急性肺损伤后肺毛细血管通透性的增加,参与肺水肿的形成。此外,LPS 诱导的ALI 与NF-κB 通路有关[16]。NF-κB 的活化可诱导多种组织炎症,且NF-κB 在VEGF 诱导的血管生成中起重要作用[17],表明VEGF 和NF-κB 可能参与LPS 诱导的大鼠ALI。本研究结果显示,与大黄素或左氧氟沙星单独用药相比,大黄素联合左氧氟沙星可抑制LPS 诱导的肺组织中VEGF 和NF-κB p65 水平升高,表明其可能通过降低肺组织VEGF 的表达和抑制NF-κB 信号通路发挥对ALI伤的保护作用。
另外,本研究中,大黄素联合左氧氟沙星可升高肺组织NLRP3 表达和自噬小体数量。自噬在维持细胞稳态和适应不利环境方面具有重要作用,但过度的自噬可诱导细胞凋亡,加重肺损伤的进程[18]。NLRP3 既受自噬与氧化应激的调控,又与炎症性疾病的发展密切相关[19]。
综上,大黄素联合左氧氟沙星可降低LPS 诱导的大鼠ALI,其机制可能与下调NF-κB/VEGF 信号通路,抑制炎症和氧化应激有关。本研究结果可为ALI的临床治疗与深入研究提供理论依据。
