神经内镜下手术治疗小脑出血与显微镜下开颅手术的疗效对比研究*
2023-11-06张入丹王剑波吴小波耿保伟张轶行
蒋 敏,张入丹,王剑波,吴小波,耿保伟,张轶行,廖 鹏
(重庆大学附属涪陵医院神经外科,重庆 408000)
小脑出血是脑血管疾病常见的急危重症,小脑出血原因较多,有高血压脑出血、动脉瘤破裂出血、抗凝药物引起凝血功能障碍导致脑出血等,其中高血压引起的脑出血最为常见。由于长期动脉粥样硬化引起血管慢性损伤,逐渐形成微小动脉瘤,成为自发性小脑出血的主要原因,小脑出血约占脑出血的9%,小脑出血的常见部位为小脑半球[1]。小脑位于后颅窝幕下相对狭小的空间,小脑出血后代偿空间有限,小脑紧邻脑干,出血后早期血肿压迫脑干,导致脑干损伤,随着血肿的逐渐增大,脑干受压进一步加重,小脑出血,尤其是当血肿破人四脑室,引起脑脊液循环不畅,短时间形成梗阻性脑积水,很快出现高颅压症状,诱发枕骨大孔疝,导致呼吸、心力衰竭,因此病情进展快,预后很差[2-3]。小脑出血的治疗方法主要有内科保守治疗和外科手术清除血肿治疗。外科手术清除血肿治疗有显微镜下开颅血肿清除手术、CT定位血肿穿刺引流术、神经内镜微创清除血肿手术等[4-5]。随着显微外科技术的发展,神经外科手术现已广泛应用显微外科技术,同时微创手术理念不断被用于临床实践[6]。研究表明,神经内镜下手术清除小脑血肿能与显微镜下清除小脑血肿取得同样好的疗效。现将本院收治的65例小脑出血患者采用神经内镜下血肿清除手术、显微镜下开颅血肿清除手术的治疗效果报道如下。
1 资料与方法
1.1 一般资料
回顾分析2017年1月至2020年1月重庆大学附属涪陵医院神经外科收治的65例小脑出血患者的临床资料,男44例(67.7%),女21例(32.3%);年龄31~75岁,平均(55.4±7.5)岁。其中行显微镜开颅血肿清除术(显微镜开颅手术组)41例,神经内镜下血肿清除术(神经内镜手术组)24例。纳入标准:(1)头部CT确诊为小脑出血,可伴有血肿破入脑室;(2)血肿量大于10 mL。排除标准:(1)年龄大于75岁;(2)脑动脉瘤、血管畸形所引起的小脑出血;(3)脑疝形成;(4)有严重全身系统疾病或凝血机制障碍不能耐受手术;(5)格拉斯哥(GCS)评分小于5分。两组临床资料比较差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组患者基线资料比较
1.2 手术方式
开颅手术:全身麻醉后患者取俯卧位,三钉头架固定头部,取枕下正中入路,作长约12 cm切口,切开皮肤及皮下组织,颅骨钻孔,取下直径约5 cm的骨瓣,剪开硬脑膜,选择无血管区皮质,在显微镜下进行皮质造瘘,仔细分离组织,直达血肿腔,清除血肿,确认血肿清除满意并彻底止血后,使用止血材料覆盖于血肿腔表面,缝合或减张缝合硬脑膜,根据脑组织塌陷情况还原或去除骨瓣,皮下留置引流管,逐层缝合头皮。术后将患者送回神经外科重症监护病房继续治疗,对患者实施镇静、镇痛,密切监测管理。
神经内镜手术:患者全身麻醉后取侧卧位,血肿侧位于上方,依据术前CT血肿最大层面和血肿边缘距枕骨内板最近处,来确定骨窗的中心位置,标出血肿的皮瓣投影范围。在头皮上标记出横窦、乙状窦和中线的位置,设计骨窗时应避开横窦、乙状窦[7],以骨窗的中心位置处皮肤纵行作长5 cm直切口。在枕骨麟部钻孔,用铣刀铣下直径约为3 cm的骨瓣,剪开硬脑膜,选择无血管区皮质,以双极电凝电凝局部皮质5 mm并稍切开。沿血肿最大层面方向缓慢置入手术扩张器,有明显突破感时,表示扩张器已进入血肿区域。按照预设的穿刺深度,穿刺至血肿底部,将透明内镜套筒置入血肿腔深部并固定,置入神经内镜和吸引器。周围血肿流入工作鞘内,予以吸引清除,操作均在血肿腔内进行。血肿腔壁黏附较紧部分血凝块不强行清除,否则易引发新的出血。小的渗血可用止血材料压迫,活动性出血的,可以通过双极电凝止血,深部止血满意,缓慢移出工作套筒,止血材料覆盖于血肿腔周壁止血。缝合硬脑膜,以连接片固定颅骨,缝合头皮各层。术后回到神经外科重症监护病房继续治疗,对患者实施镇静、镇痛,密切监测管理。术前、术后影像见图1,术中图片见图2。
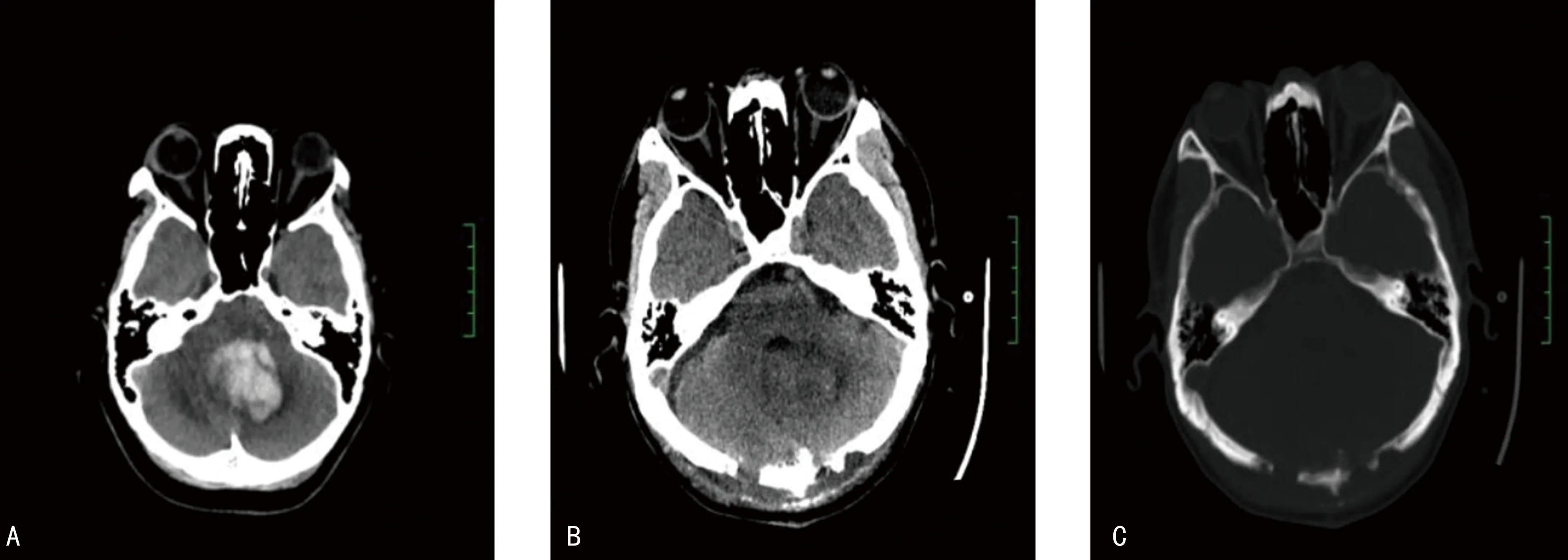
A:术前头颅CT;B:术后头颅CT,血肿清除满意;C:术后头颅CT,骨瓣复位满意。

A:术中皮肤纵行直切口;B:术中取下直径约3 cm的骨瓣;C:术中剪开硬脑膜;D:术中清除血肿;E:术中还原骨瓣。
1.3 疗效评价
患者术后1 d行头部CT检查,了解血肿清除、再出血及脑水肿等情况,对比术前、术后的CT检查结果,测算血肿清除率,测量水肿最大层面的直径并进行分级,分为轻度水肿、重度水肿。通过门诊或电话的方式进行随访,随访3个月,应用日常生活量表(ADL)进行疗效评定。
1.4 统计学处理
2 结 果
与显微镜开颅手术组比较,神经内镜手术组平均手术时间明显缩短(P<0.05),重度水肿发生率更低(P<0.05),枕部皮瓣下积液发生率更低(P<0.05)。两组平均血肿清除率、术后再出血率、病死率、术后3个月ADL评分预后良好率比较,差异均无统计学意义(P>0.05),见表2。
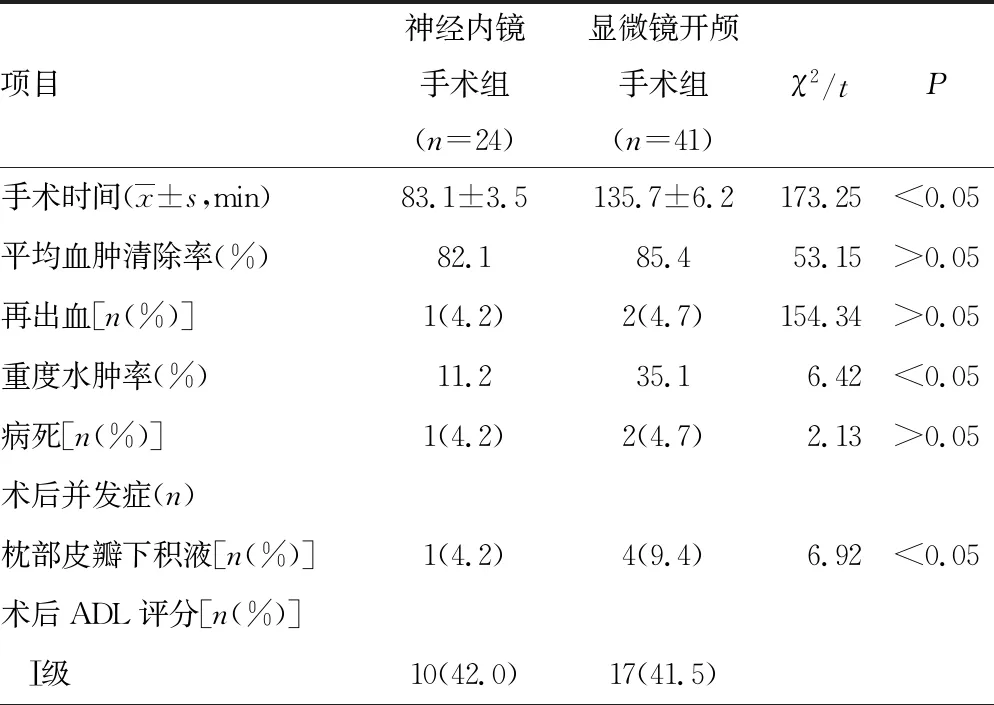
表2 两组各项指标比较
3 讨 论
小脑出血有其特殊性,后颅窝幕下容积有限,前方紧邻脑干,即使小脑少量的出血就有可能对脑干产生刺激甚至压迫,从而让病情迅速恶化[8]。因此,有手术指征的小脑出血患者,应尽快清除血肿,解除压迫,引流脑脊液,降低颅内压,争取最大限度保全神经功能,为脑功能恢复创造有利条件[9-10]。依据中国脑出血诊治指南(2019)小脑出血手术指征:血肿直径>3 cm或>10 mL,第四脑室受压或完全闭塞,有明显的占位效应及颅内高压[11]。小脑出血的手术方式包括传统的显微镜下开颅血肿清除术,早期的CT引导下穿刺引流术及现阶段的神经内镜下血肿清除术等。显微镜下开颅脑内血肿清除术血肿清除率较高,本组病例平均血肿清除率为85.4%,但手术时间长,本组病例平均手术时间为(135.7±6.2)min,术中脑牵拉较重、继发性脑损伤较重[12]。尤其当血肿位置比较深时,术中牵拉相对较重,术区周围重度脑水肿发生率为35.1%。神经内镜下脑内血肿清除术治疗小脑出血创伤小,能够迅速、有效地清除血肿组织,平均血肿清除发生率为82.1%,本组病例平均手术时间为(83.1±3.5)min,术中对脑组织基本上是零牵拉,脑组织损伤很小,术区周围重度脑水肿率为11.2%,明显低于显微镜下开颅脑内血肿清除术组。虽然,两种手术方法的手术时间和术区周围重度脑水肿发生率有差异,但是根据随访3个月时应用ADL评分进行疗效评定,两组的良好预后率差异无统计学意义(P>0.05)。
运用神经内镜行颅内血肿清除能有效清除血肿,在直视下彻底止血,运用内镜良好的照明,加上手术者熟练地运用“筷子技术”,达到手术时间短、术中出血少、术后脑水肿反应轻、再出血率低、术后神经功能恢复好的效果[13]。“筷子技术”是法国颅底神经外科医生SEBASTIEN FROELICH教授在经鼻入路神经内镜手术中,发现可以让术者同时操作“内镜、吸引器、第三个器械”,做到“人镜合一”[14]。皮肤切口为直切口,切口短,骨瓣小,手术时间明显缩短,手术创伤进一步减轻,使神经内镜组病例皮瓣下积液发生率明显降低。本研究中,神经内镜手术组有1例发生皮瓣下积液,开颅手术组有4例发生皮瓣下积液,但是,对良好预后率无明显影响。内镜可置入血肿腔内,全景化显露术野,避免血肿残留,尤其在处理小血肿时,神经内镜容易清除深部血肿,清除第四脑室血肿更加彻底,术后梗阻性脑积水发生率低;神经内镜能提供高清图像,术中易于发现活动性出血点,便于止血,降低再出血的概率,在手术过程中,不要一味地急于清除血肿,对血肿壁周围渗血,不要过度止血,可用止血纱或流体明胶压迫止血[15]。
但是神经内镜下血肿清除也有其局限性[16],在有限的透明内镜套筒空间内,需放置内镜、吸引器及双极电凝器械,操作空间有限。进行结构显露,清除血肿,神经内镜放置角度不同,存在观察死角,特别是远隔血肿可能有残留,对手术者的技术要求较高,需具备显微神经外科手术操作技巧,同时能熟练应用神经内镜技术。目前本科室把“筷子技术”运用到神经内镜下清除脑出血手术中,能有效避免通道内器械“打架”的情况,但是这项技术对于初学者来说不易掌握,需要在实践中反复练习,才能掌握其技术要点。
对于小脑出血量大,术前有脑疝形成的患者,需要去骨瓣减压,甚至打开枕骨大孔,充分减压,这个时候使用内镜技术是不合适的。如果血肿小,血肿位置比较深,尤其是血肿破入脑室时,可以考虑使用内镜技术。但内镜技术要求高,内镜操作的创伤更小,术中对脑组织零牵拉,能在较短时间内清除脑内血肿,及时解除脑组织受压,神经内镜下血肿清除术后脑水肿反应轻。因此,在临床中要灵活选择这两种手术方法,充分体现对脑出血的规范化、个性化的最优治疗,让患者最大限度获益。
综上所述,神经内镜下清除血肿和显微镜下清除血肿治疗小脑出血均能取得好的治疗结果,关键是术者对内镜技术和显微镜技术的掌握和熟练程度。
