PELP1、SETDB1在卵巢癌组织中的表达及意义*
2023-11-06黄吉仁李长江毛艳华张文文谢乐乐张应凤
黄吉仁,李长江,毛艳华,张文文,王 佳,谢乐乐,张应凤
(重庆医科大学附属大学城医院妇产科,重庆 401331)
卵巢癌是常见的妇科恶性肿瘤之一,其高发年龄集中在50岁以上,病死率居妇科恶性肿瘤首位,在女性所有肿瘤相关死亡原因中排名第五[1-3],严重影响女性的身心健康。目前卵巢癌的治疗方案为手术+化疗,但存在易复发及耐药等问题[4]。近年来,随着对卵巢癌发生、发展机制的深入研究,靶向精准治疗能有效降低复发率、提高生存率,但能接受靶向治疗的人群相对局限,且亦存在复发及耐药等问题,仍需寻找新的分子靶点[5-6]。组蛋白甲基化参与了多种恶性肿瘤的发生、发展,深入研究该过程的调控有望成为卵巢癌靶向治疗的新突破口[7-8]。
脯氨酸-谷氨酸-亮氨酸富集蛋白1(proline-,glutamic acid- and leucine-rich protein 1,PELP1)是多种转录因子及核受体的共调节剂。PELP1基因是激素依赖性肿瘤如乳腺癌、卵巢癌、子宫内膜癌等的原癌基因[9-12]。SET结构域分支型组蛋白赖氨酸甲基转移酶1(SET domain bifurcated histone lysine methytransferase 1,SETDB1)是一种甲基转移酶,它能够使组蛋白H3K9位点发生甲基化,影响基因的表达,进而介导肿瘤的发生[13-14]。已有研究证实,SETDB1在肺癌、乳腺癌、卵巢癌等多种恶性肿瘤组织中过度表达,发挥致癌作用[15-17]。由于组蛋白修饰过程具有可逆性[18],SETDB1有望成为治疗癌症的重要靶点。LIU等[19]关于乳腺癌激素治疗耐药性形成的一项研究中证实,PELP1与SETDB1存在相互作用。本研究旨在探索PELP1、SETDB1在卵巢癌组织及卵巢癌细胞系中的表达情况,分析与患者临床病理特征之间的联系,初步探讨两者在卵巢癌发生、发展过程中的作用,以期为临床上卵巢癌患者的基因靶向治疗提供新思路,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年7月至2022年5月本院妇产科行手术治疗且临床病理资料完整的35例卵巢癌患者组织标本,按2014年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)手术病理分期标准分为Ⅰ~Ⅱ期16例、Ⅲ~Ⅳ期19例,另选取同期收治因子宫肌瘤行子宫及双侧附件切除术的17例患者的正常卵巢组织作为对照。所有患者的组织标本均经病理检查明确诊断,所有患者术前均未行放化疗、生物治疗及内分泌治疗。本研究经医院医学伦理委员会审查通过(批准编号:LL-202240)。
1.2 方法
1.2.1主要试剂
RNA提取试剂 TRIzol购自宝生物工程(大连)有限公司;超微量紫外分光光度计购自美国 Thermo Fisher Scientific 公司;cDNA 逆转录试剂盒、SYBR Green 染料法荧光定量 PCR 技术检测试剂盒购自宝生物工程(大连)有限公司;PELP1引物(上游5′-CGG ACC AAG GTG TAT GCG ATA TT-3′,下游5′-CCA GTC TGC AAA CTC CCA TCA G-3′)、SETDB1引物(上游5′-GAA TCT TCC CGG CCT ACA GAA AT-3′,下游5′-AGA TCC TGG GAA CTG CTC TTC TT-3′)均由北京擎科生物科技有限公司合成;兔抗人SETDB1多克隆抗体、兔抗人PELP1单克隆抗体均购自英国Abcam公司;即用型SABC-POD(兔IgG)免疫组织化学试剂盒购自武汉博士德生物技术有限公司。
1.2.2细胞培养
将卵巢癌细胞A2780(购自上海中乔新舟生物科技有限公司)、OVCAR3(购自武汉普诺赛生命科技有限公司)、SKOV3(购自武汉普诺赛生命科技有限公司)加入含10%胎牛血清的RPMI 1640培养基中,正常卵巢上皮细胞IOSE80(购自上海中乔新舟生物科技有限公司)加入含10%胎牛血清的DMEM高糖培养基中,置于37 ℃、5% CO2培养箱内培养,胰蛋白酶消化传代,取对数生长期细胞提取RNA。
1.2.3实时荧光定量逆转录PCR
按TRIzol试剂说明书采用苯酚-氯仿抽提法提取细胞总RNA。按逆转录PCR试剂说明书首先配制20 μL逆转录PCR体系,37 ℃孵育15 min,85 ℃ 5 s终止反应合成cDNA。取 4 μL cDNA 为模板,配制 20 μL实时荧光定量PCR反应体系,使用PCR 扩增仪按预变性 95 ℃ 30 s,变性95 ℃ 5 s,退火延伸 60 ℃ 30 s,扩增 40 个循环的条件进行反应。以GADPH为内部参照物,SETDB1和PELP1 mRNA的相对表达水平通过 2-ΔΔCt法计算得到。
1.2.4免疫组织化学
石蜡组织切片经脱蜡、水化后进行抗原热修复,过氧化氢抑制内源性过氧化物酶活性后以牛血清封闭。以1 × PBS溶液配制1∶400兔抗人PELP1抗体工作液、1∶400兔抗人SETDB1抗体工作液,充分覆盖组织切片。4 ℃ 孵育过夜。滴加生物素标记山羊抗兔IgG,37 ℃孵育30 min后滴加SABC。使用二氨基联苯胺显色,苏木素复染。结果判定根据阳性细胞所占比例及染色强度综合评分:(1)阳性细胞所占比例评分:<10% 记0分,10%~<26%记1分,26%~<51%记2分,51%~<76%记3分,≥76%记4分;(2)染色强度评分:无着色记0分,浅黄色记1分,棕黄色记2分,棕褐色记3分。阳性细胞所占比例评分与染色强度评分相乘即为综合评分,综合评分 0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++);以(-)~(+)判定为阴性表达,(++)~(+++)判定为阳性表达。
1.2.5观察指标
(1)PELP1、SETDB1 mRNA在卵巢癌细胞及正常卵巢上皮细胞中的相对表达水平;(2)PELP1、SETDB1蛋白在不同卵巢组织中的阳性表达率。
1.3 统计学处理
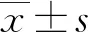
2 结 果
2.1 PELP1、SETDB1 mRNA的表达情况
PELP1 mRNA在卵巢癌细胞系A2780、OVCAR3、SKOV3中的表达水平分别为15.967±1.140、10.266±0.776、4.168±0.200,均高于正常卵巢细胞系IOSE80(1.004±0.090),差异有统计学意义(P<0.05)。SETDB1 mRNA在卵巢癌细胞系A2780、OVCAR3、SKOV3中的表达水平分别为 1.720±0.071、2.232±0.271、4.157±0.016,均高于正常卵巢细胞系IOSE80(1.005±0.093),差异有统计学意义(P<0.05),见图1。
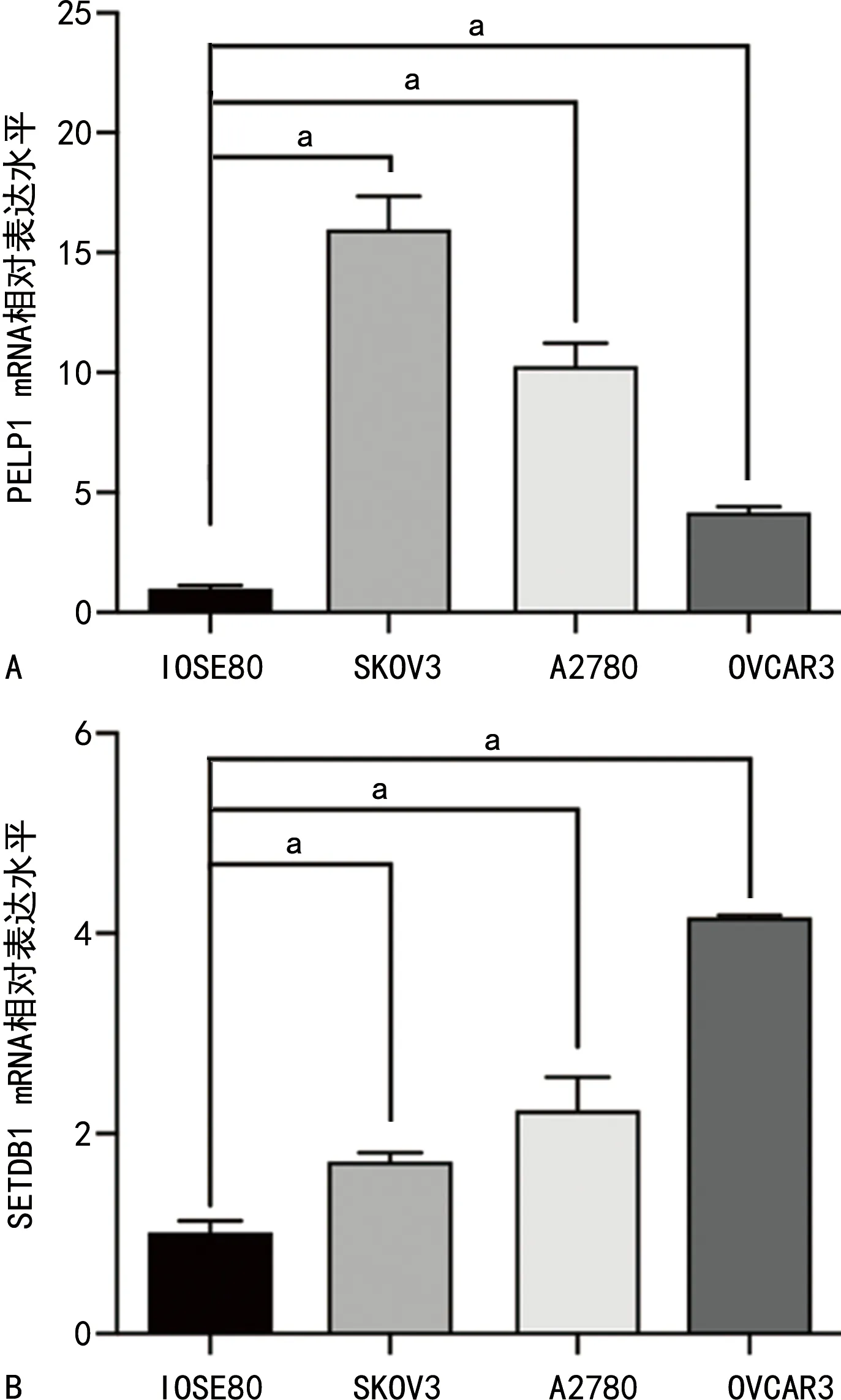
A:PELP1 mRNA相对表达情况;B:SETDB1 mRNA相对表达情况;a:P<0.05。
2.2 PELP1、SETDB1蛋白的表达情况
卵巢癌及正常卵巢组织大体标本见图2。PELP1蛋白主要表达于细胞核中,其在卵巢癌组织中呈棕黄色至棕褐色阳性表达,在正常卵巢组织中呈淡黄色弱阳性或不着色阴性表达。SETDB1蛋白的表达则位于细胞质,其在卵巢癌组织中呈淡黄色弱阳性或不着色阴性表达,与正常卵巢组织无差异,见图3。卵巢癌组织中PELP1蛋白阳性表达率高于正常卵巢组织,差异有统计学意义(P<0.05);二者SETDB1蛋白阳性表达率比较,差异无统计学意义(P<0.05),见表1。
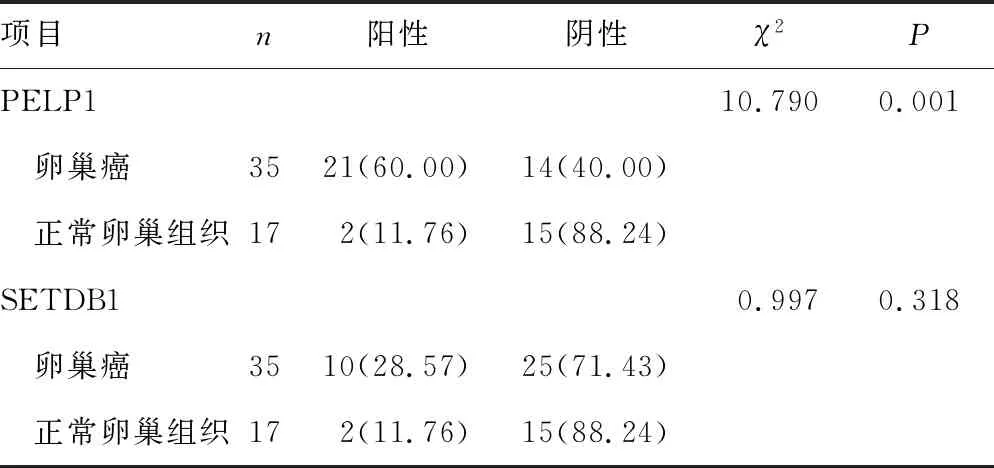
表1 卵巢癌组织与正常卵巢组织中PELP1、SETDB1蛋白表达情况比较[n(%)]
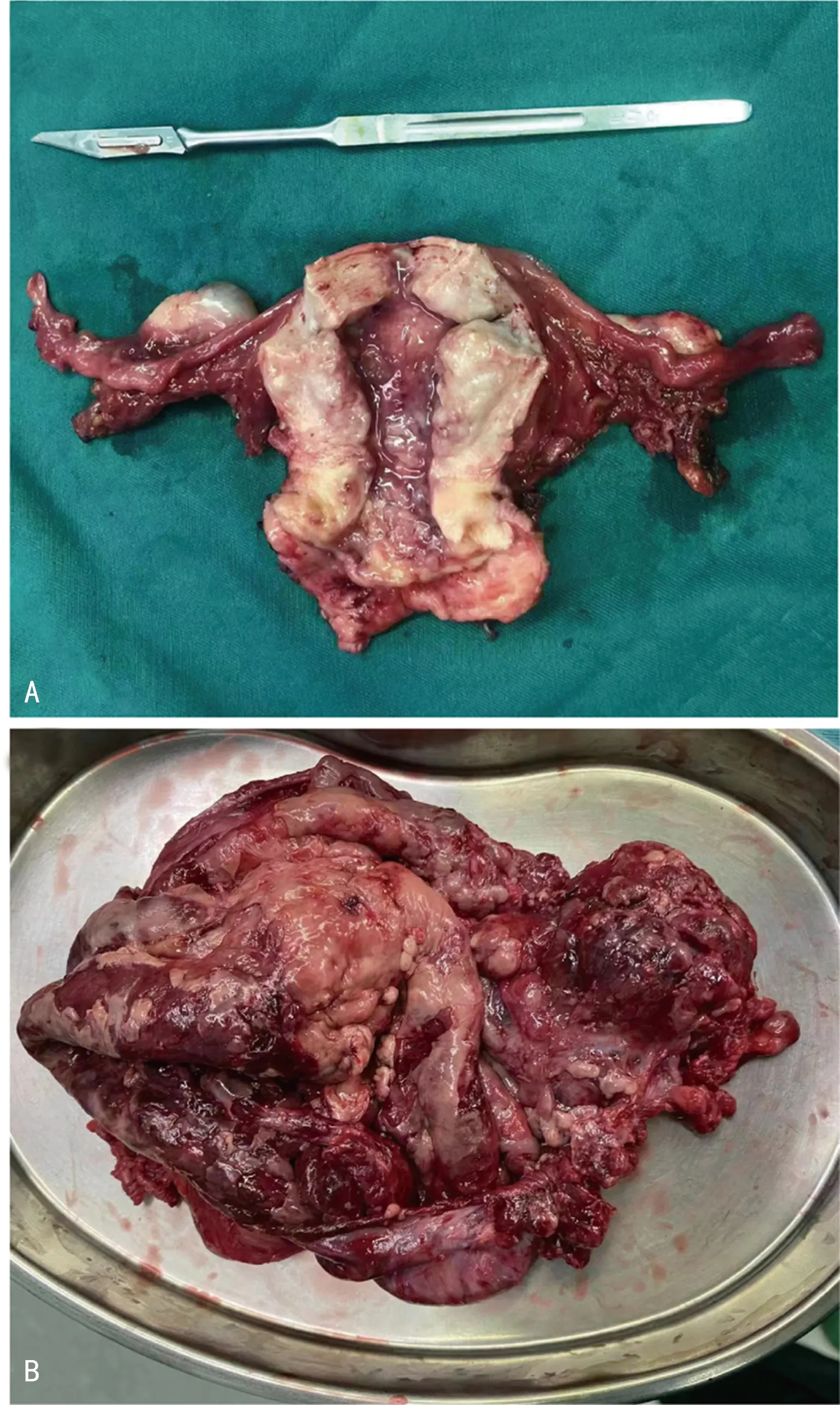
A:正常卵巢组织;B:卵巢癌组织。
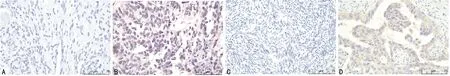
A:正常卵巢组织中PELP1蛋白表达情况;B:卵巢癌组织中PELP1蛋白表达情况;C:正常卵巢组织中SETDB1蛋白表达情况;D:卵巢癌组织中SETDB1蛋白表达情况。
2.3 PELP1、SETDB1蛋白表达与临床病理特征间的关系
基于卵巢癌的高发病年龄多集中在50岁以上,根据患者年龄是否>50岁将其分为两组,分析卵巢癌组织中PELP1、SETDB1蛋白表达情况与相应患者临床病理资料之间的相关性。结果表明,不同FIGO分期、淋巴结转移情况的PELP1蛋白阳性表达比较,差异有统计学意义(P<0.05),见表2。
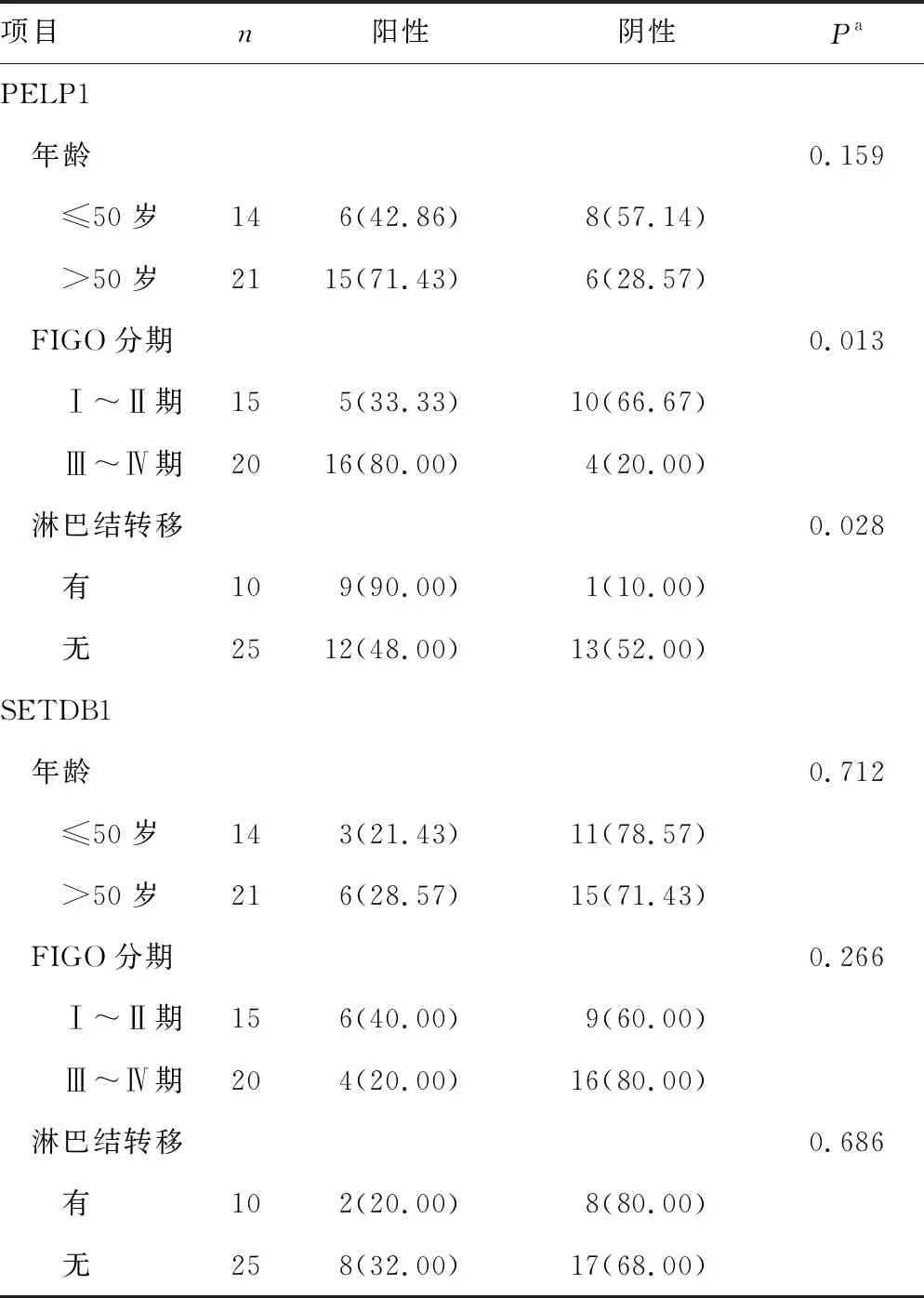
表2 PELP1、SETDB1蛋白表达与卵巢癌患者临床病理特征的关系[n(%)]
3 讨 论
随着对卵巢癌认识和研究的不断深入、诊疗水平的不断提升,卵巢癌患者的预后逐渐得到改善,但其病死率仍常年居于妇科肿瘤首位[20]。近年来,靶向治疗成为有效降低卵巢癌复发率、提高患者生存率的治疗措施[21]。目前,靶向药物主要包括抗血管生成药物、聚腺苷二磷酸核糖聚合酶抑制剂及免疫检查点抑制剂等,但其获益人群相对有限,也存在耐药、骨髓抑制等问题,仍需继续寻找新的分子靶点[5-6]。
近年来,表观遗传调控在癌症发生、发展中的作用得到了广泛研究。PELP1是一种支架蛋白及多种转录因子、核受体的共调节剂,通过其N-末端包含的LXXLL基序或C-末端富含谷氨酸的区域与多种转录因子及核受体的相应结构域发生相互作用,进而发挥其生物学效应[9]。PELP1基因定位于17p13.2,编码长度为1 130个氨基酸组成的蛋白,表达于人脑、睾丸、卵巢及子宫等部位[22-23]。研究表明,PELP1是激素依赖性肿瘤如乳腺癌、卵巢癌、子宫内膜癌的原癌基因,此外,在激素非依赖性肿瘤如脑肿瘤、肺癌和结直肠癌中亦有作用[24-25]。目前,PELP1在卵巢癌中的临床价值尚不清楚,本研究表明,相较于正常卵巢组织,卵巢癌组织中PELP1蛋白的表达水平明显升高,此外PELP1 mRNA在几种卵巢癌细胞中的表达也明显高于正常卵巢细胞。分析其与患者临床病理特征的联系,发现不同FIGO分期、淋巴结转移情况的PELP1蛋白阳性表达比较,差异有统计学意义(P<0.05)。因此推测PELP1可能是一种重要的促癌蛋白,在卵巢癌的侵袭转移过程中起到一定的促进作用。
组蛋白甲基化是常见的表观遗传修饰之一,此过程可由甲基转移酶介导。SETDB1由1 291个氨基酸组成,其编码基因位于1q21.3,长度为50 000 bp[14],表达于人的睾丸、卵巢、阑尾及脑组织等部位。SETDB1可催化组蛋白H3上的赖氨酸9残基发生二甲基化或三甲基化,加重染色质的致密程度,DNA缠绕于组蛋白上组成染色质,其致密程度加重后使得该部位的DNA转录过程变得更难,进而影响基因的表达[14]。研究表明,SETDB1参与了多种肿瘤的发生、发展[26]。由于SETDB1引起原癌基因或抑癌基因沉默或转录抑制的不确定性,使得其在某些组织中表现为肿瘤抑制作用,在另外一些组织中表现为肿瘤促进作用。
LIU等[19]关于乳腺癌激素治疗耐药性形成的一项研究中证实了PELP1对SETDB1介导的蛋白激酶B(Akt)激活至关重要,但PELP1是否能够调节SETDB1介导的其他生物学功能,如表观遗传修饰、p53信号通路传导、细胞周期调控、上皮间质转化及肿瘤转移等,仍有待进一步研究。王巍等[16]、董红玲[17]的研究结果表明,SETDB1在卵巢癌组织及卵巢癌细胞中均呈高表达,并能促进卵巢癌细胞的增殖、侵袭和迁移,与患者的不良预后密切相关。本研究与上述两位学者的研究结果有所不同的是,相较于正常卵巢组织,SETDB1蛋白在卵巢癌组织中的表达并无明显差异,但SETDB1 mRNA表达水平在几种卵巢癌细胞系中相较于正常卵巢细胞系明显升高,故SETDB1在卵巢癌的发生、发展过程中是否起到作用仍需深入研究。本研究表明PELP1与SETDB1 mRNA表达水平在几种卵巢癌细胞系中均明显升高,PELP1蛋白在卵巢癌组织中呈高表达,SETDB1蛋白在卵巢癌及正常卵巢组织中的表达无明显差异,结合文献推测PELP1能参与调节SETDB1的表观遗传修饰功能,并可能作用于蛋白质转录后翻译过程,负性调控SETDB1蛋白的表达,使得原癌基因组蛋白H3K9位点甲基化程度减弱,染色质的致密性程度减弱,转录活性增强,进而促进卵巢癌的发生、发展。
目前,国内外关于PELP1、SETDB1在卵巢癌中的研究鲜有报道,在卵巢癌中,PELP1是否能够调节SETDB1蛋白的表达、是否参与SETDB1的表观遗传修饰过程,以及SETDB1介导的组蛋白甲基化这一表观遗传修饰过程在不同组织中对不同基因是否具有选择性等问题仍需深入研究。在后期的研究中,本课题组拟扩大样本量,进一步验证SETDB1基因在卵巢癌组织中的表达情况。预期的研究结论为,PELP1与SETDB1在卵巢癌组织及卵巢癌细胞中均高表达,并可促进卵巢癌细胞的增殖、侵袭和迁移能力,PELP1蛋白与SETDB1蛋白存在相互作用,PELP1参与调控SETDB1的表观遗传修饰过程,并进一步影响基因的表达。
与基因组变异不同,组蛋白甲基化作为一种表观遗传调控方式,其过程是可逆的,因此,从逆转表观遗传修饰的角度着手,如通过调节组蛋白甲基转移酶-去甲基化酶动态调节组蛋白甲基化过程,靶向逆转异常的基因表达,可能为卵巢癌的治疗提供一种新的思路。
综上所述,PELP1基因在卵巢癌组织及卵巢癌细胞中均呈高表达,其在卵巢癌中可能发挥了重要的促癌作用。此外,PELP1可能对SETDB1有一定的调控作用,两者有望成为卵巢癌靶向治疗的新突破口。
