UO126干预MSCs修复肺上皮细胞损伤的作用研究*
2023-11-06吴友良刘富春
冯 静,吴友良,陈 霞,杨 艳,向 萍,刘富春
(陆军第九五八医院儿科,重庆 400020)
急性肺损伤(acute lung injury,ALI)/急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是一种死亡率高达40%~70%的肺部炎症性疾病,现有临床治疗措施有限且疗效较差。间充质干细胞(mesenchymal stem cells,MSCs)因具备组织损伤修复、免疫调控等功能,在ALI/ARDS治疗方面表现出强大的治疗潜力[1],但部分临床研究也发现单独MSCs移植效果尚未达到临床治愈标准,在减少肺上皮细胞氧化应激损伤及凋亡等方面存在不足[2]。如何提高MSCs修复功能将成为促进其未来临床推广应用的关键。本课题组前期证实了MSCs可修复脂多糖(lipopolysaccharide,LPS)诱导的ALI细胞模型中肺上皮细胞(alveolar epithelial cells,AEC)损伤。最新研究已发现,机体出现ALI的关键机制之一在于体内的活性氧产生增加,从而导致细胞凋亡加速,而MEK1/2特异性抑制剂(UO126)能有效抑制细胞氧化损伤[3]。因此本研究首先采用LPS诱导AEC损伤,然后将UO126加入AEC和MSCs共培养液中,探索UO126在MSCs干预LPS诱导ALI细胞模型中的作用,为提高MSCs移植疗效提供新举措,现报道如下。
1 材料与方法
1.1 材料
1.1.1细胞
人正常肺上皮细胞株和骨髓MSCs购自武汉普诺赛生命科技有限公司。
1.1.2主要试剂
线粒体膜电位测定试剂盒、CCK-8检测试剂盒购自东仁化学科技(上海)有限公司,细胞腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)测定试剂盒购自上海碧云天生物技术有限公司,TUNEL细胞凋亡检测试剂盒、caspase-1活性检测试剂盒购自大连美仑生物技术有限公司,特级胎牛血清购自美国Clark Bioscience公司,UO126购自北京百奥莱博科技有限公司,融合蛋白1 (Mitofusin 1,MFN1)、线粒体RhoGTP酶1(mitochondrial Rho-GTPase 1,Miro1)、核转录因子(nuclear respiratory factor,NRF1)、过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator-activated receptor γ coactiva-tor-1,PGC-1α)、线粒体转录因子A(mitochondrial transcription factor A,TFAM)ELISA检测试剂盒购自武汉菲恩生物科技有限公司。
1.2 方法
1.2.1实验分组
实验分成AEC组、AEC+LPS组、AEC+LPS+MSCs组、AEC+LPS+MSCs+UO126(配制浓度为0.3 nmol/L)组。UO126配制浓度根据前期实验及RAHMAN等[4]研究。
1.2.2LPS诱导肺上皮细胞损伤模型的建立
取AEC 5×106/mL接种于6孔板DEME培养液中,根据既往课题组研究加入10 μg/mL的LPS继续培养,建立ALI细胞模型。
1.2.3AEC和MSCs共培养
AEC培养液中加入10 μg/mL LPS,37 ℃,5% CO2培养箱中培养72 h。取MSCs悬液500 μL,细胞密度5×106/mL直接加入AEC培养瓶中,5% CO2培养箱中培养48~72 h。
1.2.4流式细胞分选术
无菌条件下采用流式细胞分选术,将混合共培养AEC和MSCs相互分离。利用增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)的标记将其中阴性表达的上皮细胞群进一步分选,将分选出的细胞接种于96孔板内激光共聚焦显微镜下观察,证实分选出的细胞为EGFP阴性,且呈现出内皮细胞特征性的大小均一的短梭形状。分选出的用于后续的细胞凋亡、细胞活性分析等实验。
1.2.5CCK-8 测定
检测加入UO126 48 h后对AEC及共培养细胞活力的影响。在96孔板中接种细胞悬液(100 μL/孔),将培养板放在培养箱预培养(在37 ℃,5% CO2的条件下),向每孔加入10 μL的CCK-8溶液,继续将培养板在培养箱内培养1~4 h。用酶标仪测定在450 nm处的吸光度(A)值。
1.2.6线粒体膜电位的测定
把配制好的JC-1染色工作液用JC-1染色缓冲液稀释5倍,加入0.2 mL总蛋白量为100 μg纯化的线粒体,用荧光分光光度计检测。
1.2.7细胞ATP测定
加100 μL ATP检测工作液到检测孔或检测管内。在检测孔或检测管内加上20 μL样品或标准品,迅速用枪(微量移液器)混匀,至少间隔2 s后,用光度计或液闪仪测定相对光单位(relative light unit,RLU)值。根据标准曲线计算出样品中ATP的浓度。
1.2.8TUNEL检测细胞凋亡
免疫染色固定液(P0098)固定细胞30 min,再加入免疫染色强力通透液(P0097)室温孵育5 min。荧光显微镜下观察细胞并计算凋亡率。
1.2.9caspase-1活性检测
用按照每200万细胞加入100 μL裂解液的比例加入裂解液,重悬沉淀,冰浴裂解15 min。把上清液转移到冰上预冷的离心管中,立即测定caspase-1的酶活性或-70 ℃保存样品。
1.2.10线粒体相关蛋白水平测定
采用生物素耦联抗体作为检测抗体,依次将标准品、待测样品和生物素耦联检测抗体加入孔中,用洗涤液洗去未结合的成分。加入辣根过氧化物酶(horseradish peroxidase,HRP)-链霉亲和素,用洗涤液洗去未结合的偶联物。再将四甲基联苯胺(trimethylbenzene,TMB)底物溶液添加到每个孔中进行显色。通过添加硫酸溶液终止酶-底物反应,并通过分光光度法在450 nm 的波长处测定A值,通过曲线软件方程计算蛋白水平。
1.3 统计学处理
2 结 果
2.1 各组细胞形态及数量比较
镜下可见AEC组细胞贴壁生长,呈梭形、扁平立方形、多角形等多种形态生长,以梭形最为常见,AEC+LPS组细胞数量减少。AEC+LPS+MSCs组可见呈短梭形、三角形或多边形生长的MSCs,AEC+LPS+MSCs+UO126组两种细胞均可见,数量较AEC+LPS+MSCs组增加,见图1。
2.2 各组细胞活力比较
AEC+LPS组细胞活力较AEC组降低,而AEC+LPS+MSCs组细胞活力较AEC+LPS组升高,AEC+LPS+MSCs+UO126组较AEC+LPS+MSCs组升高,差异有统计学意义(P<0.05),见图2。
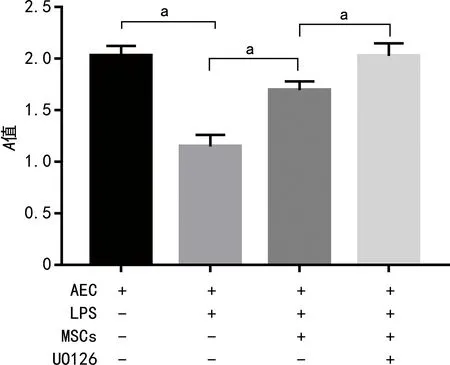
a:P<0.05。
2.3 各组线粒体膜电位比较
AEC+LPS组线粒体膜电位较AEC组降低,而AEC+LPS+MSCs组线粒体膜电位较AEC+LPS组升高,AEC+LPS+MSCs+UO126组较AEC+LPS+MSCs组升高,差异有统计学意义(P<0.05),见图3。
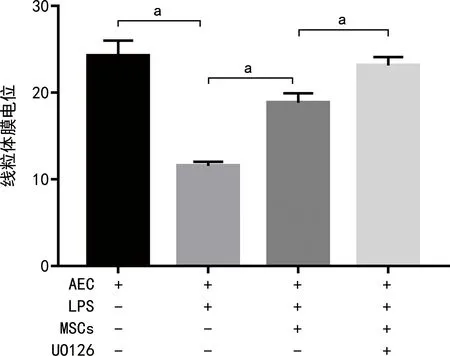
a:P<0.05。
2.4 各组ATP值比较
AEC+LPS组ATP值较AEC组降低,而AEC+LPS+MSCs组ATP值较AEC+LPS组升高,AEC+LPS+MSCs+UO126组较AEC+LPS+MSCs组升高,差异有统计学意义(P<0.05),见图4。
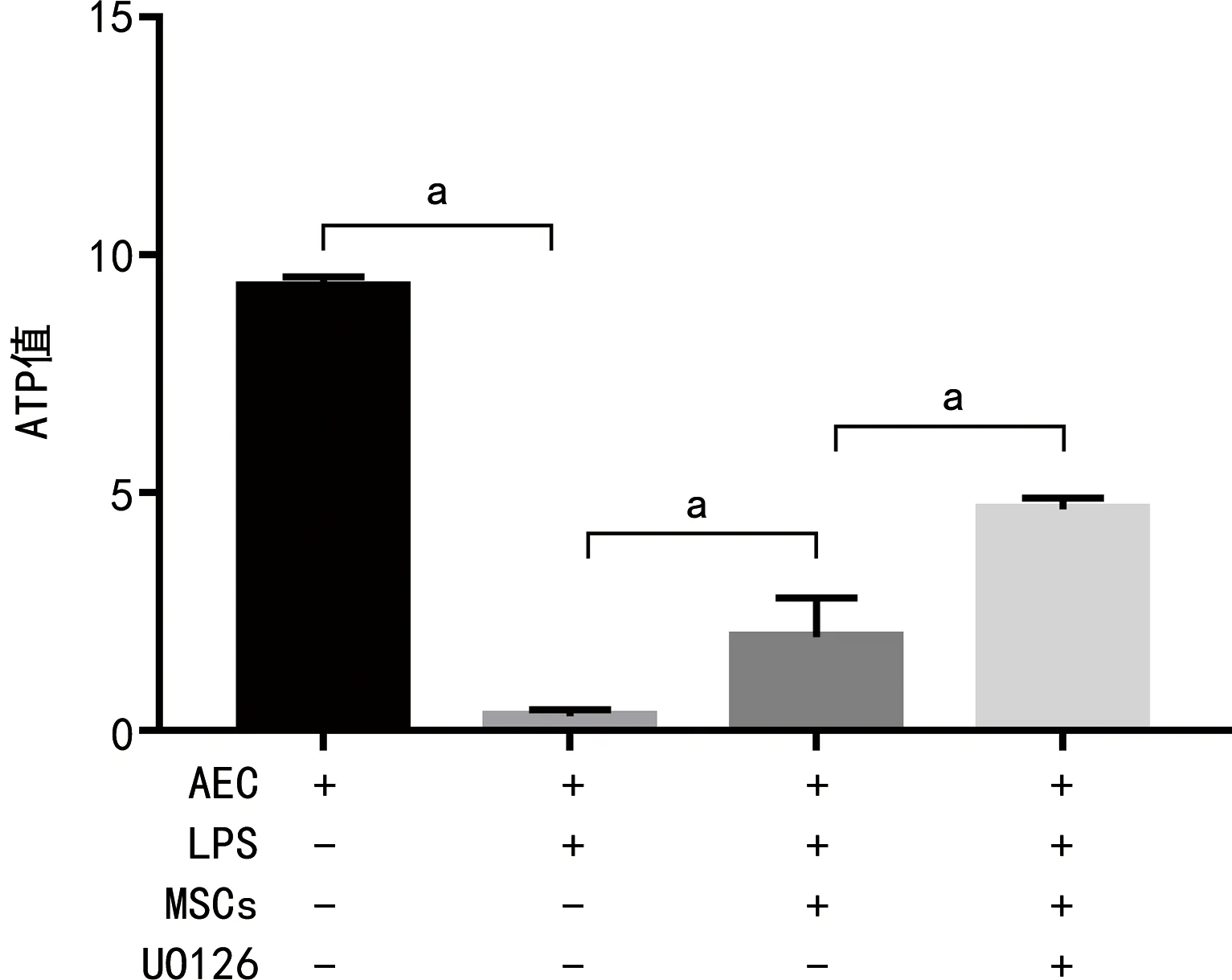
a:P<0.05。
2.5 各组细胞凋亡指数比较
AEC+LPS组细胞凋亡指数较AEC组升高,而AEC+LPS+MSCs组细胞凋亡指数较AEC+LPS组降低,AEC+LPS+MSCs+UO126组较AEC+LPS+MSCs组降低,差异有统计学意义(P<0.05),见图5。
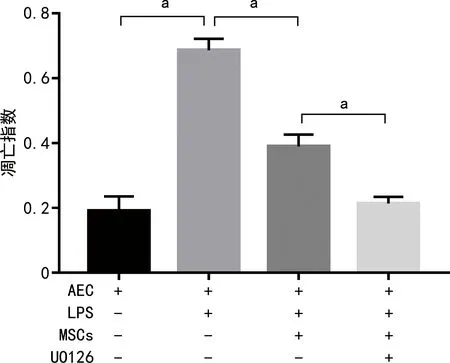
a:P<0.05。
2.6 各组caspase-1活性比较
AEC+LPS组caspase-1活性较AEC组升高,而AEC+LPS+MSCs组caspase-1活性较AEC+LPS组降低,AEC+LPS+MSCs+UO126组较AEC+LPS+MSCs组降低,差异有统计学意义(P<0.05),见图6。
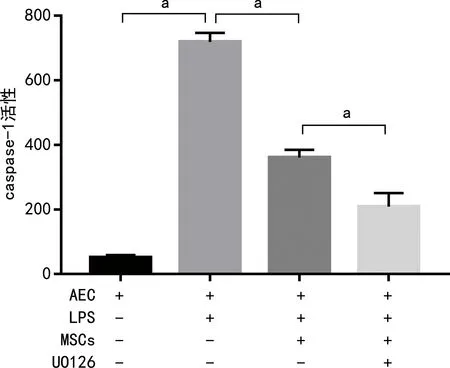
a:P<0.05。
2.7 各组细胞培养液线粒体蛋白水平比较
AEC+LPS组MFN1、Miro1、NRF1、PGC-1α、TFAM水平较AEC组降低,而AEC+LPS+MSCs组MFN1、Miro1、NRF1、PGC-1α、TFAM水平较AEC+LPS组升高,AEC+LPS+MSCs+UO126组Miro1、TFAM水平较AEC+LPS+MSCs组升高,差异有统计学意义(P<0.05),见图7。
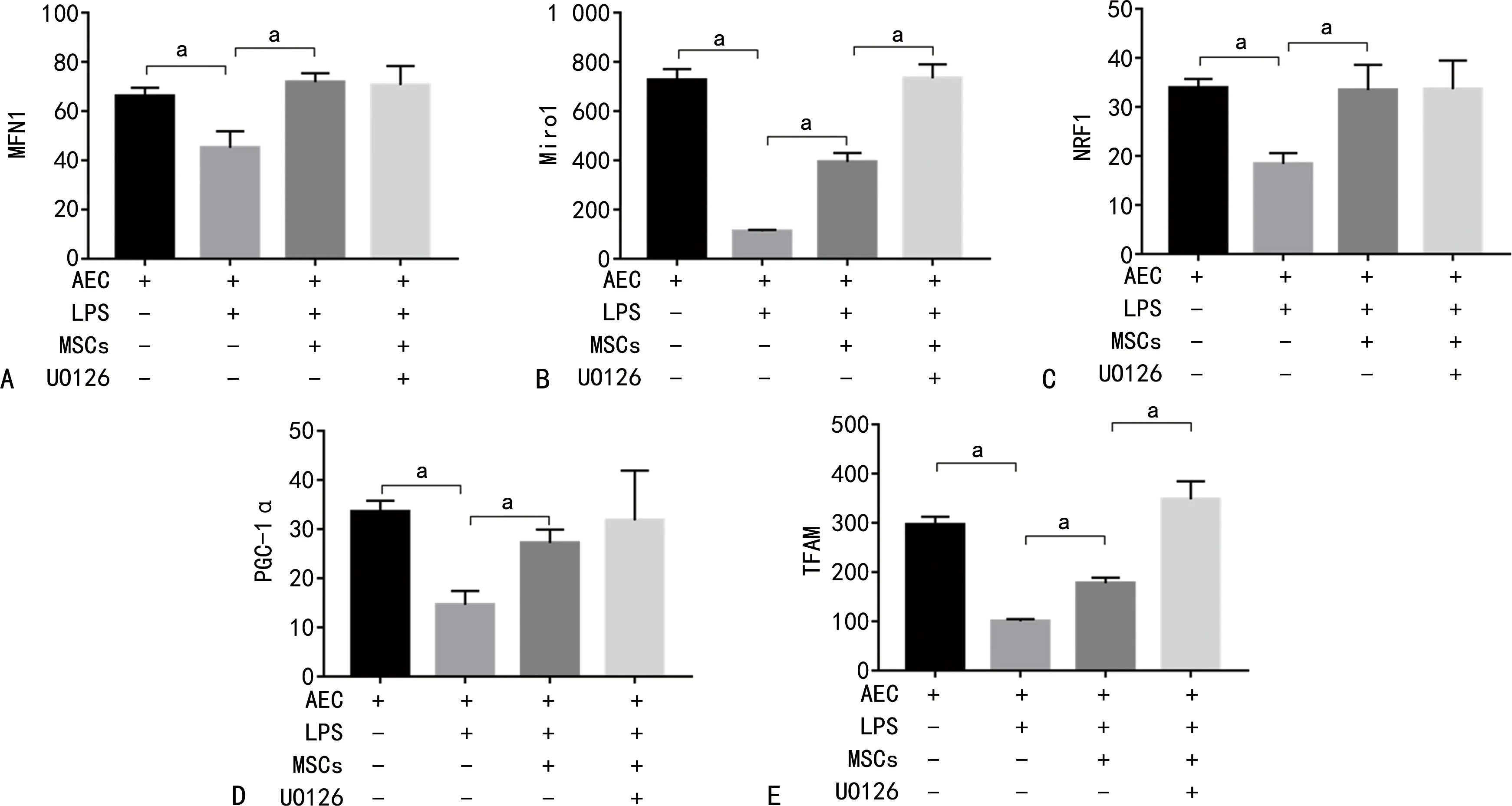
A:MFN1蛋白水平比较;B:Miro1蛋白水平比较;C:NRF1蛋白水平比较;D:PGC-1α蛋白水平比较;E:TFAM蛋白水平比较;a:P<0.05。
3 讨 论
ALI常见病理表现为弥漫性 AEC损伤,导致 AEC的过度炎症和凋亡,肺部持续性和重复性损伤可导致肺纤维化,形成不可逆的、严重呼吸功能损伤[5]。 由于现有治疗药物的药代动力学研究不足、个体差异性等多种因素,目前仍缺乏有效的ALI治疗药物。国内外学者为探求ALI新治疗措施,开展大量动物或细胞模型研究,其中LPS作为重要的炎症诱导物被广泛应用[6]。近年来开展的有关ALI临床创新研究中,MSCs移植已被证实是一种极具有潜力的治疗手段。MSCs不仅有免疫及替代作用,且分泌的外泌体可介导miR-23a-3p和miR-182-5p通过抑制B细胞κ轻肽基因增强子抑制因子激酶ε(Inhibitor of kappa light polypeptide gene enhancer in B-cells kinase epsilon,Ikbkb)和破坏kappa B 抑制因子激酶(inhibitor of kappa B kinase,IKK)β来抑制核因子-κB(nuclear factor kappa-B,NF-κB)和hedgehog通路,逆转LPS诱导的肺损伤和纤维化的进展[7]。但越来越多的研究者发现单独MSCs移植疗效不稳定,对受损的AEC修复效果尚不足,分化细胞的活力及线粒体功能等不能取代受损组织,而免疫调节作用可能为MSCs治疗ALI的关键作用机制之一。因此临床上需要反复多次输注细胞,这就导致ALI恢复时间延长、临床推广困难等问题,因此探讨提高MSCs移植疗效加强保护功能的新措施逐渐成为近年关注热点之一[8]。
研究证实细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号级联参与了肺损伤的炎症反应。ERK上游激酶MEK1/2的特异性抑制剂——UO126在体内和体外均能抑制ERK的磷酸化。多种动物疾病模型已明确,UO126可以部分通过调节白细胞反应来减少有害的炎症反应[9]。两种肺损伤小鼠模型包括LPS诱导和铜绿假单胞菌感染的细菌性肺炎模型均证实,通过药物抑制 MEK1/2信号途径可以增强体内白细胞介素(interleukin,IL)-4/IL-13应答基因表达,24~72 h后小鼠活力增加,更快恢复体重,肺中性粒细胞减少,巨噬细胞M2极化增强。进一步体外研究发现LPS刺激新鲜分离的人外周血单个核细胞,UO126可剂量依赖性地阻断IL-2和肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)的释放[10]。早期研究发现LPS诱导急性肺损伤小鼠模型中,支气管肺泡灌洗液可见大量的中性粒细胞和促炎细胞因子[11]。如果使用 UO126预处理小鼠可明显减少肺泡中性粒细胞水平,降低支气管肺泡液中TNF-α、趋化性的巨噬细胞炎症蛋白-2和KC水平[12]。UO126还可以降低支气管肺泡灌洗液中的血管渗漏的标志——白蛋白水平[13],减少机体游离脂肪酸诱导的中性粒细胞及其胞外诱捕网产生[3]。 肺组织学检查显示,使用 UO126通过抑制MEK1/2,可有效减弱LPS诱导的肺部炎症反应。这些研究均表明UO126可能成为提高MSCs移植疗效的措施之一。
本研究首先根据前期研究结果及RAHMAN等[4]研究,发现LPS对AEC细胞活力、ATP值、线粒体蛋白水平均有明显影响,而MSCs可明显降低LPS诱导的AEC细胞凋亡指数、caspase-1活性,提高线粒体膜电位、ATP值。随之将UO126加入LPS刺激下的AEC与MSCs共培养板中,发现UO126可进一步降低共培养组AEC 的caspase-1活性及细胞凋亡指数,提高线粒体膜电位、ATP值。因此,UO126可以明显提高MSC对LPS诱导下AEC损伤的保护作用,但其可能的作用途径尚不清楚,需进一步的探索。
近年研究表明,UO126可以影响线粒体生物能学[14-15]。在一项代谢分析测量中发现UO126可以影响还原型辅酶Ⅰ[nicotinamide adenine dinucleotide,NAD(H)]的实时氧化状态、电子传递链的血红素和完整的活细胞内的氧消耗,即使结构不同的MEK1/2抑制剂对线粒体代谢有直接的、剂量依赖的影响[16]。UO126引起NAD(H)还原、血红素氧化和耗氧量降低,具有复合物Ⅰ抑制特性[17-18]。另有研究证实UO126作用是与代谢密切相关,而对代谢的影响是随着线粒体调控而不是MEK1/2的抑制而发生的[19-20]。因此,UO126提高MSCs治疗疗效可能与调控细胞线粒体功能有关,故本研究主要测定了各组细胞培养液中维持线粒体的运动、形态、能量代谢都具有重要意义的MFN1、Miro1、NRF1、PGC-1α、TFAM水平。MFN1线粒体融合必需的分子,介导线粒体外膜融合[21]。Miro1作为线粒体外膜的GTPase家族成员,是线粒体移动相关的重要蛋白,与线粒体的运动功能密切相关[22]。NRF1、TFAM是调控线粒体基因复制、转录表达的因子[23]。PGC-1α作为线粒体生物合成路径中的关键环节,影响能量代谢和线粒体生物发生等诸多方面[24-25]。从实验中可以看出LPS可明显抑制AEC线粒体融合、合成、呼吸、移动等功能,而MSCs可有效减弱这种抑制作用。UO126可能通过抑制MEK1/2活性,干预LPS诱导下共培养中细胞线粒体的Miro1及TFAM水平,尤其对Miro1水平影响更为明显(P<0.05)。由此可见,UO126可能通过提高LPS刺激下细胞线粒体移动功能增强MSCs的修复作用,但对细胞线粒体融合、合成功能作用较弱。
综上所述,UO126可有效增强MSCs保护功能减少LPS诱导下AEC损伤,降低AEC凋亡,提高细胞活力及线粒体合成ATP,此作用可能与调控MSCs与AEC间线粒体功能有关。本研究为临床提高MSCs移植治疗肺损伤疗效,减少氧化损伤,减轻细胞凋亡提供了新策略,且提出调节MSCs线粒体功能尤其是线粒体移动功能可能是治疗ALI的关键,今后本课题组也将对UO126干预MSCs线粒体功能的机制进行深入探索。
