模型认知视角下必修化学微项目教学实践研究*
——以“硫与环境保护复习”为例
2023-11-06史培艳郭红彩
史培艳 郭红彩 刘 翠
(1.睢宁县凌城中学 江苏 徐州 221200;2.睢宁县教师发展中心 江苏 徐州 221200;3.江苏师范大学 化学与材料科学学院 江苏 徐州 221200)
一、研究背景
《普通高中化学课程标准(2017 年版2020 年修订)》(简称“新课标”)提出开展“素养为本”的教学。“模型认知”是化学学科核心素养之一,是可以通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系,建立认知模型,运用模型解释化学现象,揭示现象的本质和规律[1]。杨玉琴教授提出:“模型认知”即运用模型认识研究对象、解释化学现象和规律,并建构模型展示对化学事实的理解[2]。吴星教授提出:“模型认知”是运用模型思想认识事物和解决问题的思维方法[3]。“模型认知”共分为4 个水平,从低到高分别为能识别化学中常见模型并能将化学事实与模型之间进行关联和匹配,能理解、描述、表示常见的认知模型并用模型解释,能评价、改进模型并说明模型使用的条件和适用范围,能对复杂的化学问题情境中的关键要素进行分析以建构相应的模型并选择不同模型综合解释或解决复杂的化学问题[1]。
依据新课标的要求,根据鲁科版微项目特点,对苏教版专题4“硫与环境保护”采用微项目教学,创设真实情境、设计驱动问题、进行合作探究、运用模型思想展示交流成果。
二、内容分析
“硫与环境保护”是苏教版高中化学必修课程的重要专题之一,是高一学生学习的重点内容之一。“硫与环境保护”专题共三单元,分别为含硫化合物的性质、硫及其化合物的相互转化、防治二氧化硫对环境的污染[4]。以硫铁矿烧渣酸浸还原制备硫酸亚铁为主线,串联三个单元的内容进行专题复习。
三、教学与评价目标
1.教学目标
(1)通过以硫铁矿烧渣酸浸还原制备硫酸亚铁为载体,基于元素观、转化观,建构硫铁矿到硫酸亚铁的工艺流程图,发展变化观念、模型认知素养、化学工程思维能力。
(2)通过实验探究酸浸还原过程和实践二氧化硫制备、性质验证的综合实验,深化对浓硫酸、二氧化硫性质的认知,建构物质性质对比、物质性质和化学反应、气体制备及性质验证的综合实验认知模型,发展科学探究、模型认知素养。
(3)通过实验中含硫物质类别、价态及转化关系,建构价类二维认知模型,发展模型认知素养和化学学科思维能力。
2.评价目标
(1)通过建构工艺流程图,初步诊断学生变化观念和化学工程思维能力。
(2)通过实验探究,诊断并发展学生实验设计、操作、观察、分析、建模水平。
(3)通过交流展示,诊断并发展学生对含硫物质之间转化关系的认识水平。
四、教学思路
根据学生对“硫与环境保护”的已有认知、最近发展区、认知发展规律,以硫铁矿(FeS2)烧渣为原料通过酸浸还原法制备硫酸亚铁为载体,从整体观角度引导学生建构认知模型,化学工程思维和化学学科思维。“硫与环境保护”专题微项目复习教学思路如图1。

图1 “硫与环境保护复习”教学思路示意图
五、教学实录
任务1:基于元认知,建构含硫物质之间转化的工艺流程图
学习氯、钠及其化合物、海水资源综合利用之后,学生已经认识并内化工艺流程认知模型,了解前后物质的逻辑关系,能设计简单的物质制备流程图。
【问题】硫酸亚铁是一种重要的化工原料,工业上以硫铁矿(FeS2)烧渣为原料通过酸浸还原法制备硫酸亚铁[4]。如何实现由硫铁矿(FeS2)向FeSO4的转化?
【学生活动并展示成果】回顾旧知,从含硫物质类别、硫元素的化合价、硫酸的工业制备、氧化还原反应角度,结合原料到目标产物的制备过程,外显思维,建构原料到目标产物的工艺流程图,如图2。

图2 硫铁矿到硫酸亚铁的工艺流程图
【学生评价】根据硫酸的工业制备、性质、稀释方法,用稀硫酸酸浸烧渣,选择合适还原剂还原硫酸铁溶液得硫酸亚铁溶液,能合理、高效利用硫铁矿烧渣制备有价值的工业原料硫酸亚铁。该流程将孤立的物质借助内在逻辑关系联系起来,形成完整的工艺流程。
设计意图:创设真实情境,根据原料和产物的类别、硫元素价态,在工业制备硫酸基础上,建构硫铁矿到硫酸亚铁的工艺流程图,发展变化观念、模型认知素养、化学工程思维能力。
任务2:酸浸硫铁矿烧渣,建构物质性质对比思维模型
【问题】为什么不使用浓硫酸酸浸?浓、稀硫酸性质差异的本质原因?
【信息卡】KSCN溶液遇Fe3+变为血红色,该反应可用于Fe3+的检验,KSCN溶液遇Fe2+不变色;KSCN能被浓硫酸氧化。
【学生分组实验活动】对比浓、稀硫酸酸浸氧化铁,观察实验现象。
仪器与药品:井穴板、镊子、胶头滴管、生锈铁丝、浓、稀硫酸、KSCN溶液。
实验操作:用镊子取生锈铁丝分别置于井穴板的2 个井穴中,分别滴加1 滴管浓、稀硫酸,再滴加1 滴KSCN 溶液,观察、记录、分析实验现象,得出实验结论。酸浸及检验过程如图3。

图3 酸浸及检验过程图
实验现象:铁锈在稀硫酸中溶解,在浓硫酸中未溶解;滴加稀硫酸的井穴中滴加1 滴KSCN 溶液后呈血红色,滴加浓硫酸的井穴中滴加1 滴KSCN 溶液无变化。
实验结论:稀硫酸具有酸性,溶解铁锈,以氢离子、硫酸根离子形式存在;浓硫酸具有强氧化性,主要以分子形式存在。
[展示成果]根据实验现象分析反应原理,总结浓、稀硫酸性质差异的原因,建构浓、稀硫酸性质对比模型如图4。

图4 浓、稀硫酸性质对比认知模型
【学生评价】通过实验和性质对比认知模型,直观比较浓、稀硫酸性质及性质差异的本质原因,利于快速掌握浓、稀硫酸的性质及微观构成。
设计意图:通过实验对比分析浓、稀硫酸的性质,培养宏观辨识、微观探析素养;通过建构性质对比认知模型,比较性质差异,思维外显,提升建模能力。
任务3:还原硫酸铁溶液,建构物质性质及化学变化认知模型
【问题】用什么还原剂还原硫酸铁溶液?
【学生分组实验活动】选择还原剂还原硫酸铁溶液。
仪器与药品:井穴板、镊子、铁丝绒、激光笔、二氧化硫、硫酸铁溶液。
实验操作:向血红色溶液中加入一小团铁丝绒(见图5),观察现象;向盛有硫酸铁溶液的注射器中推入二氧化硫气体(见图6),振荡,观察现象;分别写出相关反应的离子方程式。

图5 铁丝绒还原硫酸铁溶液过程

图6 SO2还原硫酸铁溶液过程
实验现象:加入铁丝绒后,溶液由血红色变为浅绿色;推入二氧化硫气体,溶液由黄色迅速变为红褐色。红褐色溶液放置一段时间后溶液颜色变为浅绿色(课前实验,课中对比)。
实验结论:铁、二氧化硫均能还原硫酸铁溶液。
【交流并展示成果】根据实验现象分析反应原理,用离子方程式表征化学反应,建构物质性质及化学变化认知模型如图7。

图7 物质性质及化学变化认知模型
【信息卡】工业上用硫铁矿还原硫酸铁溶液。
【学生评价】通过对比实验,能深入认知SO2的还原性,但疑惑于SO2通入硫酸铁溶液后,溶液瞬间变为红褐色,一段时间后变为浅绿色。
设计意图:通过分组实验,对比铁、SO2还原硫酸铁溶液,深化对SO2还原性的认知,提升符号表征能力。
任务4:制备并验证SO2的性质,建构物质制备及性质验证的实验模型
基于以上建构模型的递进关系,引导学生创新实验,设计实验方案,实施SO2制备及性质验证的综合实验。SO2分别通入氯化铁溶液、硫酸铁溶液,对比观察现象,并检验SO2被三价铁氧化的产物。
【问题】SO2的化学性质有哪些?SO2被氧化成什么?如何检验?多余的SO2如何处理?
【师生共同实验】利用课前搭建好的实验装置进行实验,实验装置如图8。为了排除硫酸根离子的干扰,检验SO2与三价铁离子反应的产物,用氯化铁溶液和硫酸铁溶液做对比实验,取通入SO2后的溶液,先做丁达尔效应实验,再滴加稀盐酸酸化,后滴加氯化钡溶液;观察、记录实验现象如图9,得出实验结论。
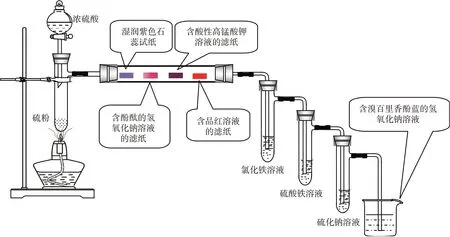
图8 SO2制备、性质验证综合装置

图9 SO2与氯化铁溶液反应过程及产物检验过程
仪器与药品:具支试管、注射器、导管、乳胶管、止水夹、干燥管、烧杯、滤纸条、硫粉、浓硫酸、品红溶液、紫色石蕊试纸、氢氧化钠溶液、酚酞、溴百里香酚蓝、酸性高锰酸钾溶液、硫化钠溶液、稀盐酸、氯化钡溶液。
【信息卡】溴百里香酚蓝指示剂变色范围的pH是6.2~7.6,即黄6.2绿7.6蓝。根据含溴百里香酚蓝的氢氧化钠溶液颜色的变化判断尾气SO2的量。
实验现象:在加热下,硫粉先焙化,后与浓硫酸反应产生无色气体,湿润紫色石蕊试纸变红,含酚酞氢氧化钠溶液的滤纸红色褪去,含酸性高锰酸钾溶液的滤纸紫红色褪去,含品红溶液的滤纸红色褪去,氯化铁溶液和硫酸铁溶液由黄色变为红褐色,硫化钠溶液中产生乳白色沉淀,含溴百里香酚蓝的氢氧化钠溶液依然呈蓝色。
实验结论:浓硫酸具有强氧化性,氧化单质硫,生成SO2气体;SO2是一种酸性氧化物,具有还原性、漂白性、弱氧化性。
实验现象:黄色溶液先变为红褐色,滴加盐酸后呈浅绿色,滴加氯化钡溶液后产生白色沉淀,因原溶液中存在Fe3+或部分Fe2+被氧化为Fe3+使沉淀呈黄色。
【查阅文献】根据氯化铁、硫酸铁溶液中通入SO2后呈红褐色的异常现象,化学兴趣小组查阅文献,收集相关证据。Fe3+在弱酸性下水解生成胶体Fe(OH)3,溶液由黄棕色变为红棕色[5];Fe(OH)3胶粒带正电荷聚沉SO24-能力强于Cl-[6];Fe3+与SO2的反应为配位催化氧化自由基反应,生成亚硫酸铁配合物,该配合物快速发生电子转移,分解为Fe2+、SO24-[7];1 mol/L溶液中通入足量SO2,溶液迅速由黄色变为红褐色,该红褐色物质为不稳定的中间产物Fe(HSO3)2+[8]。
实验结论:氯化铁和硫酸铁溶液中Fe3+会水解,通入SO2后,溶液中溶质含有多种成分,最终Fe3+被还原为Fe2+,SO2被氧化为SO24-,相关离子方程式为2Fe3++SO2+2H2O====2Fe2++SO24-+4H+。
根据SO2是一种酸性氧化物,可用氢氧化钠溶液、氨水、纯碱溶液吸收;根据SO2具有还原性,可用酸性高锰酸钾溶液、硫酸铁溶液吸收;根据SO2具有弱氧化性,可用硫化钠溶液吸收;综合考虑绿色化、经济性、吸收率等,一般选择碱性溶液吸收SO2。
根据实验过程、现象,分析与解释,得出实验结论过程,建构气体制备、性质验证流程认知模型如图10。
设计意图:本实验的目的是加深对SO2性质的认知。在特殊现象基础上培养学生查阅文献查找相关证据的能力,发展学生建构气体制备及性质验证认知模型的能力。
任务5:基于含硫物质之间转化关系,建构价类二维认知模型
【学生活动并展示成果】基于硫铁矿烧渣酸浸还原制备硫酸亚铁和含硫物质之间转化的综合实验,根据含硫物质中硫元素的价态和物质类别,建构常见含硫物质的价类二维认知模型如图11。

图11 含硫物质转化价类二维认知模型
设计意图:建立价类二维认知模型,能从类别角度认识同类物质具有相似的化学性质,从价态角度加深理解氧化还原反应的规律,发展学生化学学科思维能力。
六、教学反思
以真实工业生产硫铁矿烧渣酸浸还原制备硫酸亚铁为主线,借助驱动性问题,对比学习浓、稀硫酸性质、二氧化硫性质。基于实验证据,建构含硫物质之间的转化关系认知模型,培养“模型认知”的化学学科核心素养。在建构认知模型过程中,深度理解物质的性质,学会利用二氧化硫性质进行脱硫,形成性质决定用途的观念,认识环境保护的重要性,养成学习化学正确的价值观,进而发展“社会责任”意识,落实立德树人。

