文字与面孔识别的半球偏侧化互补模式的竞争性发展机制*
2023-11-04蔡厚德齐星亮
高 飞 蔡厚德 齐星亮
文字与面孔识别的半球偏侧化互补模式的竞争性发展机制*
高 飞1蔡厚德2齐星亮3
(1山东师范大学心理学院, 济南 250358) (2南京师范大学心理学院, 南京 210097) (3南京晓庄学院幼儿师范学院, 南京 211171)
成人的大脑左侧VWFA对正字法信息更敏感, 而右侧FFA优先处理面孔信息。然而, 这种偏侧化互补模式的发展机制还亟待阐明。神经元再利用假设认为, 在文字阅读学习过程中, 文字识别会与面孔表征在左侧FG竞争神经加工资源, 导致文字识别出现VWFA的左侧化, 并推动了面孔识别FFA的右侧化。分布式半球组织的观点提出了神经计算加工三原则, 试图系统阐释文字与面孔偏侧化竞争性发展的多层次双向动态加工机制。近期, FG的结构分区与功能特征研究取得了一些新成果, 并据此构建了一个文字与面孔识别的多维度计算加工模型。因此, 有必要基于神经元再利用假设和分布式半球组织的观点, 并结合FG的结构与功能特征和近期研究证据, 以系统探讨文字与面孔识别的半球偏侧化互补模式竞争性发展的认知神经加工机制。未来研究应进一步探究文字与面孔竞争加工的皮层空间位置和功能神经组织学基础、汉字与面孔竞争的加工机制、面孔识别的右侧化发展机制以及数字和音符阅读学习导致大脑可塑性改变的机制。
视觉词形区, 梭状面孔区, 半球偏侧化互补模式, 竞争性发展机制, 多层次双向动态加工
1 引言
人们在识别文字与面孔时都需要利用专家化的视觉加工, 以精细辨别高度相似且差异细微的刺激(Davies-Thompson et al., 2016)。成年人的神经成像研究(Canário et al., 2020; Gerrits et al., 2019)、电生理研究(Inamizu et al., 2020; Sehyr et al., 2020)和神经心理研究(Sabsevitz et al., 2020; Susilo et al., 2015)显示, 文字与面孔识别的关键脑区位于视觉腹侧枕−颞皮层(ventral occipito- temporal cortex, vOTC)中梭状回(fusiform gyrus, FG)的两个相邻亚区, 但呈现出互补的半球偏侧化模式(complementary pattern of hemispheric lateralization) (Behrmann & Plaut, 2020; Canário et al., 2020; Davies-Thompson et al., 2016; Gerlach et al., 2022), 即左半球的视觉词形区(visual word form area, VWFA)对正字法信息更敏感, 而右半球的梭状面孔区(fusiform face area, FFA)优先处理面孔信息(Behrmann & Plaut, 2014; Gerrits et al., 2019; Lochy et al., 2019; Moret-Tatay et al., 2020)。然而, 这种成熟的大脑偏侧化互补模式的发展机制还亟待阐明。
值得关注的是, Dehaene等人(Dehaene, 2005; Dehaene & Cohen, 2007, 2011; Dehaene et al., 2015)提出文字阅读学习的神经元再利用假设(neuronal recycling hypothesis), 试图解释VWFA与FFA的半球互补偏侧化发展机制。这一假设认为, 在文字阅读学习过程中, 文字识别可能在左侧FG竞争原先用于面孔表征的神经加工资源, 导致VWFA出现左侧化, 并推动了面孔识别FFA的右侧化。之后, Behrmann和Plaut (2013, 2015, 2020)采用分布式半球组织的观点(distributed account of hemispheric organization), 系统论述文字与面孔识别的神经计算加工原则, 以阐释VWFA与FFA偏侧化互补模式竞争性发展的神经机制。近期, FG的结构分区与功能特征研究取得了一些有价值的新成果, 为阐明这种竞争性发展机制提供了必要的神经结构与组织学基础。可见, 针对神经元再利用假设关于文字阅读学习与面孔表征竞争加工的解释和分布式半球组织的观点, 并结合FG的结构和功能特征, 进一步探讨文字阅读学习与面孔识别的半球偏侧化互补模式竞争性发展的认知神经机制, 不仅对揭示文字与面孔加工偏侧化发展及其相互关系的大脑可塑性机制具有重要意义, 也对指导文字阅读教学、文字与面孔识别的人工智能模拟和临床治疗实践有一定价值。
为此, 本文首先介绍神经元再利用假设及其相关证据, 说明文字阅读学习与面孔表征在左半球FG的竞争性加工可能导致文字与面孔识别出现互补的偏侧化模式; 然后阐述文字与面孔识别的神经计算加工三原则, 表明文字与面孔的偏侧化竞争是一种发生在vOTC的多层次结构上的双向(自下而上与自上而下)动态加工; 这之后介绍FG的结构分区与功能特征, 并基于由内−外计算轴与后−前计算轴组成的FG的多维度计算加工模型及其相关证据, 初步阐明VWFA和FFA的偏侧化竞争性发展的多层次双向动态加工的认知神经机制。最后对一些未来需要研究的重要问题或方面进行展望。
2 文字阅读学习的神经元再利用假设及其相关证据
文字是人类最重要的文化发明之一。在大约5400年前的巴比伦才出现了文字作品(Dehaene & Cohen, 2007); 直到大约200年前, 文字阅读的掌握和使用还被局限于小范围的群体中(Behrmann & Plaut, 2020)。Dehaene等人(2005, 2007, 2011, 2015)认为, 大脑并无足够的时间进化出专门用于文字阅读的神经系统, 文字阅读需要重新定位或再利用大脑皮层中负责古老功能的部分区域, 且不涉及任何基因重组, 而是利用了大脑的可塑性。这一理论就是著名的文字阅读学习的神经元再利用假设(Dehaene et al., 2015)。vOTC是专门识别面孔、位置、身体和物体等不同领域视觉刺激的混合区(Behrmann & Plaut, 2020)。由于面孔选择区的发展成熟需要更长的时间, 直到成年之前还表现出结构和功能上的变化, 使该区要比其他刺激(如位置)选择区更具可塑性(Gomez et al., 2017)。因此, 文字阅读学习可能与面孔加工在左侧FG争夺神经资源, 最终将之前用于面孔识别的神经元重新用于文字识别, 进而出现了VWFA的左侧化; 而面孔识别也逐渐位移至右侧FG, 导致FFA的右侧化(Dehaene et al., 2015)。
大量证据支持文字阅读学习的神经元再利用假设。第一, 儿童的文字阅读学习会导致在左侧FG出现VWFA, 而FFA则在右侧FG发展。功能磁共振成像(functional magnetic resonance imaging,fMRI)研究表明, 当儿童获得字母知识时左侧FG对字母的反应会不断增强, 但对面孔的反应随之减弱(Cantlon et al., 2011; Centanni et al., 2018),且随着阅读成绩的提高, 右侧FG对面孔的神经活动显著增强(Dehaene-Lambertz et al., 2018; Monzalvo et al., 2012)。行为实验和事件相关电位(event-related potentials, ERPs)的研究还表明, 儿童在阅读学习早期便表现出对文字处理的右视野−左半球优势, 而儿童与少年个体的面孔处理左视野−右半球优势并不明显, 但偏侧化程度却与阅读理解能力呈正相关(Dundas et al., 2013); 7~11岁儿童由单词诱发的左侧N170振幅与面孔在右侧诱发的N170振幅也呈正相关(Dundas et al., 2014)。因此, 文字与面孔识别的半球偏侧化可能是联合发展的。
第二, 成年期的文字阅读学习会引起与儿童期类似的文字与面孔识别的半球偏侧化改变。Dehaene等人(2010)对成人文盲者、前文盲者(早期教育缺失, 到成年时才习得了基本的阅读能力)和阅读熟练者(早期获得阅读能力)的fMRI研究显示, 文盲者的左侧VWFA对字符串无反应, 却对面孔有较强的激活; 伴随从前文盲者到阅读熟练者的读写能力提高, 左侧VWFA对面孔的反应下降, 而右侧FFA对面孔的反应随之增加。Pegado等人(2014)的ERPs研究还显示, 随着从成人文盲者、前文盲者到阅读熟练者的阅读能力提高, 字符串诱发的N170成分的左侧化程度越来越强, 而面孔诱发的N170右侧化程度越来越强。
第三, 左利手者的语言偏侧化会决定面孔的偏侧化发展。Dundas等人(2015)发现, 右利手者的左半球对单词诱发的N170振幅与面孔在右半球诱发的N170振幅呈正相关, 但左利手者却无此表现。左利手者一般为右侧语言优势或左侧语言弱优势(Dundas et al., 2015; Gerrits et al., 2019), 由于文字在左侧视觉皮层未能给予面孔右侧化以足够的压力, 因此左利手者的面孔表征倾向于双侧FFA激活(Frässle et al., 2016)。Gerrits等人(2019)利用fMRI技术进一步将左利手者区分为右侧语言优势和左侧语言优势, 发现两者表现出相反的偏侧化模式, 即前者为文字加工右侧化和面孔加工左侧化, 而后者反之。可见, 当左利手者为右侧语言优势时, 文字与面孔则可能在右侧FG争夺神经加工资源, 提示这种竞争总是发生在语言优势的一侧半球。
第四, 发展性神经障碍或半球损伤会影响文字与面孔的半球竞争加工。对发展性阅读障碍(developmental dyslexia, DD)和先天性面孔失认症(congenital prosopagnosia, CP)的ERPs研究(Collins et al., 2017)发现, DDs的文字和面孔的N170均未表现出偏侧化优势, 而CPs仅表现出文字的N170左侧优势。一种可能解释是, DDs丧失了文字识别能力, 导致随后的面孔表征得不到来自文字在左侧竞争的压力而未出现右侧化, 最终文字与面孔均未出现半球优势; 而CPs的面孔识别缺陷只会妨碍面孔表征的右侧化, 但并不连累文字识别的左侧化发展。对一例右侧vOTC切除患者(U.D.)的3年纵向fMRI跟踪研究(Liu et al., 2018)还发现, 在6岁9个月做切除手术之后的第一次(7岁10个月)扫描时, 左侧vOTC只检测到VWFA; 而第四次(10岁10个月)扫描时, 左侧vOTC均可检测到VWFA和FFA。而且, 与对照组被试相比, U.D.的VWFA位置向外侧明显偏移,而FFA的激活程度和范围随着年龄增加而不断增大, 且位置比正常情况更靠内侧(Liu et al., 2018)。可见, 当面孔需要重新利用左侧FG皮层时, 同样会与文字争夺神经加工资源。
上述证据集中反映了文字阅读学习可能在左侧FG与面孔表征竞争神经加工资源, 引起FG在两半球的结构与功能重构, 最终导致VWFA的左侧化与FFA的右侧化。但是, 这种偏侧化竞争关系的解释仅停留在FG的整体结构与功能上, 基于VWFA与FFA的偏侧化相关性证据对竞争加工机制的阐释也有较大的推测性。因此, 有必要探究这两个脑区偏侧化竞争的详尽加工机制。
3 分布式半球组织的观点
Behrmann和Plaut (2013, 2015, 2020)提出分布式半球组织的观点认为, 文字与面孔识别的半球组织遵循三个关键的神经计算加工原则:(1)表征与知识的多层次分布; (2)表征的竞争与合作共存; (3)脑区空间分布的局域化。首先, 文字与面孔的表征分布在从加工局部视网膜信息的初级视觉皮层(V1区), 到加工更为整体的、基于物体的或意义信息的颞前皮层(Ayzenberg & Behrmann, 2022; Grill-Spector & Malach, 2004)。而且, 两者相关特征的知识表征依赖于不同层次脑区内和脑区间的突触连接强度或模式。学习与经验不仅可以改变突触连接的强度或表征方式, 还可能通过征用额外的神经元和脑区对表征进行精细化和专门化(Behrmann & Plaut, 2020)。其次, 尽管文字与面孔属于不同领域的视觉刺激, 但它们的识别都依赖高视敏度视觉(Gomez et al., 2018; Hasson et al., 2002)和过度学习(Gomez et al., 2019)。一方面, 两者的表征都需要与中央视觉信息表征合作, 导致它们会在与编码视网膜中央凹信息投射皮层的相邻区域竞争神经空间资源(Hasson et al., 2002; Roberts et al., 2013; Woodhead et al., 2011); 另一方面, 由于两者的特征相关知识在不同层次水平上表征的系统性或一致性差异明显, 当一个皮层区表征面孔信息时, 该区域则不适合表征文字信息, 导致面孔与文字的知识最终被不同的皮层区所表征(Behrmann & Plaut, 2020)。再次, 在进化过程中, 脑组织需要有足够的神经元连接用于承载必要的信息加工, 但轴突纤维的总量会受脑颅体积的限制。因此, 通过轴突长度最短化实现的空间分布局域化, 不仅可以减少轴突体量, 还能避免因信号传播距离增加而发生不必要的误差。因此, 在脑区地形图上, 邻近的皮层区之间更可能发展合作表征关系, 而存在竞争表征关系的皮层区之间则保持一定距离。这样一来, 为了使突触连接长度最短化, 表征正字法文字的脑区就可能被限制在邻近表征语言(尤其是语音)相关脑区的一侧半球。由于多数个体的语言表征是左侧化的, 且文字与语言加工网络存在共同偏侧化(colateralization) (Cai et al., 2010; Gerrits et al., 2019), 因此文字表征也倾向偏侧于左半球。最后, 随着文字阅读经验的增加, 左侧vOTC (VWFA)会越来越适合于表征文字信息(Nordt et al., 2019), 这也使文字在此区域与面孔的竞争日益加剧, 导致在学前期儿童的双侧面孔表征会随文字阅读学习而越来越依赖于右侧vOTC (FFA) (Dundas et al., 2014; Lochy et al., 2019)。
从分布式半球组织的观点可以看出, 文字与面孔的偏侧化竞争加工可能是一种发生在半球vOTC的多个层次结构上的双向动态加工过程, 既受到来自V1区的自下而上感觉传入信息的制约, 又受到来自高级皮层(如语言区等)的自上而下信息加工的调制。在较低加工层次上, 文字与面孔识别共享了自下而上的高视敏度视觉信息, 因此会竞争早期知觉的皮层空间资源, 进而开始出现VWFA的左侧化和FFA的右侧化。在较高加工层次上, 文字与面孔的早期竞争会在学习与经验的驱动下接受自上而下信息加工的调制, 导致文字与面孔识别的偏侧化得到发展。值得关注的是, 近期FG的结构分区与功能特征研究取得了一些重要进展, 为阐明这种多层次双向动态加工的认知神经机制提供了可能。以下将对FG的结构与功能区及其与VWFA和FFA偏侧化竞争性发展的关系进行系统探讨。
4 FG的结构与功能区及其与VWFA和FFA偏侧化竞争性发展的关系
4.1 FG的4个结构与功能区
FG是vOTC上连接腹侧枕叶皮层(ventral occipital cortex, VOC)和腹侧颞叶皮层(ventral temporal cortex, VTC)的重要结构, 其外侧以枕颞沟(occipitotemporal sulcus, OTS)为界, 内侧以侧副沟(collateral sulcus, CoS)为界, 后侧以后部横向侧副沟(posterior transverse collateral sulcus, ptCoS)为界, 中部则以中部梭状沟(mid-fusiform sulcus, MFS)的前尖端为界(Grill-Spector & Weiner, 2014; Lorenz et al., 2017; Weiner, Natu, & Grill-Spector, 2018) (图1)。研究发现, MFS可纵向在大范围上将FG分割为内−外侧不同的结构与功能区, 它们与MFS对齐、重叠或嵌套(Grill-Spector & Weiner, 2014) (图1)。其中, 紧邻后部枕叶皮层区(human occipital cortex 4 ventral, hOc4v)的FG1位于内侧且向CoS延伸, FG2位于外侧且向OTS延伸(Caspers et al., 2013) (图1)。在功能上, FG1是早期视觉皮层(V1、V2/V3和V4)与高级视觉皮层(VTC)之间的过渡区(transitional area), FG2则是视觉皮层联合区(associative region) (Caspers et al., 2013; Weiner & Zilles, 2016), 负责对刺激进行初步的知觉整合加工(Caspers et al., 2015)。神经组织学和受体检测还发现, FG的中前部可以由MFS区分出FG3和FG4 (图1)。FG3位于FG1的前部, 其中包含侧副沟地点选择区(Cos-places) (Weiner, Barnett et al., 2018); FG4位于FG2的前部,主要加工物体身份及其意义(Behrmann & Plaut, 2013; Lorenz et al., 2017; Weiner, 2019)。
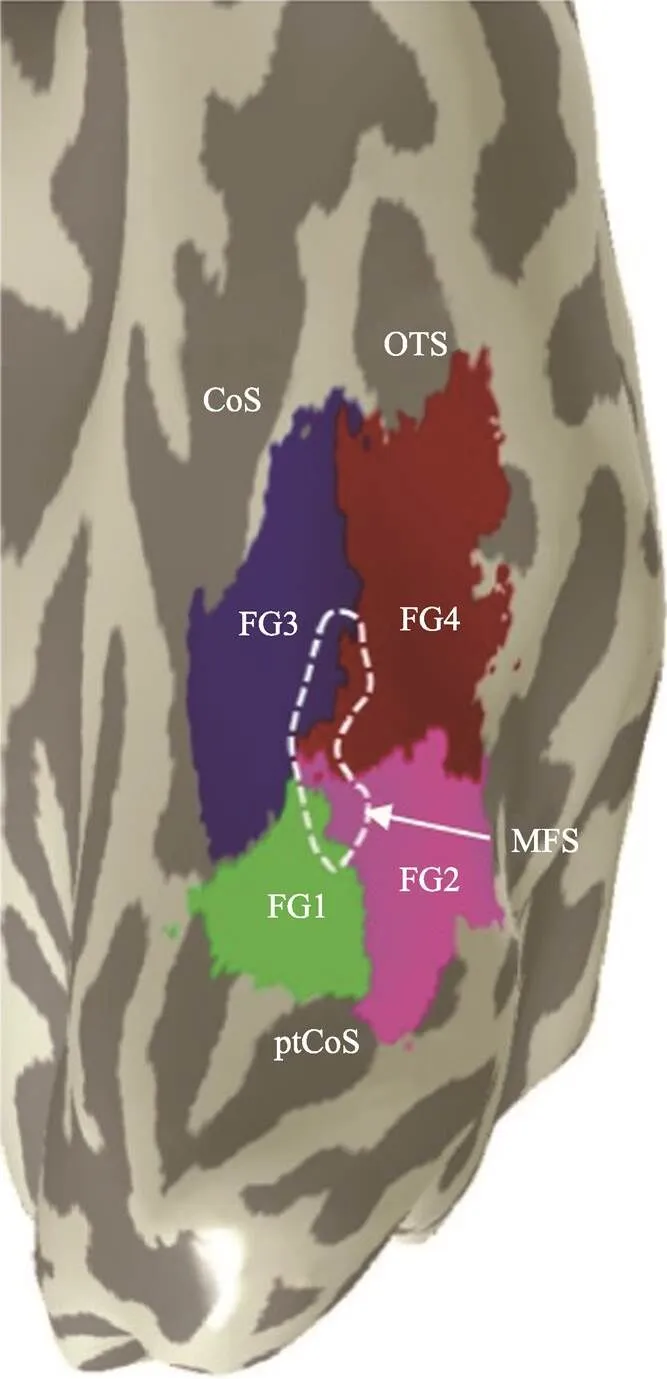
图1 FG的结构边界和4个结构与功能区(资料来源:Lorenz, et al., 2017)
值得重视的是, 基于FG的结构分区与功能特征, Weiner, Barnett等人(2017)构建了一个由内−外轴(medial-lateral axis)和后–前轴(posterior-anterioraxis)组成的多维度计算加工模型(图2)。内−外轴是一个领域特异性计算轴(domain-specific computational axis), 可以将不同领域的加工区域进行物理隔离, 从而有效并行处理各领域的特异性信息; 而后−前轴则是一个领域内加工的层次转换计算轴(computational axis of hierarchical transformation), 通过跨后−前皮层执行一系列分层次的连续计算, 以实现与行为相关的表征(Weiner, Barnett et al., 2017)。在这一模型中, 面孔与文字的识别区分布在FG外侧的FG2和FG4中, 这里偏好处理视网膜中央凹的视觉传入信息, 适合加工高视敏度视觉信息和对刺激进行精细辨别。具体而言, 位于FG2中的FFA-1与VWFA-1呈内−外交叠分布; 位于FG4中的FFA-2与VWFA-2也呈内−外分布, 但中间由梭状躯体区(fusiform body area, FBA)分隔(图2)。基于这一模型, 面孔与文字的视觉信息由早期视觉皮层对感知特征进行初步处理后, 经FG1进入FG2, 随后从FFA-1和VWFA-1分别传递到FFA-2和VWFA-2, 以完成面孔与文字识别的层次性和领域特异性加工(图2)。可见, 文字与面孔识别区是沿FG的内−外轴与后−前轴逐步出现和动态发展的。
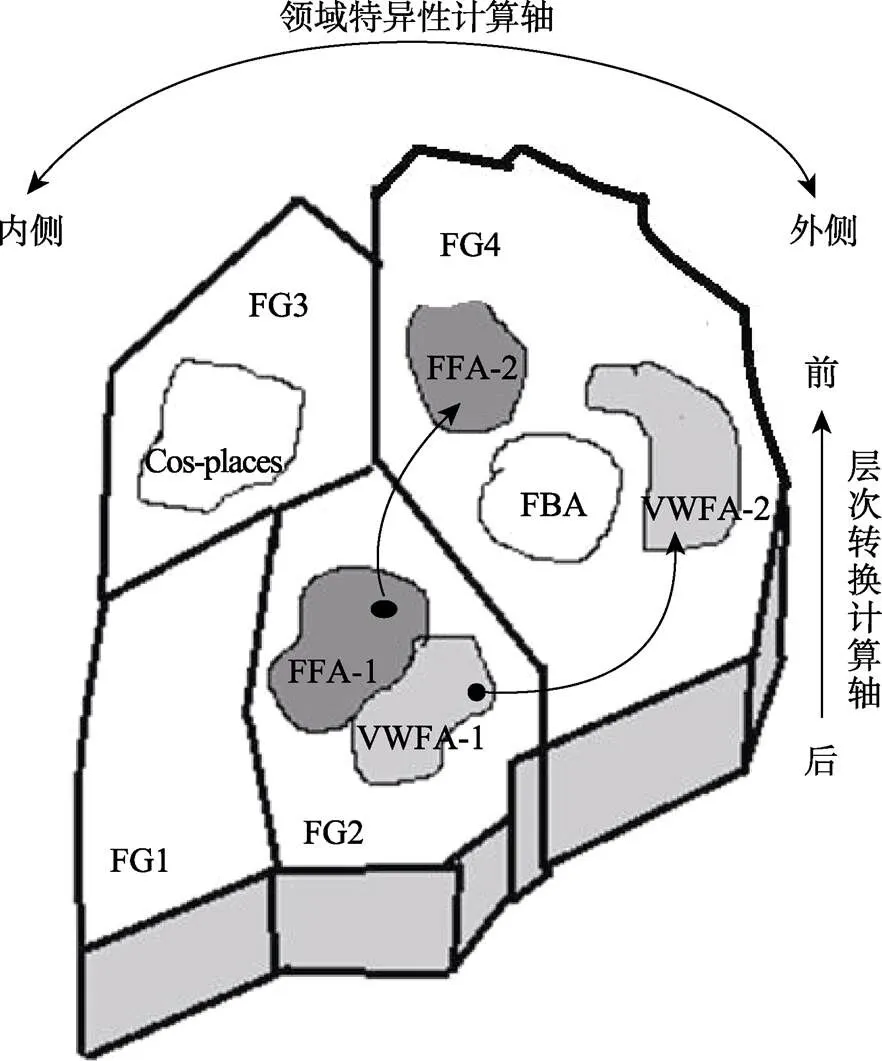
图2 FG的4个结构与功能分区以及它们在多维度计算加工模型(内−外领域特异性计算轴和后−前层次转换计算轴)中的分布(资料来源:Weiner, Barnett, et al., 2017)
需要指出的是, FG的多维度的计算模型并未说明这种动态加工如何受到自下而上与自上而下信息加工的调节, 也未涉及它们与VWFA和FFA的半球竞争性偏侧化发展的关系。从图2显示的分区特点看, 位于FG2中的VWFA-1和FFA-1处在后−前轴的较低层次上, 两者的皮层空间还存在一定交叠(领域特异性低), 提示它们的加工可能主要受自下而上感觉传入的制约, 因此FG2可能是文字与面孔出现早期竞争的皮层位置; 比较而言, 位于FG4中的VWFA-2和FFA-2处在后−前轴的较高层次上, 两者的皮层空间已相互分离(领域特异性高), 提示它们的加工可能发生在知觉的后期, 且主要通过学习与经验接受自上而下信息加工的调制, 所以这两个脑区的半球偏侧化可能会变强。以下将梳理相关证据, 并对这一机制进行阐述。
4.2 VWFA-1与FFA-1在FG2中的早期竞争加工
FG2接受由FG1传入的早期视觉皮层信息, 并基于刺激的整体形状不变性进行知觉表征(Caspers et al., 2015; Dehaene et al., 2015; Op de Beeck et al., 2019)。尽管文字与面孔识别属于不同刺激领域的认知, 但均需依赖高视敏度的中央凹视觉传入信息, 以完成高分辨率的形状不变性知觉(Dehaene, 2005; Dehaene et al., 2015; Op de Beeck et al., 2019)。证据显示, FG2不仅偏好处理中央凹的视觉信息(Grill-Spector & Weiner, 2014), 对文字和面孔也都有反应(Grill-Spector & Weiner, 2014; Weiner et al., 2014), 且两者的激活区交叠分布在视网膜中央凹投射皮层的附近区域(Behrmann & Plaut, 2020; Hasson et al., 2002)。重要的是, FG1与早期视觉皮层的协同激活较强, 且半球间功能更对称(Caspers et al., 2015), 但FG2已开始出现一定程度的文字与面孔的功能非对称性, 即文字引起左侧FG2与阅读相关脑区的协同激活, 面孔则引起右侧FG2与面孔加工相关脑区的协同激活(Grill-Spector & Weiner, 2014; Weiner et al., 2014); VWFA-1定位在左侧FG2, FFA-1则更多出现在右侧FG2 (Caspers et al., 2015)。可见, 文字与面孔识别在FG2共享了来自视网膜中央凹的精细视觉传入信息(Gomez et al., 2018; Roberts et al., 2015), 导致文字阅读学习会与面孔表征竞争早期知觉加工的皮层空间资源(Behrmann & Plaut, 2020; Dai et al., 2022; Dehaene et al., 2015), 这使FG2开始分化出不同的文字与面孔识别的半球偏侧化表征系统(Dehaene et al., 2015)。
4.3 VWFA-2与FFA-2与相关脑网络的偏侧化连通性对早期竞争加工的调制
FG2主要受自下而上视觉传入信息加工的制约, 因此, 由早期竞争导致的VWFA-1的左侧化和FFA-1的右侧化主要与文字与面孔的感知特征加工相关(Op de Beeck et al., 2019)。与之不同, FG4中的VWFA-2和FFA-2不仅接受VWFA-1和FFA-1传来的早期偏侧化信息, 还会在学习与经验的驱动下, 通过与相关脑网络的连通性(connectivity), 接受自上而下信息加工的调制。连通性是指皮层区之间互通信息的程度, 包括结构与功能连通性(Op de Beeck et al., 2019)。在结构上, VWFA-2与FFA-2通过偏侧化的领域特异性连通性(domain- specific connectivity)与非视觉系统脑区连接(Op de Beeck et al., 2019)。一方面, VWFA-2通过左侧弓状束(arcuate fasciculus, AF)与口语产生和语音表征相关的额−颞网络(如布罗卡区和颞平台)建立强势连接(Lerma-Usabiaga et al., 2018; Weiner, Yeatman, & Wandell, 2017; Yeatman & White, 2021); 另一方面, FFA-2通过右侧下纵束(inferior longitudinal fasciculus, ILF)和额−枕下束(inferior fronto-occipital fasciculus, IFOF)与负责面孔记忆、社会认知和情绪加工的面孔扩展网络(右侧颞前皮层、颞上沟、内侧前额皮层和杏仁核等)连接(Gomez et al., 2015; Hadders-Algra, 2022; Pyles et al., 2013)。重要的是, 随着文字阅读经验或能力的提高, VWFA-2不仅与相关脑网络的偏侧化连通性会增强, 对文字的选择性反应也会变强(Li et al., 2021; Op de Beeck et al., 2019)。例如, 文字阅读学习会引起左侧AF后部的各项异性值(fractional anisotropy, FA)明显增大(Thiebaut de Schotten et al., 2014), 这不仅与VWFA-2对字母串反应的激活水平相关, 也与口语词加工中额下皮层和左颞平台通过自上而下的方式调节VWFA-2的激活水平相关(Dehaene et al., 2015), 且只有左侧AF的FA值与阅读能力呈正相关(Yeatman et al., 2012), 提示左侧AF结构的变化可能与文字阅读学习中词素−音素转换通路的发育有关(齐星亮, 蔡厚德, 2019)。再如, 面孔识别能力与连接右侧FFA-2的ILF的FA值呈正相关(Gomez et al., 2015), 而CP患者的右侧ILF和IFOF的完整性受到破坏, 且仅在右半球表现为FA值与面孔识别错误率负相关(Thomas et al., 2009), 提示右侧ILF和IFOF可能是面孔整体结构信息与情绪、记忆表征信息整合的两条关键通路(Grossi et al., 2014)。值得关注的是, 在大脑中这些偏侧化连接是预置的(pre-existing), 文字或面孔的学习经验通过改变相关脑网络的连通性可以塑造文字或面孔选择区, 因此能够预测它们在儿童或成人个体脑中出现的皮层位置(Powell et al., 2018; Saygin et al., 2016)。总之, 文字阅读的学习经验可以增强VWFA-2与左侧化语言网络的连通性, 进而强化文字与面孔在左侧的早期竞争, 导致文字识别左侧化的加快建立, 并推动右侧FFA-2的发展。同时, 面孔经验的积累也会增加FFA-2与右侧化面孔扩展网络的联通性, 导致面孔识别右侧化的逐步建立。这种受学习与经验驱动的加工主要发生在文字或面孔知觉的后期, 并以自上而下的方式影响文字与面孔的竞争性半球偏侧化发展。
5 总结与展望
近10~20年来, 文字与面孔识别的半球偏侧化互补模式及其发展机制的研究, 引起了人们的极大关注。尽管大量证据支持神经元再利用假设, 即人脑在文字阅读学习时会与面孔表征竞争左侧FG的神经空间资源, 进而出现了左侧化的VWFA, 并导致FFA的右侧化, 但这种偏侧化的皮层竞争加工机制, 到近期才逐渐明晰。一方面, 文字识别与面孔表征的偏侧化竞争是一种发生在vOTC的多层次结构上的双向动态加工; 另一方面, 基于MFS区分出的4个FG结构与功能区, 以及据此构建的多维度计算加工模型, 为阐明VWFA与FFA的互补偏侧化发展的双向竞争加工机制提供了可能。综合已有的理论模型和研究证据, 本文描绘了一张文字与面孔识别的半球偏侧化竞争性发展的多层次双向动态加工机制图(图3)。在FG后−前轴上, 位于FG后部外侧的FG2主要接受来自早期视觉皮层的自下而上的传入信息。由于文字与面孔的精细识别都依赖来自中央凹的高视敏度视觉信息, 所以会共享早期知觉的加工资源, 并在FG2竞争皮层空间, 导致在左半球开始出现VWFA-1 (内−外轴的外侧), 而右半球出现FFA-1 (内−外轴的内侧)。随着文字阅读学习和面孔识别经验的积累, 文字或面孔信息的加工从FG2中的VWFA-1和FFA-1分别向位于FG中部外侧的FG4中的VWFA-2 (内−外轴的外侧)和FFA-2 (内−外轴的内侧)转换。由于文字阅读学习会强化VWFA-2与左半球语言网络的连通性, 这种自上而下的偏侧化调制会强化文字与面孔的竞争加工, 进而导致VWFA-2出现更强的左侧化, 并加快FFA-2的右侧化; 同时, 面孔的学习经验使FFA-2与相关脑网络的右侧化连通性也得到加强, 这种自上而下的调制会导致FFA-2出现更强的右侧化。可见, 文字与面孔识别的半球偏侧化互补模式的竞争性发展是在FG的多个维度上发生的一种双向动态加工过程。
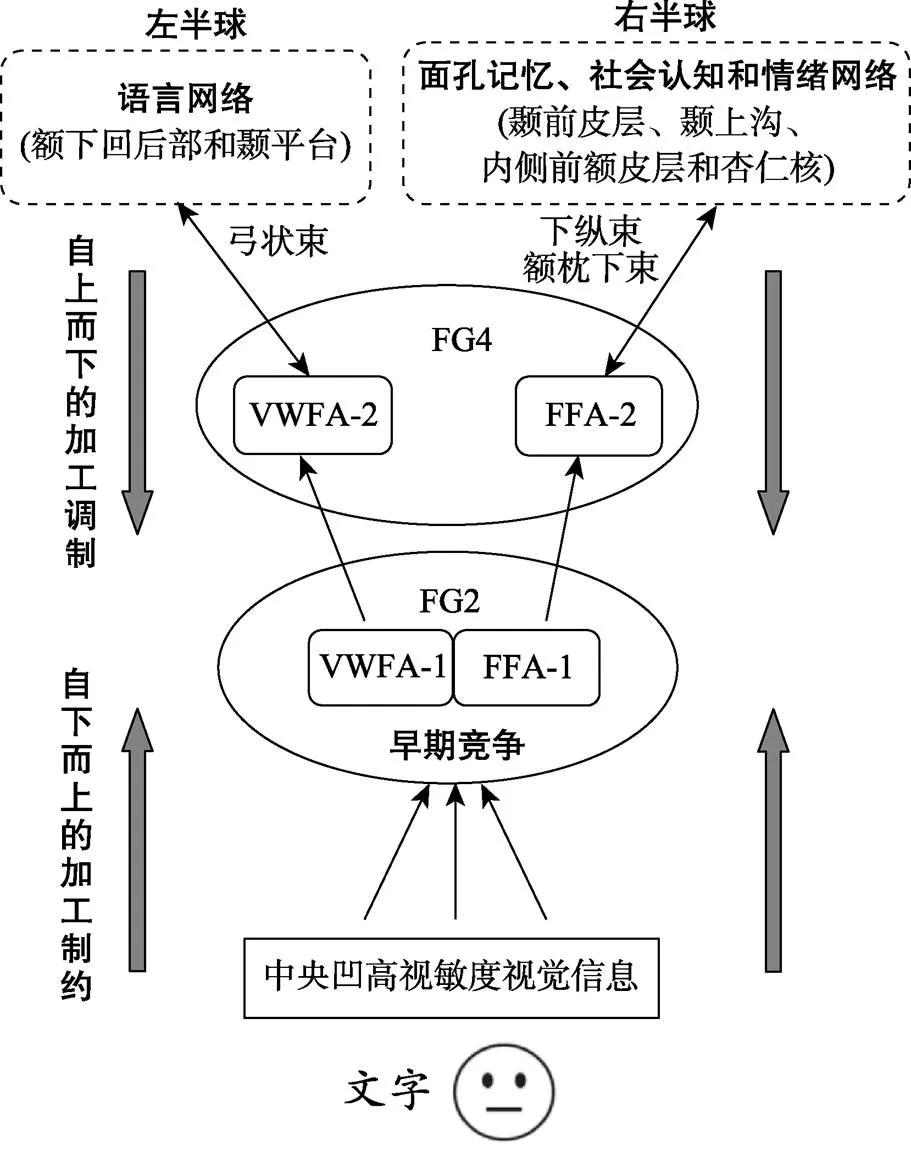
图3 文字与面孔识别的半球偏侧化竞争性发展的多层次双向动态加工机制图
尽管文字与面孔识别的半球偏侧化互补模式的竞争性发展机制得到初步阐明, 但一些关键问题或方向还需深入研究。
第一, 文字与面孔竞争皮层空间的加工机制。大量支持神经元再利用假设的证据都是基于不同年龄段和不同文字阅读水平被试的组间比较得到的, 其结果可能不够精确。因为对组内被试数据的平均或平滑处理可能导致对不同范畴刺激的皮层反应区出现交叠, 而实际上在不同个体中这些脑区可能占据着界限分明的区域(Dehaene- Lambertz et al., 2018)。因此, 有必要提供处于不同年龄段的同一组儿童在文字阅读学习中不同皮层选择区激活水平发生变化的纵向研究证据。Dehaene- Lambertz等人(2018)对从入学前到入学后第一年的10名儿童进行了共6~7次(间隔约2个月) fMRI扫描, 结果并未发现左半球内VWFA与FFA的激活存在负相关, 但发现右侧FFA的激活水平随阅读成绩的增加而提高。重要的是, 这一过程中VWFA侵占了位于面孔表征区附近的对工具有弱反应的特异性不稳定的神经元斑块(neuronal patches) (Dehaene-Lambertz et al., 2018)。据此, Dehaene- Lambertz等人(2018)提出了一个修订的神经元再利用假设, 认为伴随儿童文字阅读的学习, 左侧FG对文字反应神经元斑块的数量会不断增加, 这会阻挡物体或面孔反应斑块在这里的扩展, 使面孔识别逐渐转由右侧FG所替代。为了进一步考察脑发育成熟和文字阅读水平对这一效应的影响, Feng等人(2022)还分别对未学习阅读的6岁儿童、开始学习阅读的6岁儿童和熟练阅读的9岁儿童进行fMRI扫描, 结果支持这种阻挡模型(blocking model), 即文字阅读学习并不与面孔直接竞争, 而是通过间接方式阻挡面孔在左侧的缓慢发展, 进而增强了面孔的右侧化。这些结果可以更好解释Dehaene等人(2010)发现的边缘竞争效应, 即尽管FFA激活峰值并不受文字阅读能力的影响, 但在距FFA峰值12或16 mm的体素中却能观察到竞争效应, 即随着文字阅读分数的提高, 左侧FFA激活会降低。今后的研究可以采用高分辨率(< 1 mm)的fMRI技术(Dehaene-Lambertz et al., 2018; Feng et al., 2022), 在以FFA峰值为中心的圆环中以1 mm的体素往边缘变化, 以确定竞争发生的精确皮层空间位置, 进而考察文字究竟是直接与面孔竞争, 还是阻挡了面孔的左侧化发展。
第二, 文字与面孔偏侧化竞争加工的功能神经组织学基础。尽管证据显示FG2和FG4都与文字与面孔识别有关, 但这两个区域如何参与竞争加工的功能神经组织学, 还需深入研究。首先, FG2包含的高密度大型锥体细胞可能与高视敏度的中央凹计算有关(Weiner et al., 2014), 这也许就是制约高视敏度加工的神经资源(Dehaene et al., 2015)。近期研究(Gomez et al., 2018)发现, 与儿童相比, 成人的VWFA-1与FFA-1的群感受野(population receptive fields, pRFs)分别覆盖了左、右半球更大范围的中央凹视野区。而且, FG2的NMDA受体(N-methyl-D-aspartic acid receptor)密度高于FG1 (Caspers et al., 2015)。该受体与学习、记忆和神经元可塑性有关(Collingridge et al., 2013), 可能更适合文字阅读学习对FG2面孔皮层可塑性的要求。其次, 尽管FG4也偏好编码中央凹视野的刺激(Weiner, Barnett et al., 2017), 但VWFA-2与FFA-2的偏侧化竞争似乎更多受到与相关脑网络偏侧化连通性的影响。FG2和FG4的IIIc层中包含的中、大型锥体细胞显示出强烈的皮层−皮层连接特征, 这可能提供“自下而上”与“自上而下”加工接口的结构基础(Lorenz et al., 2017)。重要的是, FG4的V层可细分为Va和Vb两个亚层, 其功能意义尚不清楚。但是, V层中M2毒蕈碱受体(muscarinic M2 receptors)密度最高(Caspers et al., 2015)。毒蕈碱受体能抑制IV层的微弱感觉输入, 并增强II、III和V层的输入, 从而提高皮层对感觉信息的整合加工水平(Eggermann & Feldmeyer, 2009), 这或许能解释为何FG4与其他脑区有更强的连通性。未来需进一步探明FG2和FG4在细胞类型、分层、密度、突触连接、髓鞘化和受体等方面的特点, 为阐明文字与面孔偏侧化竞争加工机制提供更为坚实的功能神经组织学基础。
第三, 汉字与面孔的偏侧化竞争加工机制。与字母文字与面孔在左侧FG争夺神经加工资源不同, 汉字识别的神经发展与面孔表征的竞争出现了一种不同的表现。对学前期开始学习汉字的儿童(5~6岁)所进行的ERPs和脑电图(electroencephalography, EEG)γ波的研究(Li et al., 2013; 张文芳, 2020)发现, 汉字诱发的左侧化N170振幅与面孔诱发的右侧化N170振幅负相关, 表明儿童的早期阅读经验不仅会导致汉字识别出现左侧优势, 还在右侧与面孔竞争加工资源。研究者推测, 在个体发展的早期文字和面孔存在竞争关系, 而在学龄儿童中则是促进关系(Li et al., 2013; 张文芳, 2020)。然而, 对学前期开始学习字母文字的儿童(4~6岁)所进行的fMRI研究却发现, 当儿童获得字母知识时左侧FG对面孔的反应随之减弱(Cantlon et al.,2011; Centanni et al., 2018), 且随着阅读成绩的提高,右侧FG对面孔的神经活动显著增强(Dehaene- Lambertz et al., 2018; Monzalvo et al., 2012)。可见, 学前与学龄儿童学习字母文字所引起的表现是一致的, 即文字与面孔会在左侧竞争, 导致VWFA的左侧化, 并推动了FFA的右侧化。在本质上, “竞争关系”反映的是一种内在加工机制, 表现为文字可能占用面孔的皮层空间资源, 进而干扰或削弱其加工效率, 导致面孔偏侧化在一侧半球的减弱; “促进关系”则强调文字在左侧与面孔竞争所导致的VWFA左侧化会推动FFA的右侧化。在学前儿童中汉字阅读学习所引起的文字与面孔在右侧的竞争可能与汉字具有与字母文字相比更复杂的视觉构型特征有关, 这需要擅长视空间辨别能力的右半球的更多参与(Li et al., 2013; 张文芳, 2020)。值得关注的是, Zhao等人(2015)对学前儿童(4~6岁)的ERPs研究发现, 汉字视觉辨认学习训练会引起汉字在右侧诱发更大的N170振幅, 面孔在左侧诱发的N170振幅却变小。这提示在处理早期汉字视觉经验中右半球起了重要作用, 但汉字还可能在左半球与面孔竞争资源。可以推测, 学前儿童的汉字阅读学习既要依赖右半球辨别字形, 又要利用左半球通达正字法和字音、字义信息, 所以他们的早期阅读经验可能会在右半球和左半球与面孔竞争加工资源。到了学龄期, 随着儿童阅读熟练水平的提高, 汉字在左半球与面孔的竞争会愈加激烈, 这会加快文字的左侧化, 并推动面孔的右侧化。今后的研究有必要采用学前和学龄儿童的跨期研究设计, 利用具有高时间分辨率的ERPs技术和高空间分辨率的fMRI技术, 系统探查儿童早期阅读经验影响汉字与面孔偏侧化竞争加工的独特机制。
第四, 面孔识别右侧化的发展机制。尽管儿童和成人的研究证据倾向于支持文字阅读学习可能推动了面孔识别的FFA右侧化发展, 但不识字的成年文盲者也有一定程度的右侧优势(Dehaene et al., 2010), 这提示文字阅读学习只是影响面孔识别右侧化发展的因素之一(Dehaene et al., 2015)。文字与面孔识别的偏侧化发展都会受学习与经验的驱动, 但与文字阅读学习主要依赖外显的强化教学不同, 个体在生命早期就会自动暴露给面孔(Op de Beeck et al., 2019)。在个体发展中, 面孔识别的右侧化呈现出非线性的发展过程(Behrmann & Avidan, 2022; Lochy et al., 2019)。早在婴儿期面孔识别就出现了右侧优势(de Heering & Rossion, 2015; Leleu et al., 2020; Rekow et al., 2021; Rekow et al., 2020), 这可能与婴儿的面孔识别主要依赖低空间频率的视觉信息有关(Johnson, 2005; Johnson et al., 2015)。随着胼胝体(corpus callosum)的发育成熟(3个月到2岁) (Grand et al., 2003; Yakovlev & Lecours, 1967), 尤其是后部的髓鞘化促进了半球间的视觉信息传递(Adibpour et al., 2018), 使得面孔识别逐步依赖两半球的加工。到了学前儿童(5~6岁) (Lochy et al., 2019; Lochy et al., 2020), 面孔识别的右侧优势便逐步消失了。不过, 从文字阅读学习开始, 面孔识别的右侧优势又逐渐再现, 且在成年时稳定下来(Behrmann & Plaut, 2020)。可见, 面孔识别的右侧化发展会经历一个较长的时间延迟, 这不仅受脑发育和文字阅读学习的影响, 也与面孔经验的缓慢积累过程有关。研究发现, 伴随儿童和青少年获得较为熟练的阅读技能, 面孔识别能力和FFA右侧化还需发展相当长一段时间才能达到成人水平(Feng et al., 2022; O'Hearn et al., 2010; Vuontela et al., 2013)。例如, 儿童右侧FFA对面孔选择性激活的体积约是成人的三分之一(Golarai et al., 2007), 且FFA-1在儿童期和青春期的扩展幅度最大(Nordt et al., 2021)。而且, 儿童(7~11岁)和青少年(12~14岁)右侧FFA体积的大小与面孔识别记忆能力呈显著正相关, 而成人却无这种关系(Golarai et al., 2007)。因此, FFA右侧化的发展可能反映了个体对面孔识别和感知经验的变化。近期研究(Nordt et al., 2021)发现, 随着儿童的成长发育, FFA-1的选择性提高与枕颞沟肢体区(occipitotemporal sulcus limbs)的选择性降低直接相关, 提示面孔识别可能重新利用了右侧FG中肢体区的皮层空间。而且, 与文字相似, 面孔感知经验可能进一步调整右侧vOTC沿后−前计算轴不同区域的功能。例如, 成人FFA的激活峰值位于前部区域, 而儿童(5~8岁)FFA的选择性激活的峰值位于后部区域, 并随儿童面孔经验的积累, 激活峰值也由FFA后部转移到前部(Gathers et al., 2004)。另外, 右侧FFA-2也更易受面孔感知经验的调节(Golarai et al., 2017), 并与个体面孔识别的目的或需要密切相关(Kim et al., 2019)。因此, 今后研究不仅要关注文字阅读学习如何在左侧FG与面孔表征竞争加工资源, 还需探究面孔感知经验如何影响FFA的右侧化发展及其与其他皮层竞争空间资源的加工机制。
总之, 在文字与面孔识别的半球偏侧化互补模式的发展中, 尽管文字在左侧FG与面孔的竞争加工起了关键作用(见图3), 但这一机制通常发生在学龄期儿童开始学习文字时, 而面孔识别的偏侧化则经历了从婴儿、学前儿童、学龄儿童到成年人的变化过程。图4呈现了个体发展中文字与面孔识别半球偏侧化动态改变的时间进程。在婴儿期, 面孔识别表现为右半球优势; 在学前期, 面孔识别出现了两侧均势; 在学龄期, 文字阅读学习导致在左侧FG发展出VWFA; 左侧FFA由于受到VWFA的阻挡, 其发展逐步转移到右侧FG; 在成年期, 面孔识别的右侧优势出现成熟与稳定的状态。
第五, 数字和音符阅读学习的大脑可塑性机制。数字和音符也属于人类发明的文化产品, 它们的阅读学习会引起与文字阅读学习类似的大脑可塑性变化吗?证据表明, 优先编码阿拉伯数字的视觉数形区(visual number form area, VNFA)位于FBA的外侧, 但比VWFA位置更偏外(Hannagan et al., 2015); 音符视觉选择区(area of visual selectivity for musical notation)位于VWFA的后部外侧(Mongelli et al., 2017; Wong & Gauthier, 2010)。这表明数字与音符的识别占用了FG外侧区中紧邻VWFA的区域, 提示它们的阅读学习也依赖对中央凹高视敏度视觉信号的加工和形状不变性知觉(Hannagan et al., 2015; Mongelli et al., 2017; Wong & Gauthier, 2010)。但是, 数字阅读学习需将数字映射到数量表征上, 这导致 VNFA不仅要与躯体识别区争夺资源, 还要利用动作和空间表征的右侧顶内沟(intraparietal sulcus, IPS)以及额顶数字区(frontoparietal number regions), 以解析数字的抽象信息(Abboud et al., 2015; Hernandez et al., 2019; Klein et al., 2016)。因此, VNFA与右半球的额顶数字处理网络(Abboud et al., 2015; Kanjlia et al., 2016; Yeo et al., 2017)有较强的偏侧化连通性, 这导致VNFA会出现在VWFA更外侧(Hannagan et al., 2015), 且表现出右侧优势(Abboud et al., 2015; Shum et al., 2013)。相对而言, 音符的阅读学习需要更多利用FG到运动执行网络的神经连接, 以完成视觉−运动的编码转换(Stewart et al., 2003; van Vugt et al., 2021; Wong & Gauthier, 2010)。而且, 音符识别区与左侧颞叶后部外侧有更强的连通性, 这导致音符识别区会出现在VWFA的后部外侧, 但表现出左侧优势(Bouhali et al., 2020)。可见, 数字、音符和文字的阅读学习共享了基本相似的大脑可塑性机制, 即它们需要利用FG中原先可用于表征其它领域客体(如物体、面孔或躯体等)的皮层区域, 并通过与相关脑网络的偏侧化连通性, 以形成各自独特的皮层定位区和发展不同的半球偏侧化效应。
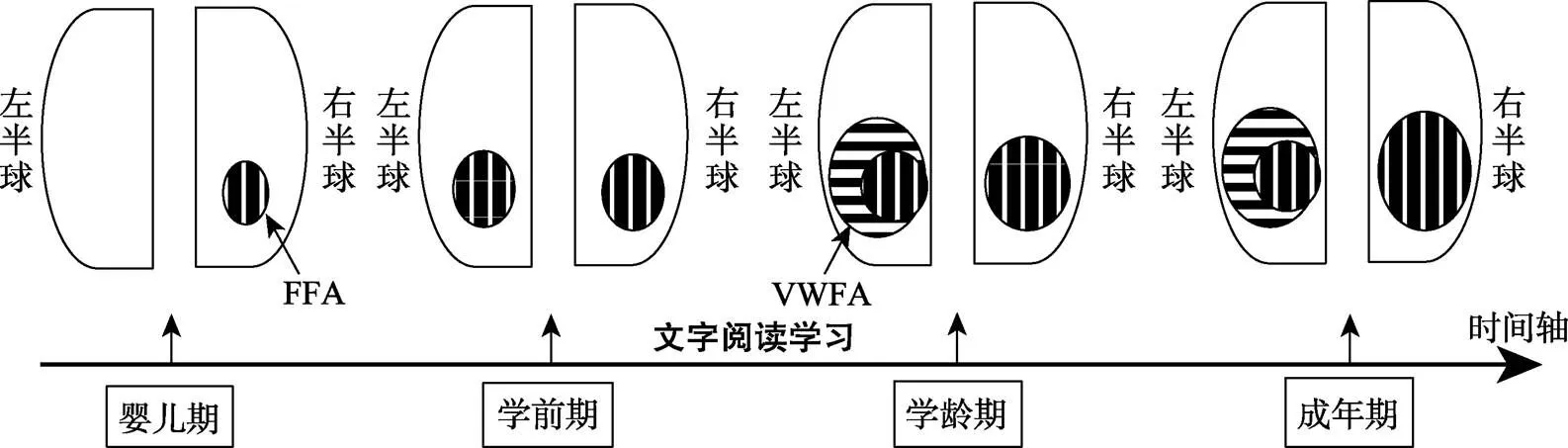
图4 个体发展中文字和面孔偏侧化动态改变的时间进程
未来的研究有必要探究数字、音符与文字阅读学习的大脑可塑性改变之间的相互关系。例如, 尽管右侧VNFA在数字识别中激活程度更强, 但割裂脑和纯失读症患者的左右半球都能识别阿拉伯数字, 表明VNFA可能是双侧化的(Hannagan et al., 2015)。而且, 左侧VNFA不仅对字母表现出较强激活, 还与VWFA高度重叠(Grotheer et al., 2016)。因此, 左侧VNFA与VWFA究竟是合并出现的, 还是两个截然不同的区域, 还亟待确认(Grotheer et al., 2016; Hannagan et al., 2015)。再如, 数字阅读学习不仅需要激活右侧VNFA, 以及右侧IPS和额顶数字区, 还需左侧化数词语音加工脑区的参与。因此, 熟练的数字加工技能需要表征数字形状、数量和数词脑网络之间的灵活转换。这也被称为数字认知的三重编码模型(Triple Code Model, TCM) (Skagenholt et al., 2018)。今后的研究需要基于这一模型, 探究儿童数字阅读学习中这三个网络之间连通性的可塑性改变及其对数字运算或思维能力发展的影响(Skagenholt et al., 2021, 2022)。还如, 音符阅读学习不仅强化了左侧音符识别区与外侧裂周边语音网络的结构与功能连通性, 还导致音符识别区的扩大, 而VWFA则向内侧前部偏移(Bouhali et al., 2020; Mongelli et al., 2017)。因此, 音符与文字阅读学习的大脑可塑性机制不仅在左半球共享了同一个结构与功能连通性的目标网络, 还可能由于这两个领域之间的皮层空间竞争加工, 导致VWFA出现位置变动(Bouhali et al., 2020; Dehaene et al., 2010; Mongelli et al., 2017)。然而, 目前的证据来自成年音乐家与非音乐家被试的比较。未来的研究需要采用纵向的研究设计, 比较不同文字与音符阅读水平的儿童, 以探查早期的文字与音符阅读学习经验对VWFA与音符识别区之间竞争皮层空间的影响, 以及这两个脑区的定位与偏侧化如何受到来自外侧裂周边语音网络的自上而下的调制。总之, 文字、数字和音符阅读学习的脑结构与功能网络既相互分离, 又相互重叠; 既相互竞争, 又相互协调。重要的是, 儿童阅读这三种视觉符号的学习在时间上可能是同步或异步发生的。因此, 探明儿童文字、数字和音符阅读学习相互作用的时间动力学及其脑机制, 不仅对加深文化学习(cultural learning)大脑可塑性的认识有理论意义, 也对指导语言、数学和音乐的早期教学有实践意义。
齐星亮, 蔡厚德. (2019). 文字阅读学习的大脑可塑性机制.(5), 1127–1133.
张文芳. (2020).(博士论文). 中国科学院大学, 北京.
Abboud, S., Maidenbaum, S., Dehaene, S., & Amedi, A. (2015).A number-form area in the blind.(1), Article 6026. https://doi.org/10.1038/ncomms7026
Adibpour, P., Dubois, J., & Dehaene-Lambertz, G. (2018). Right but not left hemispheric discrimination of faces in infancy.(1), 67–79.
Ayzenberg, V., & Behrmann, M. (2022). Does the brain's ventral visual pathway compute object shape?(12), 1119–1132.
Behrmann, M., & Avidan, G. (2022). Face perception: Computational insights from phylogeny.(4), 350–363.
Behrmann, M., & Plaut, D. C. (2013). Distributed circuits, not circumscribed centers, mediate visual recognition.(5), 210–219.
Behrmann, M., & Plaut, D. C. (2014). Bilateral hemispheric processing of words and faces: Evidence from word impairments in prosopagnosia and face impairments in pure alexia.(4), 1102–1118.
Behrmann, M., & Plaut, D. C. (2015). A vision of graded hemispheric specialization., 30–46.
Behrmann, M., & Plaut, D. C. (2020). Hemispheric organization for visual object recognition: A theoretical account and empirical evidence.(4), 373–404.
Bouhali, F., Mongelli, V., de Schotten, M. T., & Cohen, L. (2020).Reading music and words: The anatomical connectivity of musicians' visual cortex., Article 116666. https://doi.org/10.1016/j.neuroimage.2020.116666
Cai, Q., Paulignan, Y., Brysbaert, M., Ibarrola, D., & Nazir, T. A. (2010). The left ventral occipito-temporal response to words depends on language lateralization but not on visual familiarity.(5), 1153–1163.
Canário, N., Jorge, L., & Castelo-Branco, M. (2020). Distinct mechanisms drive hemispheric lateralization of object recognition in the visual word form and fusiform face areas., Article 104860. https://doi.org/ 10.1016/j.bandl.2020.104860
Cantlon, J. F., Pinel, P., Dehaene, S., & Pelphrey, K. A. (2011). Cortical representations of symbols, objects, and faces are pruned back during early childhood.(1), 191–199.
Caspers, J., Palomero-Gallagher, N., Caspers, S., Schleicher, A., Amunts, K., & Zilles, K. (2015). Receptor architecture of visual areas in the face and word-form recognition region of the posterior fusiform gyrus.(1), 205–219.
Caspers, J., Zilles, K., Eickhoff, S. B., Schleicher, A., Mohlberg, H., & Amunts, K. (2013). Cytoarchitectonical analysis and probabilistic mapping of two extrastriate areas of the human posterior fusiform gyrus.(2), 511–526.
Centanni, T. M., Norton, E. S., Park, A., Beach, S. D., Halverson, K., Ozernov-Palchik, O., ... Gabrieli, J. (2018). Early development of letter specialization in left fusiform is associated with better word reading and smaller fusiform face area.(5), Article e12658. https://doi.org/10.1111/desc.12658
Collingridge, G. L., Volianskis, A., Bannister, N., France, G., Hanna, L., Mercier, M., ... Jane, D. E. (2013). The NMDAreceptor as a target for cognitive enhancement., 13–26.
Collins, E., Dundas, E., Gabay, Y., Plaut, D. C., & Behrmann, M. (2017). Hemispheric organization in disorders of development.(4-6), 416–429.
Dai, R., Huang, Z., Weng, X., & He, S. (2022). Early visual exposure primes future cross-modal specialization of the fusiform face area in tactile face processing in the blind., Article 119062. https://doi.org/10.1016/ j.neuroimage.2022.119062
Davies-Thompson, J., Johnston, S., Tashakkor, Y., Pancaroglu, R., & Barton, J. J. (2016). The relationship between visual word and face processing lateralization in the fusiform gyri: A cross-sectional study., 88–97.
de Heering, A., & Rossion, B. (2015). Rapid categorization of natural face images in the infant right hemisphere., Article e06564. https://doi.org/10.7554/eLife.06564.001
Dehaene, S. (2005). Evolution of human cortical circuits for reading and arithmetic: The ‘‘neuronal recycling’’ hypothesis. In S. Dehaene, J. R. Duhamel, M. Hauser, & G. Rizzolatti (Eds.),(pp. 133–157). Cambridge, MA: MIT Press.
Dehaene, S., & Cohen, L. (2007). Cultural recycling of cortical maps.(2), 384–398.
Dehaene, S., & Cohen, L. (2011). The unique role of the visual word form area in reading.(6), 254–262.
Dehaene, S., Cohen, L., Morais, J., & Kolinsky, R. (2015). Illiterate to literate: Behavioural and cerebral changes induced by reading acquisition.(4), 234–244.
Dehaene, S., Pegado, F., Braga, L. W., Ventura, P., Nunes Filho, G., Jobert, A., ... Cohen, L. (2010). How learning to read changes the cortical networks for vision and language.(6009), 1359–1364.
Dehaene-Lambertz, G., Monzalvo, K., & Dehaene, S. (2018). The emergence of the visual word form: Longitudinal evolution of category-specific ventral visual areas during reading acquisition.(3), Article e2004103. https://doi.org/10.1371/journal.pbio.2004103
Dundas, E. M., Plaut, D. C., & Behrmann, M. (2013). The joint development of hemispheric lateralization for words and faces.(2), 348–358.
Dundas, E. M., Plaut, D. C., & Behrmann, M. (2014). An ERP investigation of the co-development of hemispheric lateralization of face and word recognition., 315–323.
Dundas, E. M., Plaut, D. C., & Behrmann, M. (2015). Variable left-hemisphere language and orthographic lateralizationreduces right-hemisphere face lateralization.(5), 913–925.
Eggermann, E., & Feldmeyer, D. (2009). Cholinergic filtering in the recurrent excitatory microcircuit of cortical layer 4.(28), 11753–11758.
Feng, X., Monzalvo, K., Dehaene, S., & Dehaene-Lambertz, G. (2022). Evolution of reading and face circuits during the first three years of reading acquisition., Article 119394. https://doi.org/10.1016/j.neuroimage. 2022.119394
Frässle, S., Krach, S., Paulus, F. M., & Jansen, A. (2016). Handedness is related to neural mechanisms underlying hemispheric lateralization of face processing., Article 27153. https://doi.org/10.1038/srep27153
Gathers, A. D., Bhatt, R., Corbly, C. R., Farley, A. B., & Joseph, J. E. (2004). Developmental shifts in cortical loci for face and object recognition.(10), 1549–1553.
Gerlach, C., Kuhn, C. D., Poulsen, M., Andersen, K. B., Lissau, C. H., & Starrfelt, R. (2022). Lateralization of word and face processing in developmental dyslexia and developmental prosopagnosia., https://doi.org/10.1016/j.neuropsychologia. 2022.108208
Gerrits, R., Van der Haegen, L., Brysbaert, M., & Vingerhoets, G. (2019). Laterality for recognizing written words and faces in the fusiform gyrus covaries with language dominance., 196–204.
Golarai, G., Ghahremani, D. G., Whitfield-Gabrieli, S., Reiss, A., Eberhardt, J. L., Gabrieli, J. D., & Grill-Spector, K. (2007). Differential development of high-level visual cortex correlates with category-specific recognition memory.(4), 512–522.
Golarai, G., Liberman, A., & Grill-Spector, K. (2017). Experience shapes the development of neural substrates of face processing in human ventral temporal cortex.(2), 1229–1244.
Gomez, J., Barnett, M., & Grill-Spector, K. (2019). Extensive childhood experience with Pokemon suggests eccentricity drives organization of visual cortex.(6), 611–624.
Gomez, J., Barnett, M. A., Natu, V., Mezer, A., Palomero- Gallagher, N., Weiner, K. S., ... Grill-Spector, K. (2017). Microstructural proliferation in human cortex is coupled with the development of face processing.(6320), 68–71.
Gomez, J., Natu, V., Jeska, B., Barnett, M., & Grill-Spector, K. (2018). Development differentially sculpts receptive fields across early and high-level human visual cortex.(1), Article 788. https://doi.org/ 10.1038/s41467-018-03166-3
Gomez, J., Pestilli, F., Witthoft, N., Golarai, G., Liberman, A., Poltoratski, S., ... Grill-Spector, K. (2015). Functionally defined white matter reveals segregated pathways in human ventral temporal cortex associated with category-specific processing.(1), 216–227.
Grand, R. L., Mondloch, C. J., Maurer, D., & Brent, H. P. (2003). Expert face processing requires visual input to the right hemisphere during infancy.(10), 1108–1112.
Grill-Spector, K., & Malach, R. (2004). The human visual cortex., 649–677.
Grill-Spector, K., & Weiner, K. S. (2014). The functional architecture of the ventral temporal cortex and its role in categorization.(8), 536–548.
Grossi, D., Soricelli, A., Ponari, M., Salvatore, E., Quarantelli, M., Prinster, A., & Trojano, L. (2014). Structural connectivity in a single case of progressive prosopagnosia: The role of the right inferior longitudinal fasciculus., 111–120.
Grotheer, M., Herrmann, K.-H., & Kovács, G. (2016). Neuroimaging evidence of a bilateral representation for visually presented numbers.(1), 88–97.
Hadders-Algra, M. (2022). Human face and gaze perception is highly context specific and involves bottom-up and top-down neural processing., 304–323.
Hannagan, T., Amedi, A., Cohen, L., Dehaene-Lambertz, G., & Dehaene, S. (2015). Origins of the specialization for letters and numbers in ventral occipitotemporal cortex.(7), 374–382.
Hasson, U., Levy, I., Behrmann, M., Hendler, T., & Malach, R. (2002). Eccentricity bias as an organizing principle for human high-order object areas.(3), 479–490.
Hernandez, A. E., Claussenius-Kalman, H. L., Ronderos, J., Castilla-Earls, A. P., Sun, L., Weiss, S. D., & Young, D. R. (2019). Neuroemergentism: A framework for studying cognition and the brain., 49, 214–223.
Inamizu, S., Yamada, E., Ogata, K., Uehara, T., Kira, J.-I., & Tobimatsu, S. (2020). Neuromagnetic correlates of hemispheric specialization for face and word recognition., 108–116.
Johnson, M. H. (2005). Subcortical face processing.(10), 766–774.
Johnson, M. H., Senju, A., & Tomalski, P. (2015). The two-process theory of face processing: Modifications based on two decades of data from infants and adults., 169–179.
Kanjlia, S., Lane, C., Feigenson, L., & Bedny, M. (2016). Absence of visual experience modifies the neural basis of numerical thinking.(40), 11172–11177.
Kim, H., Kim, G., & Lee, S.-H. (2019). Effects of individuation and categorization on face representations in the visual cortex., Article 134344. https://doi.org/10.1016/j.neulet.2019.134344
Klein, E., Suchan, J., Moeller, K., Karnath, H.-O., Knops, A., Wood, G., ... Willmes, K. (2016). Considering structural connectivity in the triple code model of numerical cognition: Differential connectivity for magnitude processing and arithmetic facts.(2), 979–995.
Leleu, A., Rekow, D., Poncet, F., Schaal, B., Durand, K., Rossion, B., & Baudouin, J.-Y. (2020). Maternal odor shapes rapid face categorization in the infant brain.(2), Article e12877. https://doi. org/10.1111/desc.12877
Lerma-Usabiaga, G., Carreiras, M., & Paz-Alonso, P. M. (2018). Converging evidence for functional and structural segregation within the left ventral occipitotemporal cortex in reading.(42), E9981–E9990.
Li, H., Liang, Y., Yue, Q., Zhang, L., Ying, K., & Mei, L. (2021). The contributions of the left fusiform subregions to successful encoding of novel words., Article 105690. https://doi.org/10.1016/j. bandc.2021.105690
Li, S., Lee, K., Zhao, J., Yang, Z., He, S., & Weng, X. (2013). Neural competition as a developmental process: Early hemispheric specialization for word processing delays specialization for face processing.(5), 950–959.
Liu, T. T., Nestor, A., Vida, M. D., Pyles, J. A., Patterson, C., Yang, Y., ... Behrmann, M. (2018). Successful reorganization of category-selective visual cortex following occipito- temporal lobectomy in childhood.(5), 1113–1122.
Lochy, A., de Heering, A., & Rossion, B. (2019). The non- linear development of the right hemispheric specialization for human face perception., 10–19.
Lochy, A., Schiltz, C., & Rossion, B. (2020). The right hemispheric dominance for face perception in preschool children depends on the visual discrimination level.(3), Article e12914. https://doi. org/10.1111/desc.12914
Lorenz, S., Weiner, K. S., Caspers, J., Mohlberg, H., Schleicher, A., Bludau, S., ... Amunts, K. (2017). Two new cytoarchitectonic areas on the human mid-fusiform gyrus.(1), 373–385.
Mongelli, V., Dehaene, S., Vinckier, F., Peretz, I., Bartolomeo, P., & Cohen, L. (2017). Music and words in the visual cortex: The impact of musical expertise., 260–274.
Monzalvo, K., Fluss, J., Billard, C., Dehaene, S., & Dehaene-Lambertz, G. (2012). Cortical networks for vision and language in dyslexic and normal children of variable socio-economic status.(1), 258–274.
Moret-Tatay, C., Baixauli Fortea, I., & Grau Sevilla, M. D. (2020). Challenges and insights for the visual system: Are face and word recognition two sides of the same coin?, Article 100941. https://doi. org/10.1016/j.jneuroling.2020.100941
Nordt, M., Gomez, J., Natu, V., Jeska, B., Barnett, M., & Grill-Spector, K. (2019). Learning to read increases the informativeness of distributed ventral temporal responses.(7), 3124–3139.
Nordt, M., Gomez, J., Natu, V. S., Rezai, A. A., Finzi, D., Kular, H., & Grill-Spector, K. (2021). Cortical recycling in high-level visual cortex during childhood development.(12), 1686–1697.
O'Hearn, K., Schroer, E., Minshew, N., & Luna, B. (2010). Lack of developmental improvement on a face memory task during adolescence in autism.(13), 3955–3960.
Op de Beeck, H. P., Pillet, I., & Ritchie, J. B. (2019). Factors determining where category-selective areas emerge in visual cortex.(9), 784–797.
Pegado, F., Comerlato, E., Ventura, F., Jobert, A., Nakamura, K., Buiatti, M., ... Dehaene, S. (2014). Timing the impact of literacy on visual processing.(49), E5233–E5242.
Powell, L. J., Kosakowski, H. L., & Saxe, R. (2018). Social origins of cortical face areas.(9), 752–763.
Pyles, J. A., Verstynen, T. D., Schneider, W., & Tarr, M. J. (2013). Explicating the face perception network with white matter connectivity.(4), Article e61611. https://doi.org/10.1371/journal.pone.0061611
Rekow, D., Baudouin, J.-Y., Poncet, F., Damon, F., Durand, K., Schaal, B., ... Leleu, A. (2021). Odor-driven face-like categorization in the human infant brain.(21), Article e2014979118. https://doi.org/10.1073/pnas.2014979118
Rekow, D., Leleu, A., Poncet, F., Damon, F., Rossion, B., Durand, K., ... Baudouin, J.-Y. (2020). Categorization of objects and faces in the infant brain and its sensitivity to maternal odor: Further evidence for the role of intersensory congruency in perceptual development., Article 100930. https://doi.org/10.1016/j.cogdev.2020. 100930
Roberts, D. J., Ralph, M. A. L., Kim, E., Tainturier, M.-J., Beeson, P. M., Rapcsak, S. Z., & Woollams, A. M. (2015). Processing deficits for familiar and novel faces in patients with left posterior fusiform lesions., 79–96.
Roberts, D. J., Woollams, A. M., Kim, E., Beeson, P. M., Rapcsak, S. Z., & Ralph, M. A. L. (2013). Efficient visual object and word recognition relies on high spatial frequency coding in the left posterior fusiform gyrus: Evidence from a case-series of patients with ventral occipito-temporal cortex damage.(11), 2568–2580.
Sabsevitz, D. S., Middlebrooks, E. H., Tatum, W., Grewal, S. S., Wharen, R., & Ritaccio, A. L. (2020). Examining the function of the visual word form area with stereo EEG electrical stimulation: A case report of pure alexia., 112–118.
Saygin, Z. M., Osher, D. E., Norton, E. S., Youssoufian, D. A., Beach, S. D., Feather, J., ... Kanwisher, N. (2016). Connectivity precedes function in the development of the visual word form area.(9), 1250– 1255.
Sehyr, Z. S., Midgley, K. J., Holcomb, P. J., Emmorey, K., Plaut, D. C., & Behrmann, M. (2020). Unique N170 signatures to words and faces in deaf ASL signers reflect experience-specific adaptations during early visual processing., Article 107414. https://doi.org/10. 1016/j.neuropsychologia.2020.107414
Shum, J., Hermes, D., Foster, B. L., Dastjerdi, M., Rangarajan, V., Winawer, J., ... Parvizi, J. (2013). A brain area for visual numerals.(16), 6709–6715.
Skagenholt, M., Skagerlund, K., & Traff, U. (2021). Neurodevelopmental differences in child and adult number processing: An fMRI-based validation of the triple code model., Article 100933. https://doi.org/10.1016/j.dcn.2021.100933
Skagenholt, M., Skagerlund, K., & Träff, U. (2022). Neurodevelopmental differences in task-evoked number network connectivity: Comparing symbolic and nonsymbolicnumber discrimination in children and adults., Article 101159. https://doi. org/10.1016/j.dcn.2022.101159
Skagenholt, M., Träff, U., Västfjäll, D., & Skagerlund, K. (2018). Examining the triple code model in numerical cognition: An fMRI study.(6), Article e0199247. https://doi.org/10.1371/journal.pone.0199247
Stewart, L., Henson, R., Kampe, K., Walsh, V., Turner, R., & Frith, U. (2003). Brain changes after learning to read and play music.(1), 71–83.
Susilo, T., Wright, V., Tree, J. J., & Duchaine, B. (2015). Acquired prosopagnosia without word recognition deficits.(6), 321–339.
Thiebaut de Schotten, M., Cohen, L., Amemiya, E., Braga, L. W., & Dehaene, S. (2014). Learning to read improves the structure of the arcuate fasciculus.(4), 989–995.
Thomas, C., Avidan, G., Humphreys, K., Jung, K.-J., Gao, F., & Behrmann, M. (2009). Reduced structural connectivity in ventral visual cortex in congenital prosopagnosia.(1), 29–31.
van Vugt, F. T., Hartmann, K., Altenmüller, E., Mohammadi, B., & Margulies, D. S. (2021). The impact of early musical training on striatal functional connectivity., Article 118251. https://doi.org/10.1016/j.neuroimage.2021. 118251
Vuontela, V., Jiang, P., Tokariev, M., Savolainen, P., Ma, Y., Aronen, E. T., ... Carlson, S. (2013). Regulation of brain activity in the fusiform face and parahippocampal place areas in 7-11-year-old children.(2), 203–214.
Weiner, K. S. (2019). The mid-fusiform sulcus (sulcus sagittalis gyri fusiformis).(9), 1491–1503.
Weiner, K. S., Barnett, M. A., Lorenz, S., Caspers, J., Stigliani, A., Amunts, K., ... Grill-Spector, K. (2017). The cytoarchitecture of domain-specific regions in human high-level visual cortex.(1), 146–161.
Weiner, K. S., Barnett, M. A., Witthoft, N., Golarai, G., Stigliani, A., Kay, K. N., ... Grill-Spector, K. (2018). Defining the most probable location of the parahippocampal place area using cortex-based alignment and cross-validation., 373–384.
Weiner, K. S., Golarai, G., Caspers, J., Chuapoco, M. R., Mohlberg, H., Zilles, K., ... Grill-Spector, K. (2014). The mid-fusiform sulcus: A landmark identifying both cytoarchitectonic and functional divisions of human ventral temporal cortex., 453–465.
Weiner, K. S., Natu, V. S., & Grill-Spector, K. (2018). On object selectivity and the anatomy of the human fusiform gyrus., 604–609.
Weiner, K. S., Yeatman, J. D., & Wandell, B. A. (2017). The posterior arcuate fasciculus and the vertical occipital fasciculus., 274–276.
Weiner, K. S., & Zilles, K. (2016). The anatomical and functional specialization of the fusiform gyrus., 48–62.
Wong, Y. K., & Gauthier, I. (2010). A multimodal neural network recruited by expertise with musical notation.(4), 695–713.
Woodhead, Z. V., Wise, R. J., Sereno, M., & Leech, R. (2011). Dissociation of sensitivity to spatial frequency in word and face preferential areas of the fusiform gyrus.(10), 2307–2312.
Yakovlev, P. I., & Lecours, A. R. (1967). The myelogenetic cycles of regional maturation of the brain. In A. Minkowski (Eds.),(pp. 3–70). Oxford: Blackwell Science.
Yeatman, J. D., Dougherty, R. F., Ben-Shachar, M., & Wandell, B. A. (2012). Development of white matter and reading skills.(44), E3045–E3053.
Yeatman, J. D., & White, A. L. (2021). Reading: The confluence of vision and language., 487–517.
Yeo, D. J., Wilkey, E. D., & Price, G. R. (2017). The search for the number form area: A functional neuroimaging meta-analysis., 145–160.
Zhao, P., Li, S., Zhao, J., Gaspar, C. M., & Weng, X. (2015). Training by visual identification and writing leads to different visual word expertise N170 effects in preliterate Chinese children., 106–116.
Mechanism of competitive development of hemispheric lateralization complementary pattern for word and face recognition
GAO Fei1, CAI Houde2, QI Xingliang3
(1School of Psychology, Shandong Normal University, Jinan 250358, China) (2School of Psychology, Nanjing Normal University, Nanjing 210097, China) (3School of Early-Childhood Education, Nanjing Xiaozhuang University, Nanjing 211171, China)
The left visual word form area (VWFA) of the brain in adults is more sensitive to orthographic information, whereas the right fusiform face area (FFA) is preferentially involved in the processing of facial information. However, the developmental mechanism of the complementary pattern of hemispheric lateralization still needs to be clarified. The neuronal recycling hypothesis postulates that learning to read words and face representation compete for neural processing resources in the left fusiform gyrus (FG), which leads to left hemispheric lateralization of the VWFA in word recognition, and drives the right hemispheric lateralization of FFA in face recognition. The distributed account of hemispheric organization of word and face recognition proposes three key neural computational principles to systematically elucidate a multilevel and bidirectional dynamic processing mechanism of the competitive development of word and face lateralization. Based on recent discoveries of cytoarchitectonic areas and functional organizational features of the FG, a multidimensional computational model of word and face recognition is constructed. Therefore, the cognitive neural processing mechanism of the competitive development of the complementary pattern of hemispheric lateralization in word and face recognition is systematically examined using the neuronal recycling hypothesis and distributed account of the hemispheric organization, combined with the structural and functional characteristics of FG and recent evidence. Further studies should explore the cortical spatial sites and the functional neurohistological basis of competitive processing between words and faces, the processing mechanism of competition between Chinese characters and faces, the developmental mechanism of the right hemispheric specialization for face recognition, and the mechanisms of brain plasticity changed by learning to read numbers and musical notations.
visual word form area, fusiform face area, complementary pattern of hemispheric lateralization, mechanism of competitive development, multilevel and bidirectional dynamic processing
2022-09-21
* 山东省社会科学普及应用研究项目(2020-SKZZ-01)、山东省社会科学规划研究项目(19CSZJ35)资助。
蔡厚德, E-mail: caihoude@163.com
B845
