汉黄芩素调节SIRT1/Nrf2信号通路对子宫内膜异位症大鼠铁死亡的影响
2023-11-03胡晓英吴建发姜伶俐
胡晓英,吴建发,王 鹰,姜伶俐,柳 洲
(上海健康医学院附属周浦医院 妇产科,上海 201318)
子宫内膜异位症(endometriosis, EM)是一种慢性炎症性疾病,定义为子宫内膜组织存在于子宫外,导致盆腔疼痛和不孕,已被视为一个公共卫生问题,严重影响女性的生活质量,并造成沉重的经济负担[1]。铁是细胞生存的必需元素,缺铁是许多生殖疾病的已知危险因素。铁死亡是EM的特征之一,细胞通过逆行月经扩散以存活、植入和建立EM病变,导致铁稳态失调,造成局部铁超负荷、炎症反应等病理生理学变化[2]。温经汤是一种传统中药,已被证明对EM有治疗作用,网络药理学分析结果指出,汉黄芩是温经汤的活性成分之一,可能通过调节炎症、内分泌治疗EM,且Wog本身得抗炎、抗病毒感染活性极强,对大多数炎症类疾病都有效果[3]。沉默调节蛋白1(silent information regulator 1, SIRT1)是一种应激反应蛋白,在不同的细胞和生理功能中发挥着关键作用,如线粒体生物发生、细胞损伤和细胞死亡(包括铁死亡)等,SIRT1脱乙酰化激活核因子E2相关因子2(nuclear factor erythroid2-related factor 2, Nrf2)能够抑制铁死亡进程[4]。Wog能否通过调节SIRT1/Nrf2信号通路抑制EM铁死亡暂不清楚,本研究旨在借助EM动物模型探究Wog对EM的影响和SIRT1/Nrf2轴的调控作用,尝试为开发EM的治疗药物提供一定理论基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 8周龄健康未孕SD雌性大鼠,体重206~235 g,购自北京维通利华实验动物技术有限公司上海分公司,生产许可证号:SCXK(沪)2022-0007。动物实验环境为SPF级动物房,12 h/12 h光暗循环,温度(24±1)℃,湿度(50±10)%。
1.1.2 药物、主要试剂 Wog(纯度≥98%,632-85-9),购自上海吉至生化科技有限公司;SIRT1抑制剂(EX527,HY-15452),购自美国MCE公司;白介素-1β(interleukin-1β, IL-1β,CB10205-Ra)、IL-6(CB10218-Ra)ELISA试剂盒,购自上海科艾博生物技术有限公司;雌二醇(estradiol, E2,J22765)、孕激素(progestin, P,J22752)ELISA试剂盒,购自吉利德生物;一抗SIRT1(ab110304)、谷胱甘肽过氧化物酶4(Glutathione peroxidase 4, GPX4,ab125066)、溶质载体家族7成员11(recombinant solute carrier family 7, SLC7A11,ab307601)和铁蛋白轻链(ferritin light chain, FTL,ab75973),购自美国Abcam公司;一抗Nrf2(80593-1-RR),购自武汉三鹰。
1.2 方法
1.2.1 动物造模及给药 大鼠适应性喂养1周,连续3 d灌胃戊酸雌二醇0.1 mg/(kg·d)使大鼠处于同一动情周期,采用自体子宫移植法构建EM大鼠模型。大鼠禁食24 h,麻醉,开腹,结扎左侧子宫并切除子宫角,纵向切开子宫组织,剪为5 mm×5 mm的组织块,迅速将组织块固定至右侧腹壁血管丰富部位,缝合切口;术后3 d每只腹腔注射庆大霉素(0.4×104U/d)预防感染,自术后第2 天开始灌胃戊酸雌二醇(0.1 mg/kg,2次/周)促进子宫内膜移植;4周后再次开腹,移植物体积增大且形成含淡黄色透明液体的囊状结构,异位病灶充血,新生血管丰富,表示造模成功[5]。
将所有大鼠随机分为5组:空白组(CT组)、EM模型组(EM组)、Wog低剂量组(Wog L组)、Wog高剂量组(Wog H组)、Wog+EX527组,每组12只。CT组以外所有大鼠建立EM模型,CT组大鼠仅行单侧子宫切除,不做异位移植。造模成功后第2天做给药处理,Wog根据参考文献[6-7]并做适量调整,Wog L组、Wog H组大鼠灌胃给药7、14 mg/(kg.d)Wog+腹腔注射2 mL/kg/d 0.9%氯化钠溶液;将EX527(10 mg/kg)溶解于1%二甲亚砜、30%聚乙二醇和0.9%氯化钠溶液中,Wog+EX527组大鼠灌胃给药14 mg/(kg.d) Wog+腹腔注射2 mL/(kg.d) EX527溶液;CT组和EM组大鼠灌胃+腹腔注射等量0.9%氯化钠溶液。给药持续4周,给药过程中损失大鼠及时补充。
1.2.2 异位病灶体积测定 给药结束后,所有大鼠腹腔注射1.5%戊巴比妥钠完全麻醉,打开腹腔,腹主动脉取血5 mL静置30 min,离心后取上层血清,分装储存;随后收集完整的异位内膜组织,使用游标卡尺迅速测量其长、宽、高,样品分为2份,分别保存在4%多聚甲醛溶液中和-80℃冰箱中。异位病灶体积(mm3)=0.52×长×宽×高。
1.2.3 血清性激素和促炎细胞因子含量测定 取1.2.2中血清样本,依照ELISA检测试剂盒说明书测定检测E2、P、IL-1β、IL-6的含量。
1.2.4 异位内膜组织病理学观察 将1.2.2保存在多聚甲醛中的异位内膜组织进行乙醇脱水、包埋和切片处理,切片去石蜡、干燥,按照试剂盒说明书进行HE染色,光学显微镜下拍照并分析异位内膜组织病理学变化。
1.2.5 异位内膜组织铁离子聚集情况检测 将1.2.4中石蜡切片脱蜡,亚铁青化钾溶液和盐酸溶液等比例混合成普鲁士蓝染液染色切片1 h,核固红染液染色5 min,切片依次放入无水乙醇Ⅰ5 min-无水乙醇Ⅱ5 min-无水乙醇Ⅲ5 min-二甲苯Ⅰ5 min-二甲苯Ⅱ5 min透明,中性树胶封片,显微镜拍照,铁呈蓝色,细胞核呈红色。
1.2.6 异位内膜组织Fe2+浓度检测 取1.2.2中冷藏的异位内膜组织,匀浆,样本分为2份,其中1份按照铁离子比色法检测试剂盒说明书检测Fe2+的浓度,另1份储存于-80 ℃冰箱待测。
1.2.7 异位内膜组织SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达检测 定量1.2.6中匀浆样品总蛋白浓度,采用Western blot法检测蛋白的表达。配制SDS-PAGE凝胶,样品上样10 μg,电泳设置为80 V通电30 min后转为120 V通电1 h,转膜仪设置为200 V,随后封闭PVDF膜,目的条带置于抗体稀释液中过夜,再经过二抗稀释液和ECL化学发光液孵育,拍照并分析蛋白表达水平。

2 结果
2.1 各组大鼠异位病灶体积比较 与CT组比较,EM组大鼠异位病灶体积增大(P<0.05);与EM组比较,Wog L、Wog H组大鼠异位病灶体积呈剂量依赖性减小(P<0.05);与Wog H组比较,Wog+EX527组大鼠异位病灶体积增大(P<0.05,图1A)。

A:各组大鼠异位病灶体积比较;B:各组大鼠血清性激素和促炎细胞因子含量比较;*:与CT组比较,P<0.05;#:与EM组比较,P<0.05;&:与Wog L组比较,P<0.05;@:与Wog H组比较,P<0.05。图1 异位病灶体积、血清性激素和促炎细胞因子含量比较
2.2 各组大鼠血清性激素和促炎细胞因子含量比较 与CT组比较,EM组E2、P、IL-1β、IL-6含量升高(P<0.05);与EM组比较,Wog L、Wog H组E2、P、IL-1β、IL-6含量呈剂量依赖性降低(P<0.05);与Wog H组比较,Wog+EX527组E2、P、IL-1β、IL-6含量升高(P<0.05,图1B)。
2.3 各组大鼠异位内膜组织病理学变化 HE染色结果显示,CT组子宫内膜组织结构完整,腺体排列整齐;EM组腺体较少,可见大量炎性细胞浸润;与EM组比较,Wog L、Wog H组腺体增多,炎性细胞浸润减少,病理损伤减轻;与Wog H组比较,Wog+EX527组组织损伤严重,炎性细胞浸润增加(图2)。
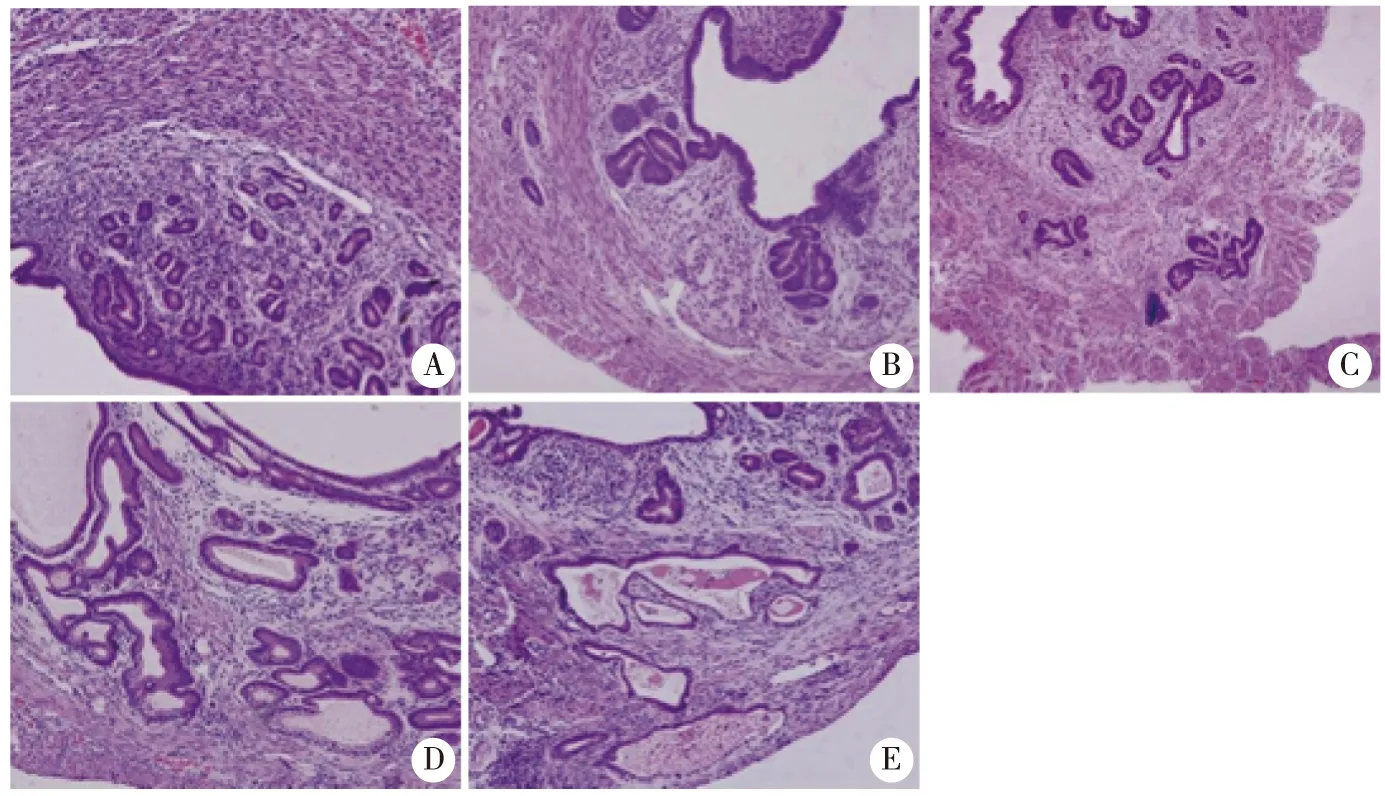
A:CT组;B:EM组;C:Wog L组;D:Wog H组;E:Wog+EX527组;×200。图2 各组大鼠异位内膜组织HE染色结果
2.4 各组大鼠异位内膜组织铁离子聚集情况 CT组子宫内膜组织未见明显蓝色染色颗粒;EM组可见大量明显蓝色染色颗粒,铁沉积量高;与EM组比较,Wog L、Wog H组蓝色染色颗粒明显减少,铁沉积量显著降低;与Wog H组比较,Wog+EX527组蓝色染色颗粒增多(图3)。
2.5 各组大鼠异位内膜组织Fe2+浓度比较 与CT组比较,EM组Fe2+浓度显著升高(P<0.05);与EM组比较,Wog L、Wog H组Fe2+浓度呈剂量依赖性降低(P<0.05);与Wog H组比较,Wog+EX527组Fe2+浓度显著升高(P<0.05,图4A)。
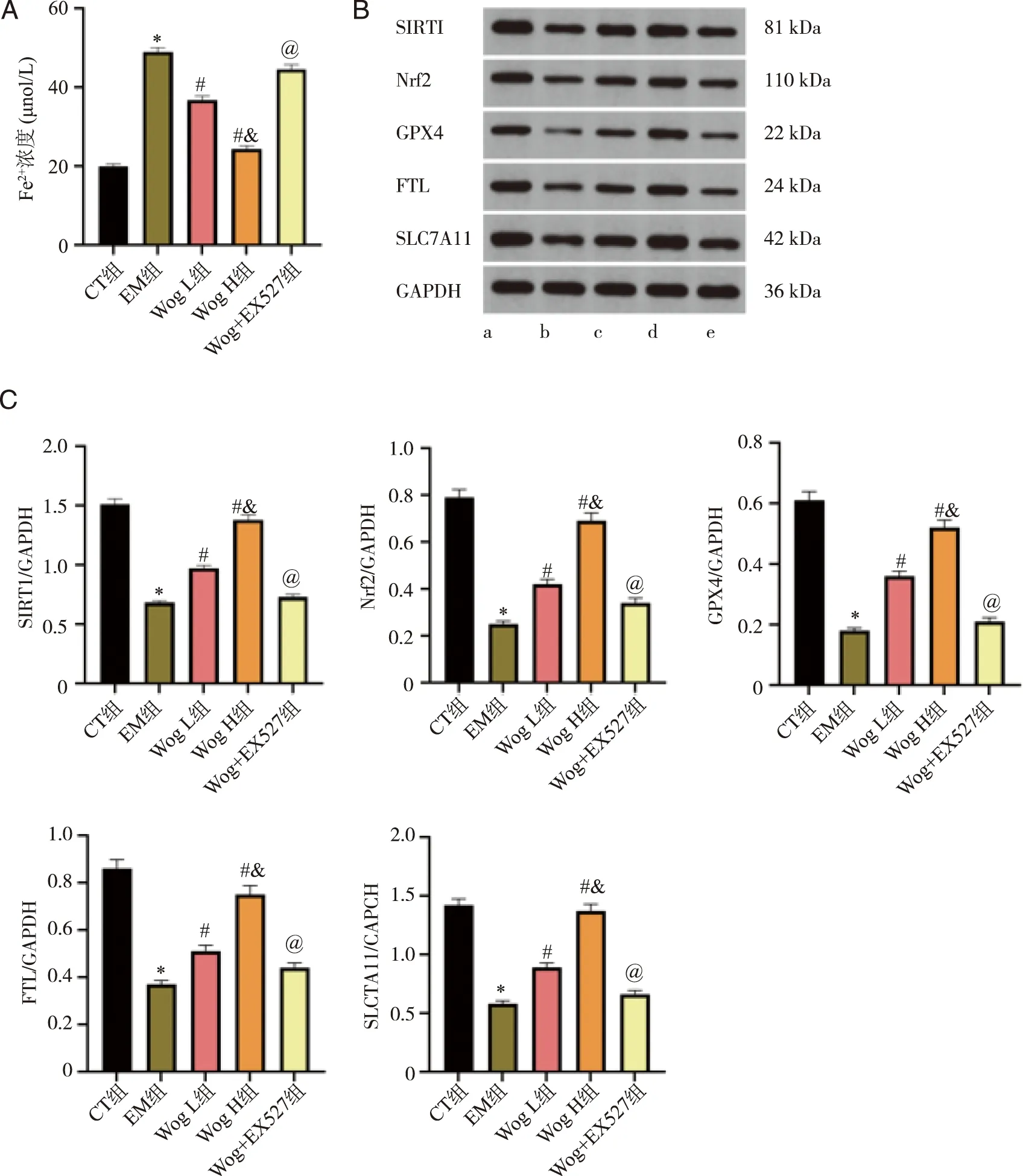
A:各组大鼠异位内膜组织Fe2+浓度比较;B:Western blot检测异位内膜组织蛋白的表达;C:各组SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平比较;a:CT组;b:EM组;c:Wog L组;d:Wog H组;e:Wog+EX527组;*:与CT组比较,P<0.05;#:与EM组比较,P<0.05;&:与Wog L组比较,P<0.05;@:与Wog H组比较,P<0.05。图4 各组大鼠异位内膜组织Fe2+浓度及蛋白表达水平比较
2.6 各组大鼠异位内膜组织SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平比较 与CT组比较,EM组SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平降低(P<0.05);与EM组比较,Wog L、Wog H组SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平呈剂量依赖性升高(P<0.05);与Wog H组比较,Wog+EX527组SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平降低(P<0.05,图4B、C)。
3 讨论
约50%的不孕症妇女发生EM,表现为卵泡发育不良和卵母细胞质量下降,铁死亡是造成卵母细胞成熟障碍的主要原因[8]。子宫内膜基质细胞铁死亡还可能触发细胞因子分泌,并通过副分泌作用促进邻近病变血管的生成,从而推动EM的发展[9],探寻改善EM铁死亡的靶向制剂刻不容缓。Wog是黄酮类化合物的成员之一,来源于唇形科植物黄芩、滇黄芩、半枝莲等根茎,具有抗癌、抗炎、抗焦虑、神经保护、治疗细菌和病毒感染等多种活性[10]。EM是一种慢性炎症性疾病,本研究主要探究Wog对EM铁死亡的影响及可能的作用机制。
本研究采用自体子宫移植法构建EM大鼠模型,模型大鼠异位病灶体积增大,异位内膜组织腺体较少,可见大量炎性细胞浸润,呈典型的EM病理状态,说明模型构建成功。血清E2、P是反映性激素水平的2个重要指标,临床数据显示,EM患者血清E2、P水平较健康人群显著升高[11]。IL-1β、IL-6是引起慢性炎症所必需的细胞因子,影响子宫内膜基质细胞的增殖、粘附、迁移和侵袭,在EM的发生发展中发挥促进作用[12]。本研究也发现,EM大鼠血清E2、P、IL-1β、IL-6含量升高,说明性激素紊乱和炎症因子的过表达可能是促进EM进展的2个因素。EM大鼠经过Wog治疗显著抑制病灶体积的增大,改善异位内膜组织病理损伤,降低血清E2、P、IL-1β、IL-6的含量,说明Wog对EM具有治疗效果。
铁死亡是一种新型细胞程序性死亡形式,不同于细胞凋亡、坏死性凋亡、自噬等传统细胞死亡形式,其特征在于脂质过氧化物的铁依赖性积累至致死量,引起器官损伤和退行性病理[13]。铁是包括人类在内的大多数生物体生存的必需元素,铁摄入过多、高铁状态、铁死亡与包括EM在内的生殖疾病有关[14]。SIRT1可以调控细胞氧化应激、炎症反应、线粒体功能、自噬、凋亡等多种生理过程[15]。Nrf2是细胞抗氧化反应的关键调节因子,抵消氧化和亲电应激基因的表达[16]。SIRT1脱乙酰化激活Nrf2能够抑制铁死亡进程。GPX4是能够直接还原复杂磷脂氢过氧化物的酶,也是Nrf2的下游靶基因,靶向抑制GPX4被认为是触发铁死亡的关键策略[17]。SLC7A11和FTL是调节铁死亡的关键蛋白,抑制SLC7A11和FTL活性、下调GPX4可以诱导铁死亡[18]。铁死亡细胞及其溢出内容物还与疾病中的免疫反应失调有关[19]。本研究发现,EM大鼠异位内膜组织大量铁沉积,Fe2+浓度显著升高,SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平降低,说明EM触发了铁死亡,机体处于高铁状态,SIRT1/Nrf2信号通路被抑制,这可能也与前述促炎细胞因子过表达有关;Wog不仅能缓解铁沉积和Fe2+浓度升高,还能增加SIRT1、Nrf2、GPX4、FTL和SLC7A11蛋白表达水平;SIRT1抑制剂EX527和Wog联合使用干预EM大鼠的治疗效果和对SIRT1/Nrf2轴的影响不明显,未改善铁死亡现象,提示Wog可能通过激活SIRT1/Nrf2信号通路抑制EM大鼠铁死亡。
综上所述,Wog可能通过激活SIRT1/Nrf2信号通路抑制EM大鼠铁死亡。除此以外,Wog抑制肿瘤细胞ZR-75-30和HeLa的增殖以及治疗类风湿性关节炎也与调控铁死亡有关[20-21]。SIRT1/Nrf2途径对机体代谢的调控也是多方面的,本研究仅分析了SIRT1/Nrf2通路在调节EM铁死亡的作用,之后可以做进一步研究,丰富Wog作为临床用药的理论依据。
