S1P1在间断禁食抑制慢性脑低灌注大鼠海马星形胶质细胞极化中的作用
2023-11-03高兴红
张 淼,高兴红,胡 源
(1.武汉大学中南医院 神经内科,湖北 武汉 430071;2.遵义医科大学 基础医学院,贵州 遵义 563006;3.武汉大学中南医院 神经心理科,湖北 武汉 430071)
慢性脑低灌注状态是血管性认知障碍及阿尔茨海默病共同的病理生理机制[1]。脑低灌注状态引起脑组织缺血缺氧,由此产生一系列病理生理过程,包括过量氧自由基的产生、继发性的神经炎症反应以及血脑屏障破坏,最终引起认知功能损害[2]。研究慢性脑低灌注有助于为相关痴呆的临床防治提供新对策。
间断禁食(intermittent fasting, IF)即间断性在一段较长时间(一般为16或24 h)内不摄入或摄入极少能量,已被证明在包括阿尔茨海默病、缺血性脑卒中和帕金森病等多种神经疾病动物模型中具有神经保护效果[3]。本课题组之前的研究发现,脑缺血后间断禁食可以改善慢性脑低灌注大鼠认知损害,减轻海马神经损伤和降低炎症因子水平[4]。但间断禁食能否以及如何调节慢性脑缺血诱导的神经炎症反应,目前并不清楚。小胶质细胞和星形胶质细胞在中枢神经系统炎症反应中起主要作用[5-6],Liddelow等[7]研究发现,LPS诱导的神经炎症反应中,A1极化的星形胶质细胞而非小胶质细胞条件培养基对于神经元和少突胶质细胞前体细胞具有直接杀伤作用。此后的研究发现,星形胶质细胞A1极化现象广泛存在于衰老、帕金森以及阿尔茨海默等神经系统疾病中,改善星形胶质细胞极化可改善上述疾病动物模型的神经损伤[8]。本课题组前期研究发现,慢性脑低灌注可诱导海马星形胶质细胞A1极化[9]。间断禁食对CCH诱导的星形胶质细胞A1极化是否具有调节作用,目前尚不清楚。本研究拟探究间断禁食对CCH动物海马星形胶质细胞极化的影响,并构建离体慢性脑缺血模型,诱导星形胶质细胞极化,探讨其具体机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 Ponesimod(Selleck,S8241);氯化钴(CoCl2,Sigma, C8661);小鼠小胶质细胞细胞系BV2及小鼠海马神经元细胞系HT22细胞购于普诺赛生命科技有限公司(Procell Life Science& Technology Co.,Ltd.);超滤管购买自Sigma(UFC-9010);Trizol试剂 (Invitrogen, CA, US No.155960 26);逆转录试剂盒(Vazyme Biotech Co, Nanjing, China No. Q311-02);DAPI(上海碧云天生物技术研究所);S1P1一抗购买自武汉三鹰生物技术有限公司,C3d抗体购买自R&D公司,其余Western Blot一、二抗及荧光二抗均购买自Abcam公司;CCK8试剂盒购买自Abbkine公司,乳酸脱氢酶(lactate dehydrogenase,LDH)活性试剂盒购买自南京建成公司。
1.1.2 实验动物和分组 6周SPF级雄性SD大鼠,体重(200±20)g,购买于北京斯贝福生物技术有限公司,于武汉大学中南医院动物实验中心进行饲养。新购进的SD大鼠首先进行3 d适应性饲养(12 h/12 h昼夜循环)后再进行下一步实验操作。所有大鼠都给予充足的食物与洁净的饮用水。实验前将30只大鼠分为假手术组、慢性脑低灌注组及慢性脑低灌注+间断禁食3组。其中间断禁食组在手术后1周开始隔日间断禁食,即第1日撤除所有饲料,次日不限制饮食,以此类推,直至术后第8周取材停止。所有实验过程均经过武汉大学中南医院动物伦理委员会审批(NO:WP2020-08067),操作过程中尽可能减轻动物痛苦。
1.2 方法
1.2.1 双侧颈总动脉结扎手术 先将大鼠置于诱导盒中用4%异氟烷诱导约3 min,再将大鼠呈仰卧位置于保温垫上给予2%异氟烷持续吸入维持麻醉。沿颈部正中线依次剪开皮肤和肌肉,钝性分离筋膜,寻找胸锁乳突肌与颈正中肌夹角内侧的颈动脉鞘,弯镊小心分离出搏动的颈动脉并避免损伤迷走神经,4号不可吸收手术缝线先结扎近心端,再结扎远心端。一侧结扎结束后结扎另一侧。手术完毕后,将大鼠呈侧卧位放置回笼内并给于充足的食物与饮水。假手术组仅分离出颈动脉而不进行结扎。
1.2.2 Western blot 术后8周,大鼠经4%异氟烷过量麻醉致死后断头取脑。新鲜组织快速剥除颅骨,去除脑膜后置于冰上,取双侧海马放入液氮中速冻后存放于-80 ℃冰箱; Western blot检测时,取大鼠海马组织或离心后细胞,置于冰上,加入RIPA裂解液,充分裂解后检测蛋白浓度,加入上样缓冲液后混匀,金属浴煮沸变性后上样。根据蛋白浓度于SDS-PAGE凝胶进行上样,每孔20 μg蛋白,设置电泳条件为75 V,30 min + 120 V,60 min,待溴酚蓝近玻璃底边时停止电泳,裁剪合适大小的PVDF膜,200 mA恒流转膜,根据目的蛋白分子量大小选择合适转膜时间。转膜后4 ℃冰箱内一抗孵育过夜,次日漂洗后加入相应HRP二抗,室温孵育1 h后ECL显色。
1.2.3 免疫荧光 对大鼠进行麻醉,用4%多聚甲醛经心肌灌注脑组织,30%蔗糖脱水后用OCT包埋切片。PBS润洗脑片,用稀释的一抗在4 ℃孵育过夜,次日PBS清洗5次,然后与相应荧光二抗常温孵育1 h后DAPI染色。在Olympus bx53荧光显微镜下拍摄海马CA1区图像(至少3个视野)。用ImageJ统计每个视野中的GFAP阳性细胞及GFAP/C3d双阳性细胞,二者比值为A1细胞比率。
1.2.4 原代星型胶质细胞的提取 取出生1 d内的SD大鼠乳鼠,麻醉后75%酒精喷洒消毒皮肤,将头颅剪下后置于培养皿中,培养皿预先加入分离液:HBSS+1%胎牛血清+1%青霉素(链霉素)溶液。剪开颅骨,分离两侧皮质,去除脑干及小脑,剥离脑膜。0.05%胰酶消化皮质5 min后加入完全培养基中和,随后将液体分离成单细胞混悬液,离心去除上清后加入2 mL完全培养基重悬,接种至T75培养瓶中。约1周后将T75培养瓶置于轨道摇床,37 ℃ 220 r/min 6 h去除小胶质细胞即获得纯化后的原代星型胶质细胞。
1.2.5 细胞分组及处理 根据文献报道,我们采用梯度浓度S1P1抑制剂ponesimod预处理星形胶质细胞,然后加入相应MCM处理[10]。即慢性缺氧模型浓度摸索实验,氯化钴以不同浓度(0、50、75、100 μmol/L)加入培养基中诱导缺氧48 h后收取条件培养基。将小胶质细胞条件培养基(microglia conditioned medium, MCM)加入原代星形胶质细胞并进行后续极化标志物转录水平及星形胶质细胞条件培养基(microglia conditioned medium, ACM)毒性检测。对于药物实验,不同浓度Ponesimod预处理原代星形胶质细胞4 h后,换液并加入各组MCM处理24 h后检测极化标志物及毒性。条件培养基进行超滤处理的方式相同。收集细胞上清后1 000 r/min 10 min离心去除细胞碎片;随后将液体转移至超滤管中,4 000 g, 20 min 4 ℃离心后小心吸取浓缩后的上清即为条件培养基。
1.2.6 RT-PCR 吸去细胞培养液上清后,DPBS洗涤细胞3遍,随后加入Trizol。加入氯仿12 000 r/min 15 min 4 ℃离心后小心吸取中间水相层,加入等体积异丙醇混匀后静置10 min。 预先以DEPC水配置75%乙醇,在12 000 r/min 10 min 4 ℃条件下离心后弃去上清后加入75%乙醇,再次7 500 r/min 15 min 4 ℃离心。弃去上清并小心吸去残留乙醇,加入适量DEPC水后55 ℃ 10 min促溶解,nanodrop测定浓度。逆转录条件:42 ℃ 2 min去除基因组DNA, 50 ℃ 15 min ,85 ℃ 5 s,4 ℃维持后完成逆转录。SYBR Green 荧光染料试剂盒构建qPCR体系,设立3个复孔。qPCR条件:预变性 95 ℃ 30 s,循环反应 95 ℃ 5 s至60 ℃(根据不同引物的 Tm 值进行调整) 30 s,循环反应 40 次,溶解曲线 95 ℃ 30 s~60 ℃ 60 s~95 ℃ 15 s。引物序列见表1。

表1 各指标PCR引物序列
1.2.7 CCK8检测细胞增殖活性 在无菌96孔板上以每孔1 500~2 000个细胞的密度接种细胞,待次日贴壁后药物干预。使用各组星型胶质细胞条件培养基对HT22细胞作用48 h。作用时间结束后,吸尽孔内液体,配制含有10%CCK8试剂的完全培养基加入每孔中并设置空白对照,37 ℃孵育2 h后在450 nm波长的酶标仪中测定吸光度(OD值)。
1.2.8 乳酸脱氢酶(lactate dehydrogenase,LDH)活性检测 在无菌96孔板上接种HT22细胞,待次日贴壁后,使用相应组别ACM加入细胞处理48 h后将上清吸出。按试剂盒说明书,将缓冲液及辅酶加入上清液中混匀,37 ℃孵育15 min。随后在混合液中加入2,4-二硝基苯肼混匀,37 ℃孵育15 min后加入NaOH溶液室温放置3 min,酶标仪检测450 nm波长检测吸光度,按说明书计算各组细胞上清LDH活性。

2 结果
2.1 间断禁食对慢性脑低灌注大鼠海马星形胶质细胞极化的影响 与对照组相比,慢性脑缺血组大鼠海马C3d(A1极化标志物)/GFAP双标星形胶质细胞明显增多(P<0.05,图1A,1B),间断禁食可降低慢性脑低灌注大鼠海马C3d/GFAP双重标记细胞数量,提示间断禁食可抑制慢性脑低灌注诱导的星形胶质细胞A1极化。

A:各组大鼠海马CA1区C3d/GFAP双重荧光标记,Scale Bar = 50 μm;B:各组C3d/GFAP阳性细胞占GFAP总细胞百分比;Con:对照组;CCH:慢性脑低灌注组;IF:慢性脑低灌注+间断禁食组;*:与Con相比,P<0.05;#:与CCH组比较,P<0.05;n=4。图1 间断禁食对慢性脑低灌注大鼠海马星形胶质细胞极化的影响
2.2 间断禁食对慢性脑低灌注大鼠海马神经损伤的影响 与对照组相比,慢性脑缺血组NeuN及PSD95(分别为神经元及突触标志物)蛋白表达下调,间断禁食可恢复慢性脑低灌注引起的NeuN和PSD95蛋白水平下降(P<0.05,图2A、B)。此外,间断禁食可抑制慢性脑低灌注诱导的S1P1蛋白表达上调(P<0.05,图2A、B)。以上结果提示间断禁食下调S1P1蛋白水平的同时可减轻慢性脑低灌注大鼠海马的神经损伤。

A:各组大鼠海马组织S1P1、NeuN和PSD95蛋白条带;B:条带分析统计结果;Con:对照组;CCH:慢性脑低灌注组;IF:慢性脑低灌注+间断禁食组;*:与Con相比,P<0.05;#与CCH组比较,P<0.05;n=4。图2 间断禁食对慢性脑低灌注大鼠海马神经损伤的影响
2.3 体外慢性缺氧诱导星形胶质细胞极化模型的构建 采用氯化钴处理小胶质细胞诱导慢性缺氧,将其条件培养基(MCM)加入星形胶质细胞,取后者条件培养基(ACM)加入神经元细胞系HT22细胞(图3A)。与对照组相比,各组浓度氯化钴(50、75、100 μmol/L)诱导的星形胶质细胞ACM均可引起HT22细胞活性下降(P<0.05,图3B),LDH释放增加(P<0.05,图3C)。提示不同浓度氯化钴慢性处理均可诱导星形胶质细胞毒性极化。检测各组星形胶质细胞A1极化标志物,虽然各组A1标志物转录均显著高于对照组(P<0.05,图3D),但100 μmol/L氯化钴组A1标志物转录水平更高,因此取该浓度进行后续实验。

A:体外实验流程;B:不同浓度氯化钴慢性处理后星形胶质细胞ACM对HT22细胞活性的影响;C:各组HT22细胞上清LDH活性;D:不同浓度氯化钴慢性处理后星形胶质细胞A1标志物的转录水平; CoCl2 :氯化钴;*:与0 μmol/L比较,P<0.05;n=3。图3 慢性缺氧诱导星形胶质细胞极化体外模型的构建
2.4 S1P1抑制剂Ponesimod能够模拟间断禁食抑制体外缺氧诱导的星形胶质细胞A1极化及神经毒性 采用梯度浓度S1P1抑制剂Ponesimod预处理星形胶质细胞,然后加入相应MCM处理。结果显示,高浓度(10 μmol/L)Ponesimod可降低慢性缺氧诱导的星形胶质细胞S1P1蛋白表达和A1极化标志物C3转录增加(P<0.05,图4A、D),减轻慢性缺氧条件下星形胶质细胞ACM对HT22细胞活性的抑制(P<0.05,图4B),同时减少慢性缺氧ACM诱导的HT22细胞LDH释放(P<0.05,图4C)。
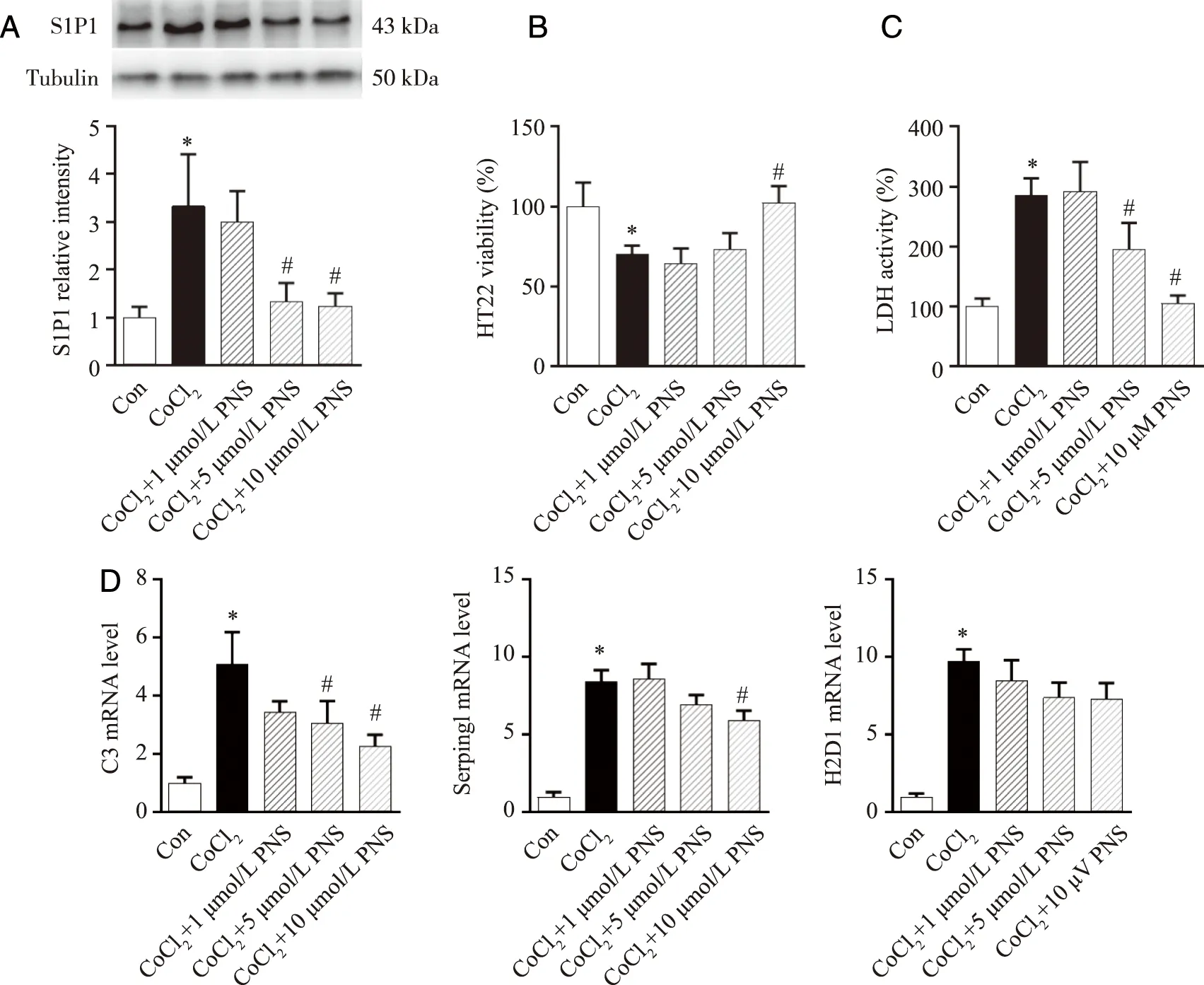
A:各组星形胶质细胞S1P1蛋白表达及分析;B:各组ACM对HT22细胞活性的影响;C:各组HT22细胞上清LDH活性;D:RT-PCR法检测各组星形胶质细胞A1极化标志物转录水平;Con:对照组,CoCl2 :氯化钴,PNS:Ponesimod;*:与Con组比较,P<0.05;#:与CoCl2组比较,P<0.05;n=3。图4 Ponesimod模拟间断禁食抑制体外缺氧条件下星形胶质细胞A1极化及神经毒性
3 讨论
本研究发现间断禁食在降低慢性脑低灌注大鼠海马鞘氨醇-1-磷酸受体1(sphingosine 1-phosphate receptor 1,S1P1)表达的同时,抑制星形胶质细胞A1极化及神经损伤;进一步构建离体模型,发现使用S1P1抑制剂能够模拟间断禁食抑制慢性缺氧诱导的星形胶质细胞A1极化及其神经损伤作用,因此星形胶质细胞S1P1可能是间断禁食抑制慢性脑缺血神经炎症作用的重要靶点。
Liddelow等[7]发现,使用脂多糖诱导小胶质细胞,将其条件培养基(MCM)加入星形胶质细胞,可刺激后者产生毒性极化(A1极化)作用,具体表现为形态及转录组的改变,如大量表达C3、H2D1、Serping1等基因。同时A1细胞可通过非细胞接触的方式,分泌毒性物质,其条件培养基(ACM)具有神经毒性,可诱导神经元和少突胶质细胞前体细胞死亡;而脂多糖直接刺激星形胶质细胞则无此现象。此外,该研究还发现,小胶质细胞条件培养基对神经细胞亦无杀伤作用,提示星形胶质细胞是神经炎症中具有直接神经损伤作用的环节[7]。 此后的研究发现,星形胶质细胞A1极化现象广泛存在于肌萎缩侧索硬化、帕金森病以及阿尔茨海默病等多种神经系统疾病中,药物或分子手段抑制星形胶质细胞极化可改善上述疾病动物模型的神经损伤[11]。间断禁食为单位时间内(如1 d或16 h)不摄入或摄入极低能量的一种饮食方式,在神经科学领域,间断禁食被证明对阿尔茨海默病、帕金森病及急性缺血性卒中等多种疾病的动物模型具有神经保护作用[12]。本题组前期研究也发现,间断禁食能够降低慢性脑低灌注大鼠海马炎症因子表达,改善其认知损害[4],但间断禁食抗神经炎症的机制以及具体作用的细胞亚型及分子靶点并不清楚。本题组及其他课题组既往研究表明,慢性脑低灌注能够引起星形胶质细胞极化[9, 13],本研究发现间断禁食能够降低慢性脑低灌注大鼠海马GFAP/C3d共标记星形胶质细胞(A1极化细胞)数量,揭示了间断禁食在慢性脑缺血诱导的神经炎症中的作用靶细胞。
S1P1是神经酰胺代谢产物鞘氨醇-1-磷酸的受体之一。Gaire等[14]发现在小鼠脑缺血再灌注模型中,脑S1P1表达显著增加,而敲除该模型小鼠脑中的S1P1表达则能够降低小鼠脑梗死体积、降低神经炎症因子的表达,该结果表明S1P1的活化在脑缺血中是神经炎症反应的上游事件。中枢神经系统中,S1P1主要表达于星形胶质细胞;本研究中间断禁食抑制慢性脑低灌注大鼠海马S1P1表达上调和星形胶质细胞A1极化,离体实验使用S1P1抑制剂能够模拟间断禁食,抑制星形胶质细胞A1极化,发挥神经保护作用,提示抑制S1P1介导的星形胶质细胞A1极化可能是间断禁食发挥抗炎作用的重要机制。间断禁食如何下调S1P1目前机制不明,值得进一步研究。
相对于传统S1P1抑制剂如fingolimod、Ponesimod对于S1P1特异性明显增强,且可通过抑制S1P1改善双环己酮草酰二腙(铜螯合剂)诱导的扣带回脱髓鞘病变[10]。本研究在离体缺氧模型中也发现Ponesimod可模拟间断禁食对星形胶质细胞A1极化的抑制作用,下调A1极化标志物并降低ACM毒性。但也注意到,Ponesimod下调A1极化标志物转录水平的作用较微弱,提示极化标志物转录水平与ACM神经毒性之间不完全对应。已有文献提示,突触核蛋白、致病性朊蛋白等均可引起星形胶质细胞毒性极化[15-16],但其极化后毒性成分与传统方式,即脂多糖诱导的毒性极化可能存在差异。此后的研究将着重于细化星形胶质细胞激活后的分类并研究其在不同病理条件下的毒性成分[17]。
综上所述,S1P1可能介导间断禁食对慢性脑低灌注大鼠海马星形胶质细胞毒性极化的抑制作用,本文为慢性脑低灌注相关痴呆疾病的防治提供药物靶点,并为间断禁食这一非药物干预手段提供临床转化依据。
