老年长病程低级别胶质瘤1例并文献综述
2023-11-02黎辰王丽琨叶飞伍国锋
黎辰,王丽琨,叶飞,伍国锋
低级别胶质瘤(low-grade glioma,LGG)是指2007版WHO颅内肿瘤诊疗指南中Ⅰ级、Ⅱ级少突胶质细胞瘤及星形细胞瘤;LGG发病高峰在35~45岁,在60 岁以上的老人中发病率仅有约10%~18%;老年LGG 恶化发生率高,总体生存期较短,且由于年龄因素影响,基础疾病较多,手术治疗受限,目前关于老年低级别胶质瘤治疗及预后的临床研究很少。现报道1例老年长病程低级别胶质瘤患者,并对近年来LGG的诊疗进展进行总结分析。
1 病例资料
患者,男性,70 岁,因“反复发作性抽搐8 年,加重10 天”入院,患者于8 年前开始有抽搐发作,发作时为牙关紧闭,口角流涎,双上肢强直,约1~2 min后缓解,1~2 次/月,事后能够回忆;经抗癫痫口服卡马西平,0.1 g/次,3 次/d,治疗效果可;出院后有癫痫反复发作,约2~3个月发作1次,针对癫痫发作服药不规律,发作频繁时自行加药,发作减少时,自行停药。10天前,患者无明显诱因抽搐症状较前加重,表现为发作频繁,发作3~4 次/d,持续时间2~3 min/次。无恶心、呕吐,无视物旋转,无肢体活动障碍、意识障碍等。心肺腹查体及神经系统查体无阳性体征。头颅CT 提示:左侧颞顶叶可见混杂片状密度增高影,密度不均,其间可见多发斑片状密度增高影,密度均匀,边缘清晰(图1 A、B)。头颅MR 平扫示:左侧颞叶、顶叶可见片状稍长T1、稍长T2信号影,在FLAIR上呈高信号,其脑回稍肿胀,脑沟变浅。考虑中枢神经原始神经外胚层肿瘤可能。头颅MR 增强示:左侧岛叶及颞顶叶病灶内可见条片状不均匀强化影。头颅DWI 结果提示:左侧岛叶及颞顶叶病变呈稍高信号改变(图1 C-F),考虑影像学特点不符合脑梗死后遗症期软化灶改变,更倾向于颅内占位变化,排除手术禁忌症后行立体定向微创穿刺颅内病灶活检术(图2)。脑组织病理HE结果提示肿瘤细胞呈浸润性生长,带晕,呈蜂房、煎蛋样排列,血供丰富,毛细血管增生丰富(图3)。免疫组化结果示IDH-1(+)、Ki67(+)1%、S-100(+)、P53(±)、Vim(-)、Syn(-)、GFAP(+)、NeuN(+)(图3)。诊断考虑为少突胶质细胞瘤。活检后患者及家属决定保守治疗,目前仅给予抗癫痫治疗,左乙拉西坦口服,1 片/次,2 次/d;卡马西平3 片/次,3 次/d。目前患者发作频率约为1次/月,每次1 min 左右,平时下地务农,不影响日常工作。
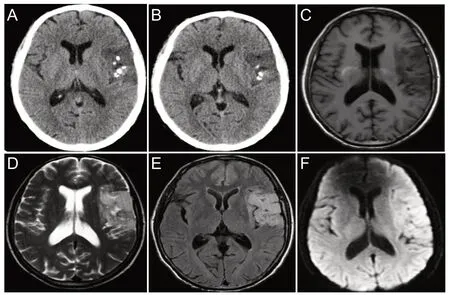
图1 患者活检前影像学表现
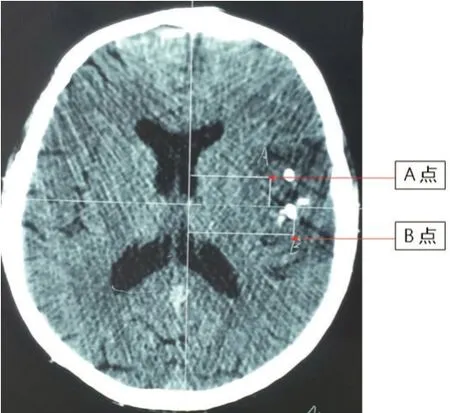
图2 立体定向微创穿刺颅内病灶活检术术前定位CT

图3 活检术后病理及免疫组化
2 讨论
少突胶质细胞瘤占所有胶质瘤的10%,原发性中枢神经系统肿瘤的2%~4%,临床症状中癫痫发病率在70%以上,神经功能缺损发生率低,病理呈煎蛋样改变,常在皮质及皮质下呈浸润性生长,无清晰包膜及边界。在MRI上可见病灶常位于皮质及皮质下,CT 上可见多发钙化灶,增强MRI 中无强化或点状、花边样强化。少突胶质细胞瘤与星形细胞瘤同属于低级别胶质瘤(LGG),即侵袭生长能力差,恶变发生率低。随着功能影像学的发展,通过弥散灌注成像、核磁波谱成像等可实现对LGG 的初步识别。LGG 的预后受年龄、免疫组化类型等多种因素的影响。欧洲癌症研究及治疗组织提出影响总体生存期及无进展生存期(progression-free survival,PFS)的5个危险因素:星形细胞瘤的组织学特点、年龄>50 岁、胶质瘤直径>4 cm、肿瘤跨中线生长、神经功能缺损或卡氏评分(Karnofsky Performance Status,KPS)≤80 分,超过2 个危险因素为高危人群。随访研究发现未经治疗的高危人群总生存期(overall survival,OS)及无进展生存期(progression-free survival,PFS)为3.9 年及1.9 年,低危人群可总生存期OS可在10年以上[1]。
近年来分子病理学研究发现了很多与LGG 密切相关的分子标记物,对于预测LGG的预后提供了重要的信息。主要的有以下2个:①异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)基因突变:胶质瘤患者在IDH活性位点132位精氨酸处发生频繁突变,涉及395 位鸟嘌呤突变为腺嘌呤[2]。IDH 突变在WHOⅡ级胶质瘤中占65%~80%,其中少突胶质瘤突变率为75%~80%,95%以上的IDH 突变见于IDH1 R132H位点上的点突变。IDH突变多发生在年轻患者且预示着较长的PFS[3]。有研究通过对中国人脑胶质瘤基因组学数据库样本的分析提示IDH突变频率高且年轻患者预后好,IDH 突变频率低且患者年龄大提示预后差[4]。②染色体1p 和19q 联合缺失:发生在80%~90%WHOⅡ级少突胶质细胞瘤中,1p/19q 联合缺失的少突胶质瘤细胞有较慢的肿瘤生长速度,并对化疗敏感,该类少突胶质瘤患者已被证明通过PCV 方案(甲基苄肼+罗氮芥+长春新碱)及替莫唑胺治疗预后得到明显改善,生存期延长[5],其原因可能与染色体易位丢失产生抑癌基因有关。此外,与1p/19q 联合缺失相关的还有端粒酶逆转录酶(telomerase reverse transcriptase,TERT)启动子区突变,二者重合发生的几率达98%,在少突胶质细胞瘤中发生率达70%以上[6]。
2016年WHO中枢神经系统肿瘤诊断与治疗指南将分子生物学特征作为胶质瘤分类的一项必须条件,弥散型胶质瘤被重新分为3类:①星形胶质瘤,IDH突变型;②星形胶质瘤,IDH野生型;③少突胶质细胞瘤,IDH突变及1p及19q联合缺失同时存在;④少突胶质细胞瘤,1p及19q联合缺失,缺少IDH突变,这种类型非常少见,仅占胶质瘤的0.3%[7]。由于60岁以上老年胶质瘤发病率降低,在上述基因分型的样本采集中老年人的比例是较低的,癌症基因组图谱研究网络对293个WHOⅡ级胶质瘤进行基因分析时发现60岁以上患者仅有14个,其中仅有8个符合上述WHO基因型分类[8]。
关于LGG 的治疗目前普遍被认可的为手术后辅助以放射治疗(radiation therapy,RT)及甲基苄肼、环己亚硝脲、长春新碱(procarbine lomustine vincristine,PCV)联合替莫唑胺化疗(chemical therapy,CT),手术包括微创脑组织活检术、肿瘤近全切除术、肿瘤全切术(gross tumor resection,GTR)。LGG 多无完整包膜,GTR 病理诊断准确率高,且可解除对周围脑组织压迫,但切除范围广,无法做到微创,对脑组织损伤大;微创脑组织活检术损伤小,但其确诊率受活检穿刺定位、取材部位及取材大小等因素影响。由于LGG患者可获得较长的生存期,如何最大限度降低手术风险,使患者获得最佳生存质量,精确病理诊断及分级是影响LGG 治疗选择的主要因素。对于影像诊断高度考虑LGG 的患者进行微创活检或直接GTR 一直存在争议,对于低危LGG 人群,通过立体定向微创脑活检术及分子病理诊断,减少了手术带来的损伤,可极大提高生存质量[9]。随着影像技术的发展,立体定向已从基于框架定向发展到通过功能影像学定位,已有临床研究通过仪器引导如共焦激光内窥镜系统或术中磁共振与光敏剂结合引导定位穿刺来实现精确瞄准和简化操作流程,诊断的准确率均达95%以上,且手术时间短、可耐受性高,感染发生率小[10,11]。
对于高危LGG 目前的研究提示积极早期切除肿瘤有助于延长生存期,一项随访研究发现未经治疗的高危人群OS 及PFS 为3.9年及1.9年,而GTR后辅以RT及CT可使得PFS达近10年[1]。欧洲神经肿瘤学协会提出:对于IDH突变型,1p及19q联合缺失的WHOⅡ级少突胶质细胞瘤及IDH突变型星形细胞瘤,年龄<40 岁,KPS 评分>80 分等提示良好预后的人群可选择单纯放射治疗后PCV 化疗,通过定期复查核磁共振以决定是否需要GTR;对于IDH 野生型WHOⅡ级星形细胞瘤,建议尽早放疗加上替莫唑胺化疗后GTR[12]。一项多中心随机对照试验比较了GTR 及术后联合放化疗的治疗预后,结果提示高危LGG 患者行GTR 术后放化疗的PFS 及OS 的中位数可达4.0 年及7.8年[13]。
老年LGG中高危人群占80%以上,但由于发病率较年轻人低,目前关于60 岁以上老年LGG 的治疗临床研究很少。本例报道患者70岁,KPS评分80分,为高危人群,行微创脑活检术后仅予抗癫痫对症治疗获得了10年以上的生存期。在治疗方式的选择上,老年LGG 需充分考虑预期寿命、患者对手术及术后放化疗并发症的耐受程度及对生活质量的影响[14]。临床研究提示60岁以上患者选择GTR的比例仅占20%左右,微创脑活检术是更容易被接受的选择。有随访研究提示60岁以上LGG患者GTR术后并发症较年轻患者显著增多,且并未延长PFS 及OS[15]。2019年一项多中心回顾性研究提示40岁以上患者GTR对于胶质瘤治疗具有关键作用,但术后放化疗并未延长PFS 及OS,反而使生存期缩短[16]。但也有文献认为,60~69岁及70~79岁的LGG 患者预期寿命为6 年及1.3 年,积极治疗有可能改善60 岁以上患者的OS[17]。美国加州大学对26例平均年龄66岁的胶质瘤患者进行GTR 及放化疗并进行以死亡为终点的随访,发现OS平均5.2年,少突胶质细胞瘤的PFS及OS较星形细胞瘤明显延长,该试验治疗并发症的发生率并未高于低龄组LGG 患者,提示老年LGG从GTR中获益的关键因素可能为术后并发症的控制[18]。这对老年LGG的治疗提供了一个新的方向,但该研究样本量小,且老年人易合并基础疾病,能否从GTR 中获益仍需更多临床研究。
近年来,关于LGG的手术方式及术后是否需要积极放化疗存在很大争议,尤其关于老年人LGG的研究很少。2018年一项Meta 分析提示安全范围内尽可能多的切除胶质瘤组织可获得OS及PFS的延长,癫痫症状也能更好控制,但对于老年LGG的获益并不肯定[19]。随着功能影像学的发展及定向活检精确度的不断提高,立体定向微创脑组织活检术可能成为老年LGG的首选手术方式。本例患者经微创活检术后保守治疗,获得较高的生活质量及较长的生存期。未来需要更多的临床试验比较老年LGG在立体定向微创脑组织活检术及GTR中的获益及风险,为风险最小、治疗费用最低及生存质量最高的个体化治疗提供更准确的循证医学证据。
