芝麻Cu/Zn超氧化物歧化酶基因的全基因组鉴定与分析
2023-11-02张文香崔文宁高小宽梁魁景
张文香 崔文宁 高小宽 梁魁景
(衡水学院生命科学学院,河北 衡水 053000)
超氧化物歧化酶(superoxide dismutase,SOD)是一种活性氧清除剂,植物在遇到逆境胁迫时便会产生大量的活性氧物质,影响植物的生长发育,因此超氧化物歧化酶活性的提高,有助于提高植物的抗逆性。从分子水平了解超氧化物歧化酶基因的特性,对于优良抗性基因的发掘以及植物抗性品种的选育均有重要的作用。根据超氧化物歧化酶的辅因子的不同,可以分为铁超氧化物歧化酶(Fe-SOD)、锰超氧化物歧化酶(Mn-SOD)、镍超氧化物岐化酶(Ni-SOD)和铜/锌超氧化物岐化酶(Cu/Zn-SOD)[1,2]。其中,Cu/Zn-SOD是植物体内含量最丰富,功能也最重要的一种活性氧清除酶[2]。目前,研究者已在多种植物中克隆到了Cu/Zn-SOD基因,并发现逆境可以诱导该基因的表达,提高植物的抗逆性。
芝麻(Sesamum indicum)具有丰富的营养价值和保健价值,被称为“油中皇后”。芝麻具有较好的耐贫瘠性,因此在多省份广泛种植,随着人民生活水平的提高,芝麻需求量日益增长[3]。干旱是制约芝麻产量的重要影响因素之一,因此本研究通过鉴定分析芝麻Cu/Zn-SOD基因,为芝麻抗性基因的挖掘提供基础[4]。
1 材料与方法
1.1 芝麻铜/锌超氧化物歧化酶基因的鉴定
根据Wang等[5]公布的基因组数据,下载芝麻全基因组序列(https://doi.org/10.6084/m9.figshare. 21151948),同时在TAIR网站下载拟南芥Cu/Zn-SOD基因的蛋白序列作为参考序列,通过本地blast筛选得分值≥100的候选蛋白序列。
1.2 蛋白质理化性质与结构域预测
在EXPASY(https://web.expasy.org/protparam/)预测芝麻Cu/Zn-SOD蛋白序列的分子量、氨基酸数量、等电点、亲水性、脂肪系数、不稳定系数等性质;通过GSDS2.0(http://gsds.gao-lab.org/)在线预测基因结构;在InterPro(http://www.ebi.ac.uk/interpro/result/InterProScan/)网站进行蛋白结构域预测;在TMHMM(https://dtu.biolib.com/DeepTMHMM)网站进行跨膜区预测;利用SignalP(https://services.healthtech.dtu.dk/services/SignalP-5.0/)进行信号肽预测;利用Cell-Ploc 2.0(http://www.csbio. sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行蛋白的亚细胞定位预测。
1.3 序列比对和进化树构建
下载拟南芥(Arabidopsis Thaliana)、水稻(Oryza sativa)、番茄(Solanum lycopersicum)、烟草(Nicotiana plumbaginifolia)等的Cu-Zn SOD蛋白序列,利用MEGA软件构建进化树,首先进行ClustW比对,然后采用NJ的方法构建进化树,bootstrap选择1000,其它为默认值。
2 结果与分析
2.1 芝麻Cu/Zn-SOD基因家族成员的鉴定及理化性质分析
以拟南芥Cu/Zn-SOD的蛋白序列,本地Blast芝麻全基因组蛋白序列,共鉴定出4条Cu/Zn-SOD序列,分别命名为SiCSD1、SiCSD2、SiCSD3、SiCSD4,对应的蛋白ID分别为Sesame03845.t1、Sesame19088.t1、Sesame15283.t1、Sesame06096.t1,对应染色体编号分别为3号、10号、9号和4号染色体,见表1。蛋白序列长度从165个氨基酸到245个氨基酸不等,其中,SiCSD1和SiCSD4蛋白序列最短,均为165个氨基酸,SiCSD2最长为245个氨基酸。等电点为5.6~6.92,说明均为酸性蛋白质。亲水性除SiCSD3为正值外,其余均为负值,说明SiCSD3为疏水蛋白质,其余3条为亲水蛋白质。脂肪系数为77.39~95.75,不稳定系数为13.66~34,说明蛋白均较稳定,见表1。
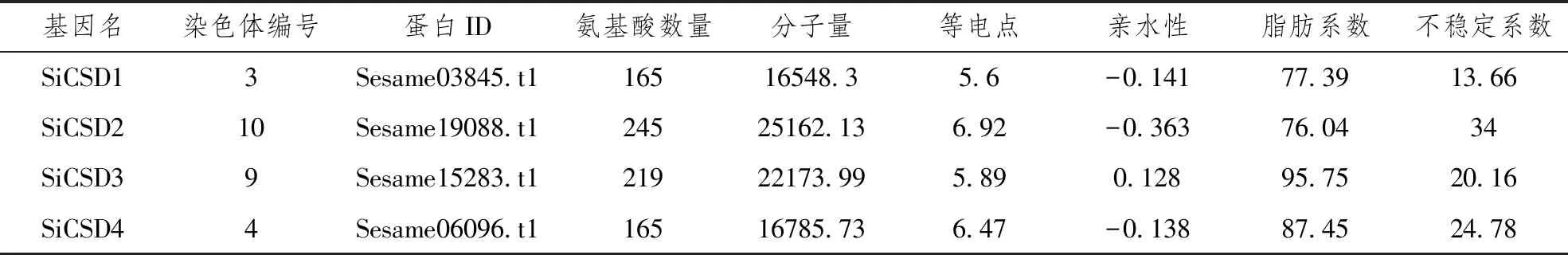
表1 芝麻Cu/Zn-SOD基因家族蛋白的理化性质
2.2 芝麻Cu/Zn-SOD基因家族成员的基因结构与蛋白结构域分析
根据基因注释文件,通过GSDS软件绘制芝麻Cu/Zn-SOD基因的结构图,结果如图1a所示,外显子和内含子的数量各不相同,SiCSD4的外显子数量最多,为10个;SiCSD2的外显子数量最少,为7个;SiCSD1、SiCSD3分别含有9个和8个外显子。在InterPro网站进行结构域预测,发现4条蛋白序列均含有Cu/Zn-SOD结构域和Cu2+、Zn2+结合位点,见图1b,跨膜结构域预测发现4条蛋白都不是跨膜蛋白,见图2,除SiCSD1预测到可信度较低的信号肽序列外,其他3条蛋白都未预测到信号肽序列,见图3。

图1 基因结构与结构域预测

图2 跨膜结构预测
2.3 芝麻Cu/Zn-SOD基因家族成员二级结构与亚细胞定位预测
通过SOPMA在线预测芝麻Cu/Zn-SOD蛋白的二级结构,结果发现,3条蛋白都是无规则卷曲含量最高,48.86%(SiCSD3)~58.18%(SiCSD4)。延伸链含量次之,25.71%(SiCSD2)~32.12%(SiCSD4)。除SiCSD3外,都是α-螺旋含量最低,β-转角次之;SiCSD1的α-螺旋含量最低,为3.03%,SiCSD3的α-螺旋含量最高,为15.07%,SiCSD4的β-转角含量最低为5.45%,SiCSD1的β-转角含量最高为7.88%,见表2。在Plant-mPLoc网站对芝麻Cu/Zn-SOD蛋白的亚细胞定位进行预测,SiCSD1-3都定位于叶绿体,SiCSD4定位于叶绿体和细胞质,见表2。
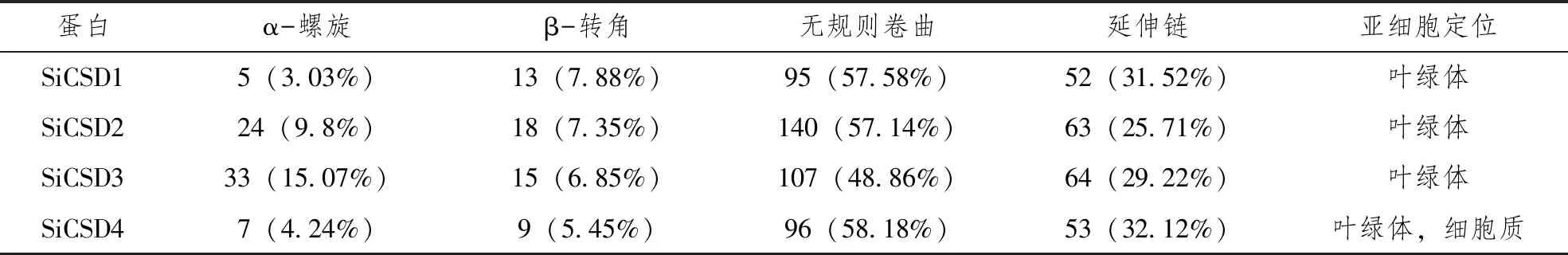
表2 蛋白二级结构与亚细胞定位预测
2.4 芝麻Cu/Zn-SOD基因的进化树分析
利用MEGA软件,将芝麻的4条Cu/Zn-SOD基因的蛋白序列(SiCSD1-4)与拟南芥(At CSD1-2)、水稻(OsSODC1-2)、番茄(SlSODC1-2)、烟草(NpSODC)进行比对并构建进化树,见图4,结果发现,SiCSD3与AtCSD2聚为1支,SiCSD4与AtCSD3聚为1支,SiCSD1和SiCSD2与NpSOODC、SlSODC1、SlSODC2聚在1个大的分支。

图4 进化树分析
3 结论与讨论
本研究通过全基因组水平的本地blast,获得4条芝麻Cu-ZnSOD基因,通过序列与理化性质的分析,对其序列长度、基因结构、亚细胞定位、进化关系等有了一定的了解,可以帮助后续对其功能的验证。
植物在遭受逆境胁迫时,体内活性氧升高。SOD是清除活性氧,帮助植物抵抗逆境胁迫的重要酶系统之一。其中,Cu/Zn-SOD又是植物体内含量最丰富、功能也最重要的一种SOD,目前对其研究也比较广泛,已在小麦[6,7]、棉花[8]、茶树[9]等多种作物进行全基因组水平的SOD基因鉴定。Han等在丹参全因组水平鉴定出3条Cu/Zn-SOD基因[10]。Zhou等在茶树全基因组中鉴定出7条Cu/Zn-SOD基因,发现其在抵抗干旱胁迫时可能发挥主要的作用[9]。Han等在日本落叶松中鉴定出4条Cu/Zn-SOD基因,其中3条的蛋白序列(LkSOD1,LkSOD3和LkSOD4)定位于细胞质,1条定位于叶绿体[11],与本研究中芝麻Cu/Zn-SOD类似。Cui等克隆了白菜Cu/Zn-SOD基因(BcCSD1),发现其在叶片中表达量最高,在根中的表达量最低,不同逆境胁迫处理都能诱导BcCSD1的表达量升高,尤其ABA处理表达量升高最明显[12]。Liu等发现,将麻风树的Cu/Zn-SOD基因在拟南芥中异位表达,能够增强拟南芥的耐盐性[13]。综上所述,Cu/Zn-SOD已在多种植物中验证对提高植物的抗逆性有着重要作用。
本研究对Cu/Zn-SOD基因序列的鉴定与分析,将为后期基因的克隆、载体构建、基因功能验证以及芝麻抗逆基因资源的获取等提供一定的研究基础。
