类普鲁士蓝纳米酶材料的制备及其酶催化反应动力学探究
——推荐一个分析化学综合实验
2023-11-02刘梦婷杨树芬薛雨臧嘉妍苏权燕郑兴烨曹秋娥周川华
刘梦婷,杨树芬,薛雨,臧嘉妍,苏权燕,郑兴烨,曹秋娥,周川华
云南大学化学科学与工程学院,化学化工国家级实验教学示范中心(云南大学),昆明 650091
1 引言
生物酶广泛存在于生物体活细胞中,并在生化反应中起重要作用[1]。由于酶催化反应具有灵敏度高和选择性好等优点,被广泛应用于化工生产、生物医学检测、环境保护等各个领域。但是由于生物酶价格高、易失活、存储困难,很难应用于实验教学。纳米酶是一种具有酶催化性能的纳米材料。与生物酶相比,纳米酶由于其成本低廉、对反应环境的耐受度高以及易于制备、催化性能优异等优点,引起了科研工作者的广泛关注[2]。目前,研究人员已经发现了许多具有模拟酶活性的纳米材料,如金属纳米材料、金属氧化物纳米材料、碳纳米材料、金属有机框架材料等等。
普鲁士蓝(PB,Fe4[Fe(CN)6]3),又称中国蓝,早在18世纪初作为染料被发现,随后在生物医学中多有应用,它是一种典型的六氰合铁配位化合物。随着对普鲁士蓝的不断深入研究,研究人员发现普鲁士蓝中的FeIII或者[FeII(CN)6]可以用其他过渡金属代替,从而得到一类它的衍生物——普鲁士蓝类配合物或者类普鲁士蓝(PBA)。它们具有和普鲁士蓝类似的结构[3],具有低成本、易于合成等优点,被广泛应用于电解水、储能材料、传感器、磁性材料等领域。
由于普鲁士蓝易于制备、成本低廉,而且有特殊的颜色,在实验教学中通常可以应用于设计科普实验[4]或趣味实验[5]。如吕喜风等将普鲁士蓝用于设计物理化学趣味实验,探究棉秆对废水中普鲁士蓝的吸附性能和吸附效果[5]。也可以将普鲁士蓝的合成与性质引入到本科实验教学项目中,如李娟等基于纳米普鲁士蓝设计了一个胶体化学综合实验[6];张彦卓等结合普鲁士蓝纳米材料设计了一个用于制备复合凝胶的药物制剂实验[7],这些教学设计有利于培养学生的创新思维。由于酶催化反应是一类非常重要的生物化学反应,在本科实验教学中引入纳米酶材料及酶催化反应动力学实验具有非常重要的意义[8]。尽管类普鲁士蓝纳米材料具有非常好的模拟酶催化性质,但是到目前为止,本科实验教学项目中还没有利用类普鲁士蓝纳米材料作为模拟酶,探究其酶催化性能的综合实验。
基于此,本文将普鲁士蓝及其类似物引入本科教学实验,通过分组实验制备和表征三种类普鲁士蓝纳米酶材料,并比较其模拟酶性质,讨论合成过程中配体及组成对其过氧化物模拟酶性质的影响,并将这些纳米酶材料应用于过氧化氢(H2O2)的分析检测。本实验试剂廉价易得,实验操作简单,实验现象直观,可以激发学生对于科学研究的热情与兴趣,培养学生的科研创新能力。
2 实验部分
2.1 实验目的
(1) 了解类普鲁士蓝纳米酶的性质,掌握其制备及表征方法;
(2) 掌握紫外-可见光谱仪的基本操作和原理;
(3) 了解Linewaerver-Burk双倒数方程,掌握米氏常数的计算方法;
(4) 掌握利用紫外-可见吸收光谱法检测H2O2,以及绘制标准曲线的方法。
2.2 实验原理
本实验采用共沉淀法制备普鲁士蓝及类普鲁士蓝纳米材料。普鲁士蓝由亚铁氰化钾与FeCl3通过共沉淀反应所得,产物为蓝色胶体溶液。其反应方程式如下:
铜铁类普鲁士蓝(CuFe PBA)由铁氰化钾与Cu(NO3)2·3H2O通过共沉淀反应所得,产物为浅黄色胶体溶液。
普鲁士蓝及类普鲁士蓝具有过氧化物模拟酶性质,它们可以催化H2O2分解产生羟基自由基,而羟基自由基可以将无色的3,3’,5,5’-四甲基联苯胺(TMB)氧化为蓝色的TMB+,后者在652 nm附近有最大吸收,因此可以利用TMB+的紫外-可见吸收来实现H2O2的含量测定。
酶的催化反应动力学实验可以帮助学生理解酶催化反应的基础理论知识,酶催化反应遵循Michaelis-Menten动力学模型。其反应方程如下式所示:
其中,v是反应速度,vmax是最大反应速度,[S]是底物的浓度,Km是米氏常数,Km越小,说明对底物的亲和能力越强。利用Linewaerver-Burk双倒数方程可求出Km和vmax。
Linewaerver-Burk双倒数方程如下式所示:
2.3 试剂或材料
本实验所需实验试剂如表1所示。
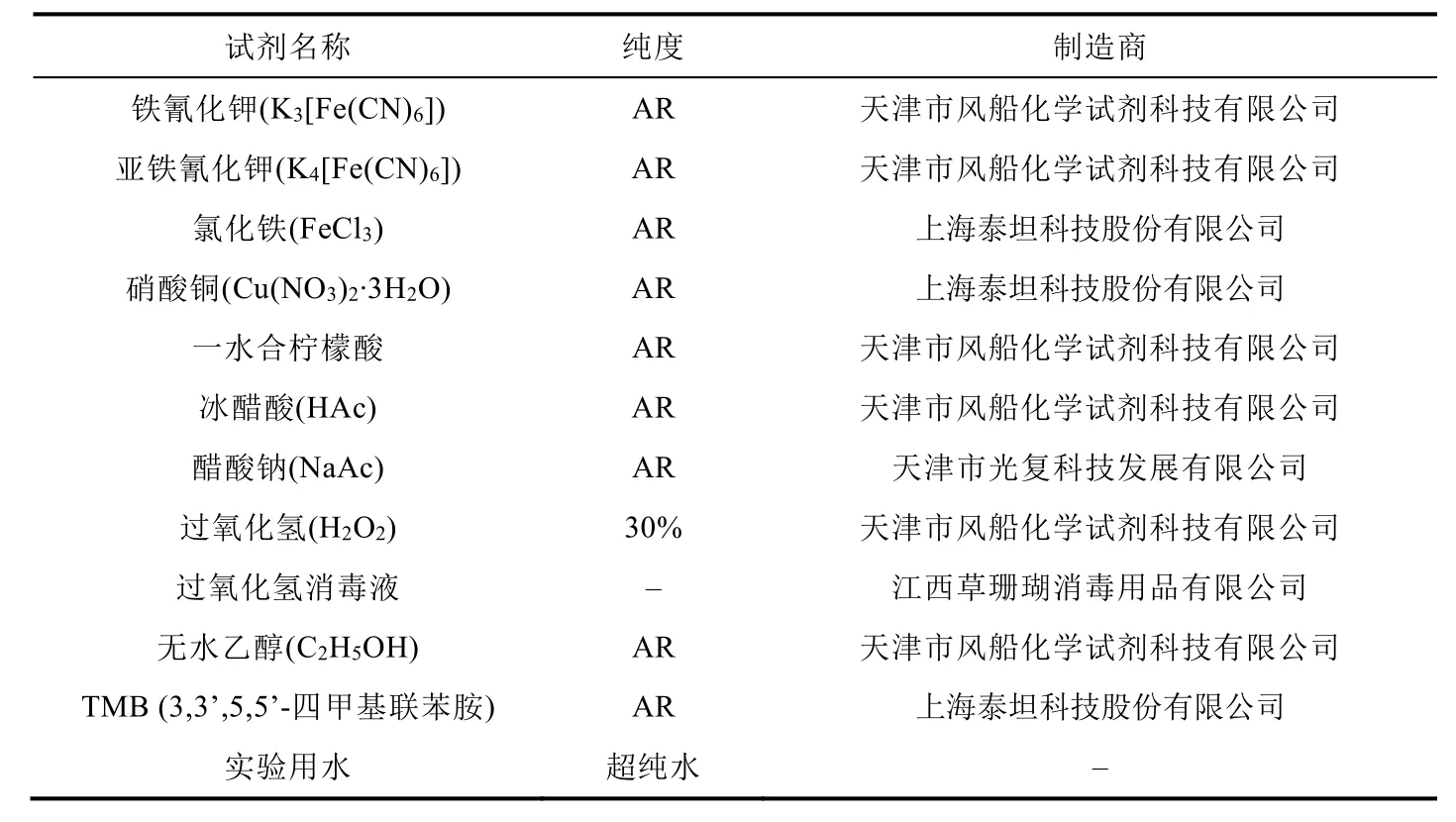
表1 本实验所用实验试剂
2.4 实验仪器
本实验所用仪器如表2所示。

表2 本实验所用仪器
2.5 实验步骤
本实验6人为一个大组,2人为一小组,每小组制备一种普鲁士蓝或者类普鲁士蓝纳米材料,制备方法如下。
2.5.1 溶液配制
(1) 柠檬酸母液的配制:准确称取柠檬酸0.2630 g,于250 mL容量瓶中加蒸馏水定容、摇匀,得到5 mmol·L-1柠檬酸溶液。
(2) A组溶液配制:准确称取K3[Fe(CN)6] 0.0660 g,于100 mL容量瓶中用柠檬酸溶液定容、摇匀,得到含2 mmol·L-1K3[Fe(CN)6]的柠檬酸溶液。准确称取Cu(NO3)2·3H2O 0.0380 g,于100 mL容量瓶中用柠檬酸溶液定容、摇匀,得到2 mmol·L-1Cu(NO3)2的柠檬酸溶液。
(3) B组溶液配制:以柠檬酸溶液为溶解介质,准确称取K4[Fe(CN)6] 0.0850 g,于100 mL容量瓶中用柠檬酸溶液定容、摇匀,得到2 mmol·L-1K4[Fe(CN)6]的柠檬酸溶液。准确称取FeCl3·6H2O 0.0110 g,于100 mL容量瓶中用柠檬酸溶液定容、摇匀,得到2 mmol·L-1FeCl3的柠檬酸溶液。
(4) C组溶液配制:以水为溶解介质,准确称取K4[Fe(CN)6] 0.0850 g,于100 mL容量瓶中加蒸馏水定容、摇匀,得到2 mmol·L-1K4[Fe(CN)6]的水溶液。准确称取FeCl3·6H2O 0.0110 g,于100 mL容量瓶中加蒸馏水定容、摇匀,得到2 mmol·L-1FeCl3的水溶液。
(5) 其他溶液:配制0.20 mol·L-1HAc-NaAc缓冲溶液(pH 4.6)、5.00 mmol·L-1TMB储备液、1.25 mol·L-1的NaCl溶液备用。
2.5.2 类普鲁士蓝纳米酶材料的制备
(1) CuFe PBA的制备(以柠檬酸为溶解介质)。
取A组2 mmol·L-1Cu(NO3)2的柠檬酸溶液20 mL,在60 °C水浴磁力搅拌下缓慢滴加20 mL 2 mmol·L-1K3[Fe(CN)6]的柠檬酸溶液(约30 min滴加完成),所得溶液继续在60 °C水浴搅拌5 min,待冷却至室温后,得到A组CuFe PBA备用。
(2) PB的制备(以柠檬酸为溶解介质)。
取B组2 mmol·L-1FeCl3的柠檬酸溶液20 mL,在60 °C水浴磁力搅拌下缓慢滴加20 mL 2 mmol·L-1K4[Fe(CN)6]的柠檬酸溶液(约30 min滴加完成),所得溶液继续在60 °C水浴搅拌5 min,待冷却至室温后,得到B组以柠檬酸为溶解介质PB (PB-柠檬酸)备用。
(3) PB的制备(以水为溶解介质)。
取C组2 mmol·L-1FeCl3的水溶液20 mL,在60 °C水浴磁力搅拌下缓慢滴加2 mmol·L-1K4[Fe(CN)6]的水溶液20 mL (约30 min滴加完成),所得溶液继续在60 °C水浴搅拌5 min,待冷却至室温后,得到C组以水为溶解介质的PB (PB-水)备用。
2.5.3 纳米酶材料的表征
(1) 丁达尔效应:将三种纳米酶材料稀释10倍后,用激光笔照射,从与光束相垂直的方向观察丁达尔效应。
(2) 透射电子显微镜(TEM)表征:将制备好的纳米酶材料离心分离后重悬在蒸馏水中,取5 μL稀释液滴于铜网上,利用TEM观察三种纳米酶的形貌。
(3) X射线粉末衍射(XRD)及X射线光电子能谱(XPS)表征:将离心纯化后的纳米酶真空干燥后进行XRD、XPS表征。
2.5.4 稳态动力学测定
取适量A组CuFe PBA用水稀释20倍,取适量B组PB-柠檬酸和C组PB-水,分别用水稀释10倍。每组准备6个50 mL比色管,按照表3分别加入TMB、PB(A)、HAc-NaAc缓冲溶液、蒸馏水,最后加入H2O2后迅速摇匀,快速利用紫外-可见光谱仪测定混合溶液652 nm处的吸光度(A652nm)随时间的变化。A组测定CuFe PBA的稳态动力学时先在6个比色管中依次加入2 mL 1.25 mol·L-1的NaCl溶液,再按照上述步骤进行操作。
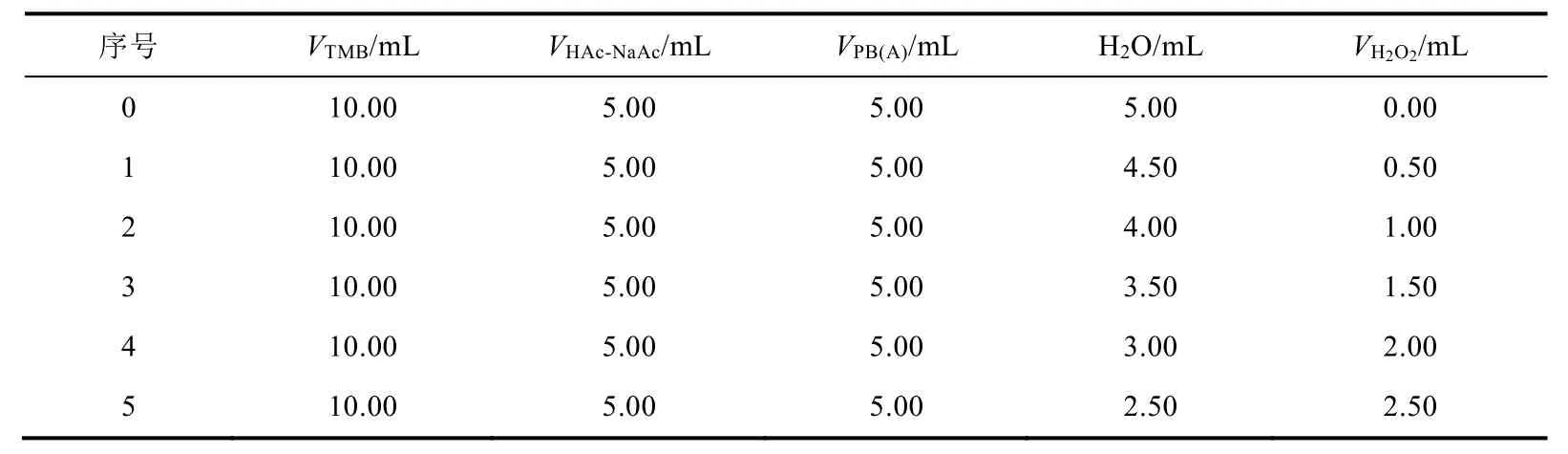
表3 稳态动力学测定各溶液加入量
注意事项:
(1) 取模拟酶前,可以先将其进行超声处理,以提高材料的分散性。
(2) 注意加入试剂的先后顺序,最后加入H2O2后应迅速混匀,并快速加入比色皿中测定动力学曲线。
2.5.5 过氧化氢的检测
取几个50 mL比色管,依次加入5 mL HAc-NaAc缓冲溶液、5 mL模拟酶稀释液、10 mL TMB,不同体积的蒸馏水,样品组加入1 mL稀释200倍后的消毒水溶液,加标组额外加入不同体积的0.01 mol·L-1H2O2标准溶液。每组溶液最后加入H2O2后迅速计时,5 min后立即测定溶液652 nm处的吸光度。
3 结果与讨论
3.1 类普鲁士蓝纳米材料的制备与表征
如图1a-c所示,所制备CuFe PBA为黄色溶液,PB-柠檬酸和PB-水为深蓝色溶液。当一束激光通过稀释后的PB及PBA溶液时,在垂直于入射光的方向可以观察到明显的光路,表明制备好的这三种材料均为胶体溶液,具有丁达尔效应。通过TEM图(图1d-f)发现这三种材料直径均在100 nm左右,都具有PB典型的方形块状结构。PB-水(图1f)比PB-柠檬酸(图1e)及CuFe PBA (图1d)尺寸稍小且棱角更加分明,证明配体对于纳米材料的合成具有一定的影响。我们也以CuFe PBA为例对所合成的纳米酶进行XRD表征,如图1g所示,其衍射峰与Cu3[Fe(CN)6]2的标准图谱一致,证明制备出的材料为铜铁类普鲁士蓝。进一步通过XPS表征(图1h),证明材料中存在Cu、Fe、O、C、N等元素,以上结果表明成功制备了CuFe PBA。
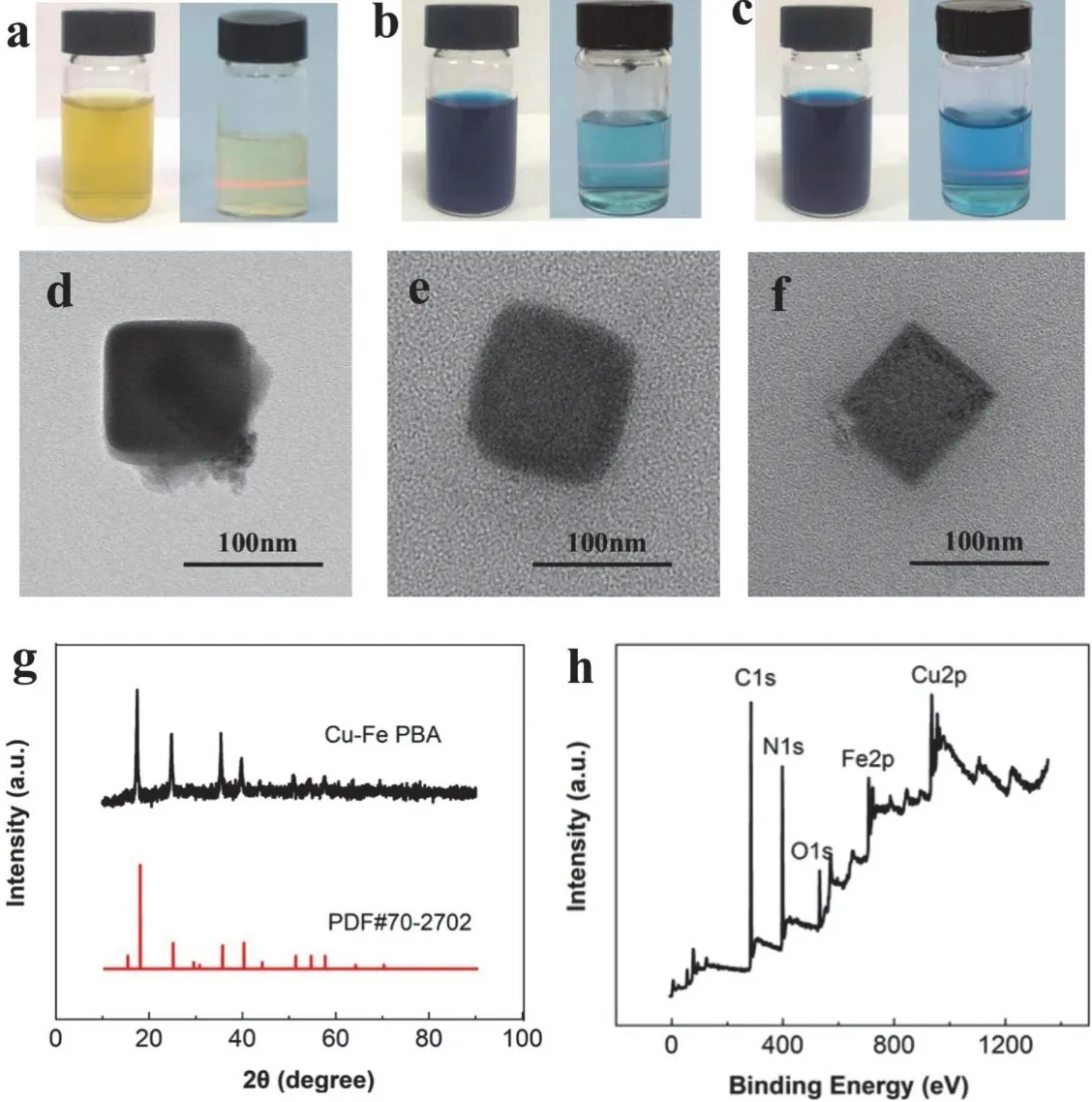
图1 CuFe PBA及PB的表征图
为了探究三种材料催化H2O2氧化TMB的可行性,我们分别采用(A组) CuFe PBA、(B组) PB-柠檬酸、(C组) PB-水作为催化剂,在不同体系中孵育5 min后,测定混合溶液的吸收曲线,检测结果如图2所示,三种材料都能够催化H2O2氧化TMB (图2a-c红色曲线),CuFe PBA本身催化H2O2氧化TMB的信号较小(图2a红色曲线),但是在溶液中加入0.1 mol·L-1NaCl后,可以使催化反应大大加速(图2a绿色曲线),这主要是源于Cl-可以加速铜基芬顿反应[9](CuFe PBA中具有CuII)。而对于其他两种PB,Cl-的存在并不能使催化反应加速。此外,从图2b、c中蓝色曲线可以看出PB-水和PB-柠檬酸都具有一定的氧化酶活性(在没有H2O2的存在下,PB也能氧化TMB产生A652nm信号),而CuFe PBA氧化TMB所产生的信号较小(图2a蓝色曲线)。以上数据证明三种材料都具有模拟酶性质,而由于合成材料时加入的配体及前体不同,所以三种酶的模拟酶性质也有所不同。
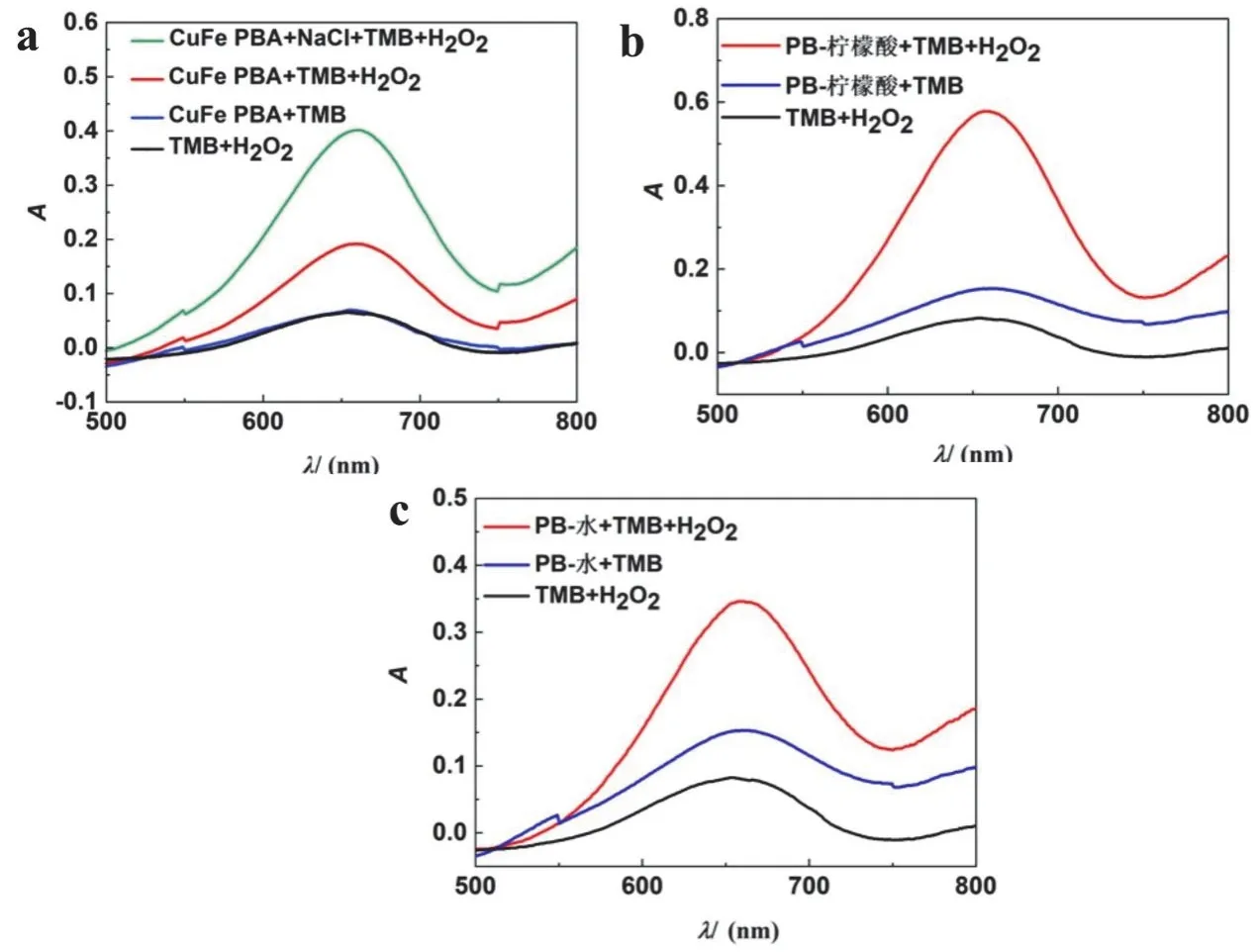
图2 三种材料催化H2O2氧化TMB的可行性分析
3.2 酶催化反应动力学性质
为了探究配体及组成对纳米酶催化性质的影响,我们测定了这三种材料催化H2O2的动力学曲线。如图3所示,向三种材料中加入TMB及不同浓度H2O2以后,混合液A652nm都会随着反应时间的延长而增大。由于PB-柠檬酸及PB-水具有一定的氧化酶性质,所以没有H2O2的空白组其A652nm也会随时间延长而加大,但是H2O2的存在可以加速TMB的氧化反应,而且H2O2的浓度越大,模拟酶催化反应速度越快。因此可以利用检测液A652nm来实现对H2O2的检测。比较三种材料的催化反应动力学曲线(图3a、c、e),由于PB-柠檬酸及PB-水的氧化酶性质,导致背景信号较大,所以不利于低浓度H2O2的检测。
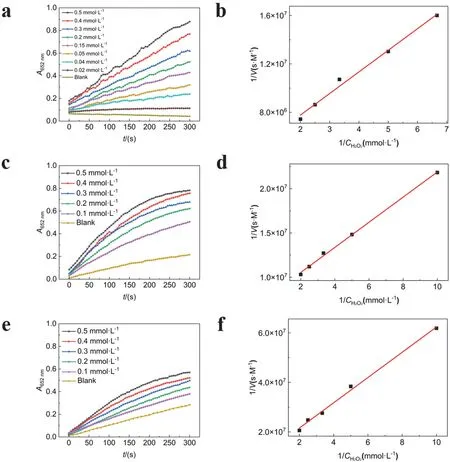
图3 三种材料催化H2O2氧化的动力学曲线(a、c、e)与双倒数曲线图(b、d、f)
我们以速率的倒数作为纵坐标,H2O2浓度的倒数作为横坐标,绘制了三种材料的双倒数曲线(图3b、d、f),利用Linewaerver-Burk双倒数方程求出Km和vmax。计算结果如表4所示,与辣根过氧化物酶(HRP)相比,三种模拟酶对H2O2的Km更小,表明这三种材料对H2O2具有更高的亲和力。其中PB-柠檬酸对H2O2的亲和力最高;CuFe PBA次之;PB-水对H2O2的亲和力最差,而CuFe PBA催化H2O2的vmax最大。由于采用柠檬酸作为介质合成PB及CuFe PBA可能会使材料具有独特的无限网络结构,可以增加材料的比表面积,使其具有更多的催化活性位点和更多的电子通道[10],故PB-柠檬酸和CuFe PBA的Km小于PB-水,而vmax大于PB-水。
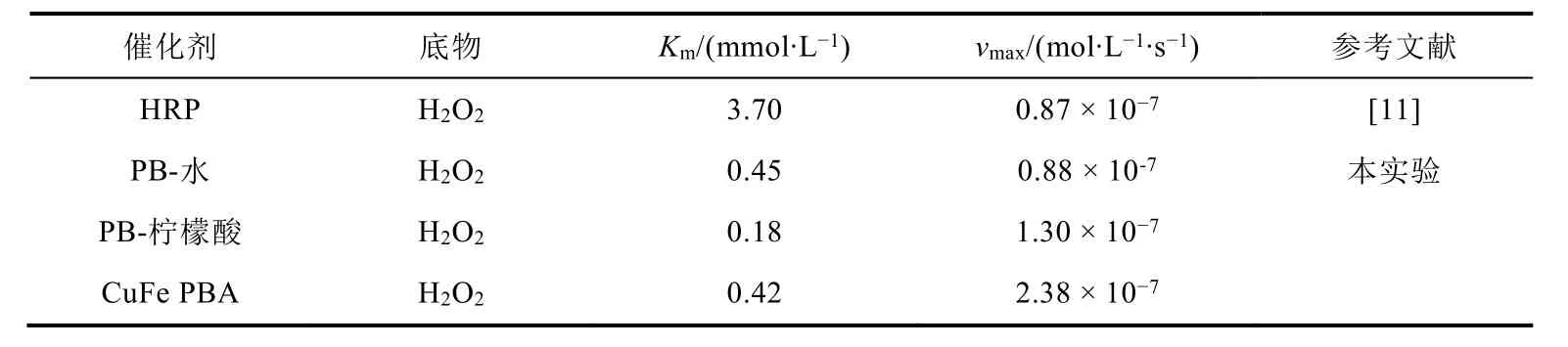
表4 HRP与PB-水、PB-柠檬酸、CuFe PBA动力学参数对比
3.3 检测H2O2
分别以三种纳米材料作为模拟酶对H2O2进行检测,以CuFe PBA为例,其对H2O2的检测结果如图4a所示,随着H2O2浓度的增加,溶液的颜色逐渐加深,因此利用溶液的颜色可以实现对H2O2的半定量检测。以A652nm作为纵坐标,H2O2浓度作为横坐标作图,绘制标准曲线,结果如图4b所示,在0.01-0.1 mmol·L-1及0.1-0.5 mmol·L-1浓度范围内,A652nm与H2O2的浓度呈线性相关,其工作曲线方程和相关系数分别为y= 0.0178 + 5.536x(mmol·L-1)、R2= 0.9912和y= 0.2543 + 1.2561x(mmol·L-1)、R2= 0.9953,可能由于CuFe PBA对H2O2具有不同的催化位点,当H2O2浓度小于0.1 mmol·L-1时,CuFe PBA对其催化速率更快。采用CuFe PBA作为催化剂测定三个平行消毒水样品中H2O2含量,检测结果如表5所示,其相对误差为5.00%,测定结果较准确,三次测定结果的相对标准偏差为0.45%,加标回收率在97.50%-103.2%之间,满足仪器分析实验基本要求。

图4 采用CuFe PBA作为催化剂检测不同浓度H2O2的颜色变化图(a)及工作曲线图(b)

表5 采用CuFe PBA对消毒水中H2O2的检测结果
4 实验组织运行方式
本实验适用于已经学习了生物化学和仪器分析理论知识的学生,实验采用小班教学,每次面向6-12名同学进行授课,将每6名学生分为一大组,每个大组分为3个小组,2名同学为一小组,每个小组同学合成一种普鲁士蓝或者类普鲁士蓝纳米材料,并分别开展材料表征、动力学实验及H2O2的检测实验,实验结束后三组同学分别处理实验数据后将实验结果进行比较,探究纳米材料的配体及其组成对其模拟酶性质的影响。
本实验采用共沉淀法制备普鲁士蓝及类普鲁士蓝纳米材料,材料易于合成,实验试剂安全无毒,操作简单,反应条件温和,可重复性强。实验用时为8学时,分两个阶段进行。第一阶段为4学时,内容包括:教师引导学生进行文献调研,了解模拟酶、类普鲁士蓝及H2O2检测的相关知识,教师讲述实验要点后学生开展实验,包括:溶液的配制,普鲁士蓝及类普鲁士蓝纳米材料的制备,模拟酶催化性能探究。材料的表征为可选部分,根据实际情况选择性开展。第二阶段为4学时,内容包括:利用紫外-可见光谱仪测定酶催化反应动力学曲线,绘制检测H2O2的标准曲线,并进行实际样品的检测。实验结束以后,对实验数据进行处理,三组同学对实验数据进行比较、思考并查阅资料,三个小组的同学共同完成实验报告。
5 结语
本实验将科学研究中常用的纳米酶——普鲁士蓝及类普鲁士蓝引入化学实验教学中,通过比较这三种材料的模拟酶性质,探究纳米材料在合成中组成及配体的不同对其模拟酶催化性质的影响。本实验可以开拓学生视野,帮助学生了解模拟酶和酶催化反应,学习酶催化反应动力学的测定及米氏常数的计算,巩固紫外-可见分光光度法的原理及其应用,同时也感受到科研的魅力,培养学生分析问题、解决问题的能力。本实验材料合成简单、反应条件温和,所用试剂无毒、价廉,实验现象直观,时间分配合理,适合本科生分析化学实验教学。此外本实验还可以根据学生情况进行拓展,进一步应用于电分析化学、电催化、污水处理、生物分析等领域。
