恶性疟原虫和卵形疟原虫双重实时荧光PCR 检测方法研究
2023-11-01丁旭聂丹丹孙玉孙舒闫聪姜佳颖罗雁非
丁旭 聂丹丹 孙玉 孙舒 闫聪 姜佳颖 罗雁非*
(1.吉林国际旅行卫生保健中心 吉林长春 130062;2.长春海关技术中心;3.吉林省中医药科学研究院;4.长春市产品质量监督检验院)
0 引言
疟疾是经按蚊叮咬或输入带疟原虫者的血液而感染疟原虫所引起的虫媒传染病,严重危害着人类健康。 鉴于全球的疟疾疫情形势和我国输入性疟疾病例分布范围广,病例报告地、时间和数量不确定等特点,在很长的一段时间内,我国必须保持县级及以上医疗机构的疟疾检测能力。 但大多数地区常年无输入性疟疾病例,少数地区每年仅报告少量输入性病例或相隔若干年又突现输入性病例,仅少数地区常年有输入性病例报告[1-3],这对基层医疗机构疟疾检测试剂的储备和检测人员能力的维持均是一个不小的挑战。 虽然我国自2017 年连续6 年无本土病例爆发,但时有输入性病例发生[1-6]。 由于医疗条件的差异, 全球疟疾疫情形势仍然严峻,2021 年仍有2.47 亿例报告,死亡人数达到61.9 万例[6]。 目前,输入中国的疟原虫主要为恶性疟原虫(Plasmodium falciparum)、间日疟原虫(Plasmodium vivax)、卵形疟原虫(Plasmodium ovale) 和三日疟原虫(Plasmodium malariae)4 种, 常用的检测技术包括了显微镜镜检、免疫学RDT 试剂盒以及分子生物学检测[7]。
荧光定量PCR(qPCR)检测技术分为染料法qPCR和探针法qPCR[7-8]。 与探针法相比,染料法qPCR 经济实惠、引物特异性强,但敏感性不及探针法,某些情况下特异性不稳定。
1 材料与方法
1.1 材料
本研究采用4 种疟原虫(恶性疟原虫、间日疟原虫、卵形疟原虫和三日疟原虫),其阳性质粒信息见表1。

表1 4 种疟原虫的阳性质粒信息Table 1 Positive Plasmid Information of Four Plasmodium Species
其余阴性对照标准菌株共13 株,购自美国典型培养物保藏中心(ATCC)、长春海关技术中心保存菌株中心(JL),菌株信息见表2。
表2 试验用菌株列表Table 2 List of standard strains for test
本研究采用的恶性疟原虫[10]和卵形疟原虫的特异性引物探针见表3。 恶性疟原虫采用的是行业标准SN/T 4793—2017 中恶性疟原虫的引物探针,卵形疟原虫的引物探针是利用GenBank 中KF018656.1序列,通过Primer 3 软件设计得到的。

表3 实时荧光PCR 引物探针序列Table 3 Primer probe sequences of real-time
1.2 试剂
TIANamp Genomic DNA Kit 血液/细胞/组织基因组DNA 提取试剂盒(批号:#S7628,天根生化科技(北京)有限公司);实时荧光PCR 2 倍预混液(批号:00699230,美国ABi 公司)。
1.3 仪器
Milli-Q-Integral 5 型纯水/超纯水系统(美国密理博公司);7A0-0052 型核酸蛋白检测仪(日本日立公司);E-centrlfuge 型离心机 (美国威泰克公司);SLM-140AY65 型制冰机(日本三洋公司);QuantStudio7 荧光定量PCR 仪(美国ABI 公司)。
1.4 样品DNA 的提取
根据DNA 提取试剂盒的要求,对疟原虫血液样品进行核酸提取。
1.5 双重实时荧光PCR 和双重微滴数字PCR 反应体系
反应体系和扩增参数:模板DNA 1 μL,恶性疟上、下游引物各0.5 μL,探针各0.5 μL,卵形疟上、下游引物各1 μL,探针各1 μL,2×实时荧光PCR 预混液10 μL,ddH2O 4.5 μL,总体积20 μL(见表4)。

表4 双重PCR 反应体系Table 4 Dual PCR reaction system
实时荧光PCR 循环参数:50℃预变性2 min,94℃预变性10 min;95℃变性15 s,60℃退火60 s,循环40 次。
2 结果与分析
2.1 37 份样品中4 种疟原虫的实时荧光PCR 实验结果
根据SN/T 4793—2017 的要求, 本实验设置空白对照(包括空白对照和提取空白对照)、阴性对照和阳性对照。 对4 种疟原虫进行实时荧光PCR 扩增,见图1~图4。
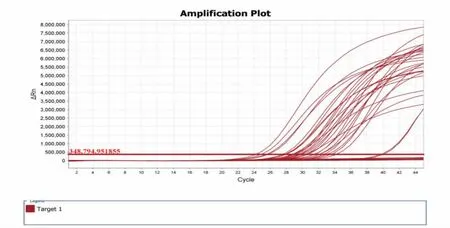
图1 37 个样品中恶性疟原虫实时荧光PCR 检测结果Fig.1 Detection results of Plasmodium falciparum in 37 samples by double real time PCR
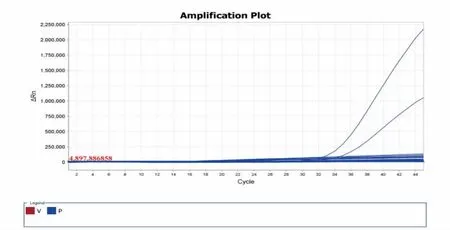
图2 37 个样品中卵形疟原虫实时荧光PCR 检测结果Fig.2 Detection results of Plasmodium ovale in 37 samples by double real time PCR
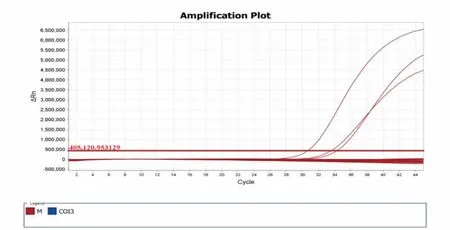
图3 37 个样品中三日疟原虫实时荧光PCR 检测结果Fig.3 Detection results of Plasmodium malariae in 37 samples by double real time PCR
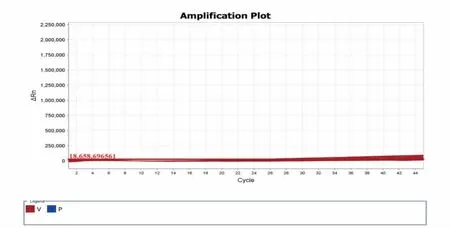
图4 37 个样品中间日疟原虫实时荧光PCR 检测结果Fig.4 Detection results of Plasmodium vivax in 37 samples by double real time PCR
结果表明,37 份样品中, 恶性疟原虫占32 份、卵形疟原虫占2 份、三日疟原虫占3 份、无间日疟原虫样品。
2.2 双重实时荧光PCR 实验结果
2.2.1 引物探针的特异性验证
取19 种DNA(包括3 份恶性疟和卵形疟混合DNA、恶性疟、卵形疟、霍乱弧菌、副溶血弧菌、沙门氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、蜡样芽胞杆菌、阪崎肠杆菌、赫氏埃希氏菌、鸡白痢沙门菌、摩根摩根氏菌、产气荚膜梭菌、空肠弯曲菌、福氏志贺氏菌)进行实时荧光PCR 检测。结果显示,不含有恶性疟和卵形疟DNA 成分的样品中无扩增信号,只有含恶性疟和卵形疟的样品有扩增信号, 表明所设计的引物和探针基因具有良好的特异性(见图5)。
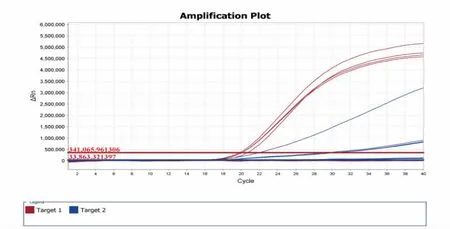
图5 恶性疟和卵形疟双重实时荧光PCR 特异性检测结果Fig.5 Specific detection results of dual real-time fluorescent PCR for Plasmodium falciparum and Plasmodium ovale
2.2.2 引物探针的灵敏性验证
以DNA 浓度为500 ng/μL 的恶性疟和卵形疟混合DNA 样品为原液,制成6 个连续梯度(DNA 浓度分别为500、50、5、0.5、0.05 ng/μL)的稀释液后,对恶性疟和卵形疟引物探针进行灵敏性实验, 结果见图6,标准曲线见图7。说明本方法可以在DNA 含量浓度较低的条件下有效鉴别恶性疟和卵形疟混合DNA。
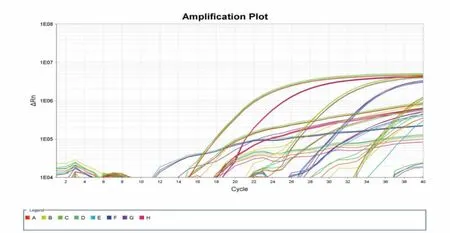
图6 恶性疟和卵形疟双重实时荧光PCR 灵敏性检测结果Fig.6 Sensitivity detection results of dual real-time fluorescent PCR for Plasmodium falciparum and Plasmodium ovale
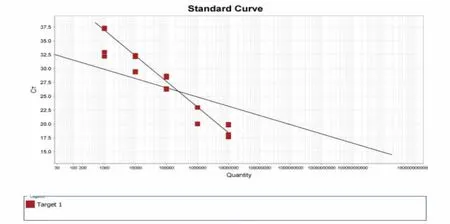
图7 恶性疟和卵形疟双重实时荧光PCR 标准曲线Fig.7 Dual real-time fluorescence PCR standard curve for Plasmodium falciparum and Plasmodium ovale
2.2.3 引物探针的灵敏性验证
经过30 次重复双重实时荧光PCR 检测,表明恶性疟和卵形疟引物探针具有良好的重复性(见图8),对恶性疟和卵形疟的DNA 扩增非常稳定,实验数据可信。
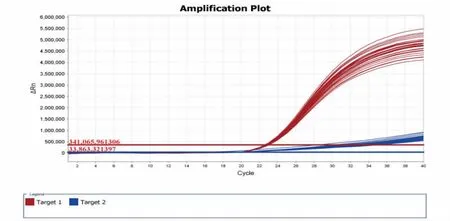
图8 恶性疟和卵形疟双重实时荧光PCR 重复性检测结果Fig.8 Repetitive detection results of dual real-time fluorescent PCR for Plasmodium falciparum and Plasmodium ovale
3 结论
对37 份疟原虫样品进行实时荧光PCR 鉴定人力物力消耗较大, 故本研究研发双重实时荧光PCR, 并成功建立了恶性疟和卵形疟双重实时荧光PCR 检测方法,且运用了SN/T 4793—2017 方法对恶性疟原虫进行验证,确保了实验数据的可靠性。
