拮抗水稻病原菌假单胞菌AH菌株的鉴定及全基因组序列分析
2023-11-01胡逸群沈文杰陈晴晴张爱芳
胡逸群,沈文杰,陈晴晴,张爱芳
安徽省农业科学院植物保护与农产品质量安全研究所,安徽合肥 230001)
为缓解农药过度施用与环境保护之间的矛盾,微生物来源的生防菌剂或制品有较好的开发前景。假单胞菌属、芽孢杆菌属和木霉属来源的微生物,对多种植物或动物病原菌具有良好的抑菌活性,因此被广泛用作生物防治剂[1-4]。假单胞菌属具有代谢多样性的特点,可产生多种次级代谢产物,如吩嗪类物质(phenazines)、硝吡咯菌素(pyrrolnitrin)、2,4-二乙酰基间苯三酚(2,4-diacetylphloroglucinol)、黄绿菌素(pyocyanin)和环脂肽(cyclic lipopeptides,CLPs)等。此外,假单胞菌属细菌也能通过诱导系统抗性的方式,抑制病原菌定殖或生长,对植物具有保护作用[5-8]。铜绿假单胞菌P.aeruginosaUPMP3菌株合成的吩嗪粗提物,可显著减轻狭长孢灵芝引起的油棕榈茎基底感染[9]。从苹果花上分离的P.orientalF9菌株表现出对火疫病菌的良好拮抗特性[10]。此外,大多数假单胞菌属菌株可作为植物根际促生菌,分泌生长调节剂来增强植物防御病原菌的能力。从印度青蒿根际分离的P.aeruginosa可以促进植物生长,且对植物病原菌链格孢、黄曲霉和尖孢镰刀菌表现出很好的生防活性[11]。
恶臭假单胞P.putida与近缘物种P.fluorescens和P.brassicacearum可作为生物防治剂和植物生长促进剂[12-13]。P.putida与其他有益微生物复合施用时,显著增加了水果营养元素的含量[14-15]。P.putidaB2017菌株通过产生铁载体pyoverdine来抑制植物病原菌[16]。在有益于植物的同时,生防菌也需要使自己免于如活性氧爆发之类的快速且强烈的植物防御反应所导致的损伤。P.putidaRRF3通过改变根部基因的转录表达来刺激植物产生防御反应,并通过改变根际的化合物组分来保护自身[17]。
一直以来,我国稻米主产区的真菌、细菌病害频发,稻瘟病菌可在水稻营养生长期侵染叶片导致叶瘟,在生殖生长期侵染稻穗导致穗颈瘟,严重降低稻米产量和品质[18]。镰孢菌Fusarium的复合侵染,如藤仓镰孢菌F.fujikuroi、层出镰孢菌F.proliferatum、拟轮枝镰孢菌F.verticillioides等,会降低种子发芽率,或引起水稻恶苗病[19]。此外,黄单胞菌Xanthomonas是一类重要的植物病原细菌,可侵染400多种植物,包括稻、棉、豆等粮食作物和柑橘、香蕉和木薯等经济作物[20]。其中,X.oryzaepv.oryzae和X.oryzaepv.oryzicola是稻黄单胞的2个致病变种,分别引起水稻白叶枯病和细菌性条斑病,危害严重[21-22]。面对防病增产与生态保护之间日益突出的矛盾,广谱抑菌菌株的开发利用是减少化学制剂使用、降低环境污染的有效策略。
叶际微生物的生境更为复杂多变,具备良好的环境适应性和多种生防机制。基于此,笔者通过分离水稻叶片微生物、平板对峙筛选拮抗菌株、多基因测序和系统发育分析鉴定得到一株具有良好抗菌活性的恶臭假单胞P.putidaAH菌株,田间试验明确其对水稻白叶枯病和稻瘟病具有防治效果。利用第二代Illumina与第三代PacBio结合的方法进行全基因组测序,并对测序数据进行基因组组装、基因预测与功能注释、次级代谢产物合成基因簇分析,为AH菌株的基因功能研究提供分子遗传信息。恶臭假单胞P.putidaAH菌株的研究可为水稻病害防控提供科学依据。
1 材料与方法
1.1 供试菌株和培养条件稻瘟病菌Magnaportheoryzae、纹枯病菌Rhizoctoniasolani、茎点霉菌Phomasp.、水稻白叶枯病菌Xanthomonasoryzaepv.oryzae、尖孢镰孢菌Fusariumoxysporum、层出镰孢菌F.proliferum、短小杆菌Curtobacteriumsp.,均保存于笔者所在实验室。细菌培养用LB培养基,白叶枯病菌培养用NA培养基,培养条件为28 ℃,保存介质为50%甘油。真菌培养用PDA培养基,培养条件为28 ℃,无菌滤纸对菌丝块进行低温保存。
1.2 稻瘟拮抗细菌的分离和筛选为从水稻叶际分离稻瘟病菌的拮抗细菌,用无菌剪刀将水稻叶片组织切成小块,在无菌水中浸泡30 min,6 000 r/min 离心3 min获得上清液。将悬浮液进行梯度稀释(10-2、10-3、10-4、10-5),取不同浓度的稀释液50 μL涂布于3个LB板上,平板于28 ℃培养2 d。挑取形态差异的单菌落进一步纯化保存,用于拮抗菌的筛选。稻瘟病菌孢子液稀释至2×107个/mL,涂布PDA平板后,28 ℃培养3 d。取2 μL上述细菌菌液滴于上述平板,28 ℃培养3 d,周围有抑菌圈的细菌即为目的菌,纯化并保存。
1.3 拮抗细菌的形态观察取20 μL新鲜菌悬液滴到碳膜铜网,静置5 min后用滤纸吸去多余液体。将2%磷钨酸滴在碳膜铜网,静置染色2 min后用滤纸吸去多余液体,室温干燥。在透射电子显微镜下观察细菌形态,采集图像分析。
1.4 细菌分类鉴定利用细菌基因组DNA提取试剂盒提取基因组DNA。使用细菌通用引物[23]扩增16S rDNA基因(27F,5′-AGAGTTTGATCATGGCTCAG-3′;1492R,5′-ACGGTTACCTTGTTACGACTT-3′)。使用特异性引物扩增gyrB序列(F,5′-GAGCAGACCTACGTCCACGGTGTG-3′;R,5′-GTCGATCATCTTGCCAACGACCGC-3′)。PCR扩增产物经过纯化后送生工生物技术公司进行测序。测序结果与BLAST(https://www.ncbi.nlm.nih.gov/)中核酸数据进行比对,选择同源性较高的近缘物种序列,利用MEGAX软件使用邻接法构建系统发育树。
1.5 平板对峙试验5种植物病原菌(M.oryzae,R.solani,F.oxysporum,F.proliferatum,X.oryzaepv.oryzae)和2种附生菌(Phomasp.,Curtobacteriumsp.)作为拮抗测试的靶标菌。将上述分离得到的拮抗细菌在液体LB中培养至生长对数期(OD600 nm=1.0),用于平板对峙试验。拮抗真菌试验:将新鲜菌丝块放置在PDA平板中央,将2 μL拮抗细菌菌悬液滴在平板边缘。平板于28 °C培养箱培养3~7 d,拍照并记录数据。拮抗细菌试验:将靶标菌的菌悬液(OD600 nm=1.0)稀释100倍,涂布于LB平板,28 °C培养1 d后再将2 μL拮抗细菌的菌悬液滴在上述平板边缘。平板放置在28 °C培养箱培养3 d,拍照并记录数据。
1.6 田间防治试验籼稻常规稻品种WH26作为参试材料,评价拮抗细菌对水稻3种病害(稻瘟病、水稻白叶枯病、细菌性条斑病)的田间防治效果。1月龄的水稻苗用于接种病原菌。病原菌接种前1和3 d,分别用拮抗菌的菌悬液(OD600 nm=0.5)均匀喷施水稻幼苗,以叶片布满微液滴为限。水稻白叶枯病菌接种:用无菌剪刀沾取X.oryzaepv.oryzae的菌悬液(OD600 nm=0.5),在距离叶尖边缘约2 cm处剪下叶片。选取10株水稻,每株取3片叶片进行接种处理。接种14 d后进行病斑长度测量。水稻细菌性条斑病菌接种:用无针头的1 mL注射器将X.oryzaepv.oryzicola菌悬液(OD600 nm=0.5)注入水稻叶片的细胞间隙,注意避免对植物造成另外的机械损伤。选取10株水稻,每株取3片叶片进行接种处理。接种7 d后进行病斑长度测量。稻瘟病菌接种:将M.oryzae孢子悬液浓度调整为2×105个/mL,均匀喷施于水稻叶片,以叶片布满微液滴为限,接种7 d后观察统计发病情况。
1.7 抗生素敏感性试验采用平板加药法测试拮抗细菌对庆大霉素(Gm)、卡那霉素(Kn)、氨苄霉素(Amp)和利福平(Rif)的敏感性。固体LB培养基中分别加入上述抗生素,配制终浓度分别为20.0、10.0、5.0、2.5 μg/mL的抗生素平板。将拮抗菌的菌悬液(OD600 nm=1.0)稀释100倍,均匀涂布于上述平板,28 ℃培养1 d,拍照并计数菌落。
1.8 细菌全基因组测序第二代Illumina与第三代PacBio结合的测序方法进行全基因组测序。离心收集新鲜的AH菌体,试剂盒法提取基因组DNA(Genomic DNA Isolation Kit,TaKaRa)。使用G-tubes(Covaris)剪切基因组DNA,EXO VII处理DNA并进行DNA末端修复,制备SMRTbell DNA文库。基因组的从头组装基于三代数据,使用falcon进行原始数据的自我矫正及基因组初步组装,得到一致性序列。使用GenomicConsensus软件对原始数据再次矫正,使用sprai对一致性序列进行环化处理,得到环化的细菌基因组[24],Circos软件构建基因组圈图[25]。使用Prodigal软件预测编码基因[26],Rfam预测非编码RNA[27]。
2 结果与分析
2.1 生防细菌的分离通过稻瘟孢子液平板的筛选方法,分离得到5株具有抑菌作用的细菌菌株,其中抑菌作用最显著的一株命名为AH,对其进行后续研究。在PDA培养基上培养2 d后,AH菌落形态为黄白色,表面粗糙,边缘凹陷(图1A、B)。在LB培养基上,AH菌落形态与PDA培养基相似,菌体更为致密(图1C、D)。透射电镜观察到AH呈短杆菌(图1E、F)。

注:使用平板划线法(A,C)和菌液悬滴法(B,D),分别在PDA培养基(A,B)和LB培养基(C,D)培养菌株AH。透射电镜观察菌体形态(E:5.0 μm;F:500 nm)。Note: Strain AH was cultured on PDA medium (A,B) and LB medium (C,D) by streak plate method (A,C) and dropping plate of liquid bacterial culture (B,D),respectively.P.putida AH strain was observed by transmission electron microscope (TEM),which was treated with 2% phosphotungstic acid on the copper grid to stain for 2 min on 5.0 μm (E) and 500 nm (F) scale.图1 菌株AH的形态学特征Fig.1 The morphological features of strain AH
2.2 生防细菌的鉴定AH的16S rDNA基因序列长度为1 405 bp,BLAST比对结果显示该序列与P.putida、P.wayambapalatensis、P.muyukensis、P.monteilii、P.plecoglossicida、P.shirazica和P.asiatica等菌株高度相似,相似度均高于99.87%,需进一步确定种属。利用特异性引物扩增得到gyrB基因序列,长度为708 bp,BLAST比对结果显示该序列与P.putidaNX-1、P.putidaPC2同源性为97.74%,与P.wayambapalatensisRW3S1相似度为96.15%,与P.muyukensisCOW39相似度为93.04%,与P.monteilii各菌株相似度均为92%。利用MEGAX软件构建系统发育树,表明AH属于恶臭假单胞菌P.putida(图2)。

图2 菌株AH基于gyrB基因的系统发育树Fig.2 Phylogenetic tree based on the nucleotide sequences of the complete gyrB gene
2.3 菌株AH的生防潜力菌株AH对参试的7种菌株均表现拮抗活性,其中对稻瘟病菌、水稻白叶枯病菌、短小杆菌和茎点霉抑制作用显著,抑菌圈直径均大于1.3 cm(图3A、B、F、G,图4)。对于水稻纹枯病菌、尖孢镰孢菌和层出镰孢菌的抑菌圈直径小于1.0 cm(图3C、D、E,图4)。

注:平板拮抗测试AH对稻瘟病菌(A)、茎点霉(B)、纹枯病菌(C)、尖孢镰孢菌(D)、层出镰孢菌(E)、短小杆菌(F)、水稻白叶枯病菌(G)的抑菌活性。H.平板模式图。Note: Tested pathogens included Magnaporthe oryzae (A),Phoma sp.(B),Rhizoctonia solani (C),Fusarium oxysporum (D),F.proliferatum (E),Curtobacterium sp.(F),and Xanthomonas oryzae pv.oryzae (G).Experimental model diagram(H).图3 菌株AH对参试菌株的平板拮抗测试Fig.3 Antagonistic efficacy of P.putida AH against tested strains

图4 菌株AH的平板抑菌效果Fig.4 Antagonistic efficacy of P.putida AH against tested strains
田间防治试验中,水稻叶片喷施AH菌悬液不影响水稻生长(图5A)。仅接种稻瘟孢子液时,叶片出现急性型病斑、慢性型病斑、褐点和白点型病斑的混合症状(图5B、C);接种前用AH菌悬液处理后症状显著减轻。水稻白叶枯病菌接种后,叶片呈现黄白色皱缩症状,沿叶脉扩展。AH喷施后症状显著减轻。且AH处理组的叶片皱缩现象比白叶枯病菌接种组的症状延迟3 d出现。水稻细菌性条斑病菌接种后,接种部位叶片出现黄褐色的短病斑,AH菌液处理对病害进程无明显影响(图5)。说明田间喷施菌株AH悬液可有效减轻水稻白叶枯病和稻瘟病的病害等级。
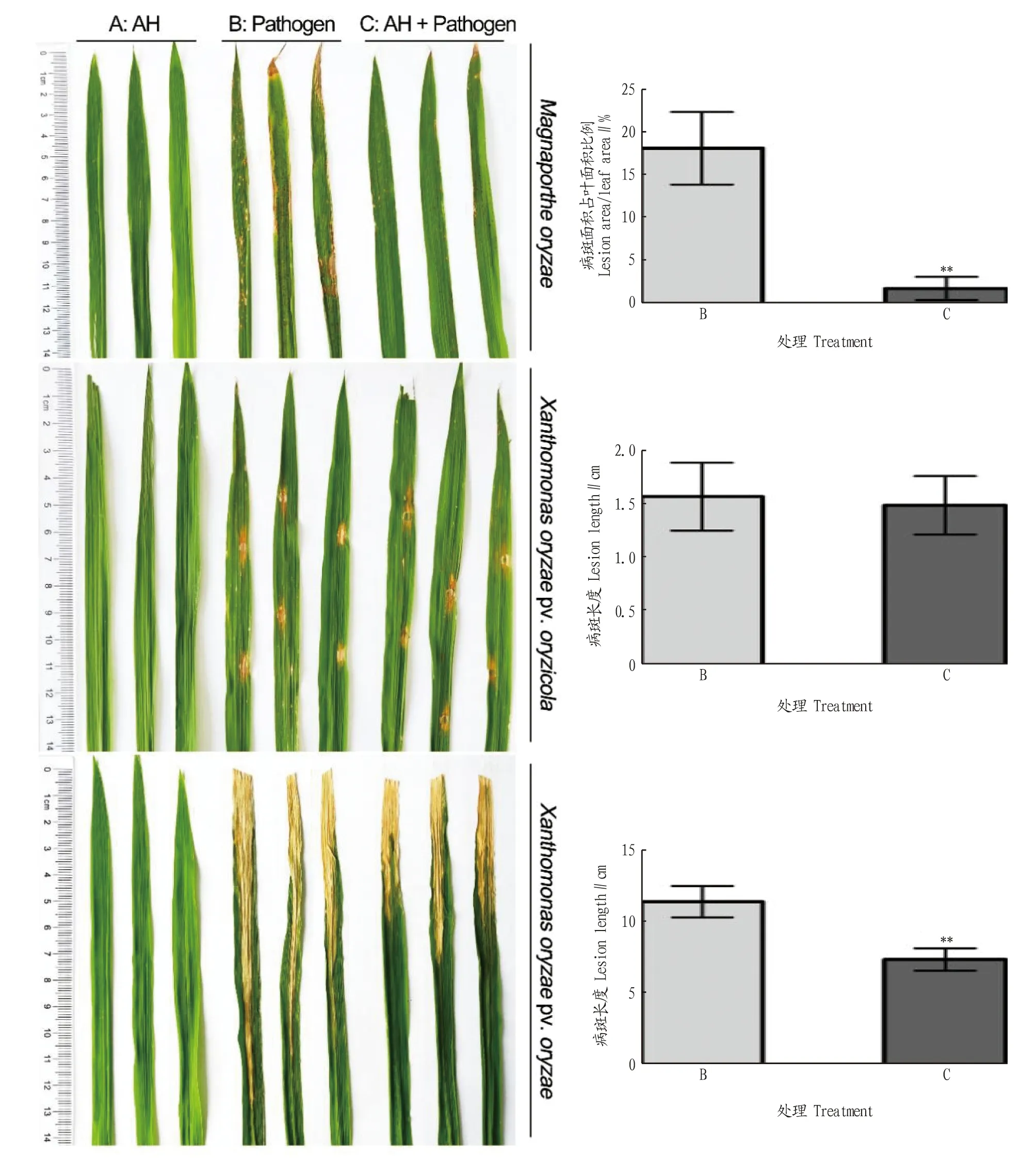
注:稻瘟病菌(上),水稻细菌性条斑病菌(中)和白叶枯病菌(下)在感病水稻品种WH26上的发病情况。Note:The severities of rice blast (upper),bacterial leaf streak (middle),and bacterial blight (lower) in the susceptible rice variety WH26 were exhibited.图5 菌株AH对水稻病害的防治效果Fig.5 The biocontrol effect against three major pathogens on rice plants
2.4 菌株AH基因组分析采用二代Illumina与第三代PacBio结合的测序技术对菌株AH进行全基因组测序,获得高质量Reads 102 114条,数据量1.27 G。AH基因组长为5 889 125 bp,GC含量为63.74%,包含5 215个编码序列,其中包括19个rRNA、77个tRNA和78个nRNA。基于GC偏差、GC含量、非编码RNA(rRNA为红色表示,tRNA为蓝色表示,sRNA为绿色表示)和COG注释等信息,使用Circos软件构建的基因组圈图见图6。全基因组测序数据已提交至GenBank,收录号为SAMN34209943。利用NR数据库进行蛋白质序列相似性比对显示,共有5 183个基因被注释,占基因总数的99.4%;在KEGG数据库中比对得到5 150个基因,占比98.8%;在COG、Swiss-Prot和GO数据库中分别比对得到4 164、3 858、3 715个基因,占比分别为79.8%、74.0%和71.2%。

注:Circos(v0.69)软件绘制菌株AH的基因组圈图,从内到外分别代表GC 偏移、GC含量、非编码RNA(红色是rRNA,蓝色是tRNA,绿色是sRNA)、前导链的COG注释和后随链的COG注释。Note:The map was drawn using Circos (v0.69).From the center to the periphery,different components represent GC skew,GC content,non-coding RNA (rRNA,red;tRNA,blue;sRNA,green),COG annotation of the leading strand,and COG annotation of the lagging strand.图6 菌株AH的基因组圈图Fig.6 Graphical circular map of the genome of P.putida AH
对菌株AH基因组数据进行KEGG和GO数据库分析,结果见图7。KEGG注释结果表明,菌株AH基因组中有2 810 个编码蛋白的基因富集到六大类42条代谢通路中。其中,代谢功能相关的基因占比最大,其中氨基酸代谢、碳水化合物代谢、辅酶因子和维生素代谢、能量代谢相关通路的数量较高。表明菌株AH具有代谢多样性的特征。GO数据库按照生物过程、细胞组分和分子功能三类对菌株AH基因功能进行分类,其中细胞组分中膜组分相关基因、分子功能中的ATP结合和金属离子结合相关基因占比较大。

注:A.KEGG注释结果;B.GO注释结果。Note:A.KEGG annotation results;B.GO annotation results.图7 菌株AH的基因功能分析Fig.7 Gene functions in the P.putida AH genome
2.5 次生代谢产物合成基因簇的预测使用antiSMASH在线平台对菌株AH基因组中次级代谢产物合成基因簇进行预测,分析表明该基因组包含8个次级代谢产物基因簇,其中5个是非核糖体肽合成酶(NRPS)基因簇或NRPS-like基因簇(图8、表2)。根据基因簇同源性,AH可能合成2类已知的抗菌物质viscosin和putisolvin。分析发现,Cluster1与BGC0001100来源的Streptomycesrochei的合成基因簇相似性为13%;Cluster2和Cluster5都与BGC0000413来源的PseudomonasprotegensPf-5的pyoverdin合成基因簇相似,相似度分别为10%和4%;Cluster3与BGC0001312来源的PseudomonasfluorescensSBW25的viscosin合成基因簇相似度为50%。Cluster4与Pseudomonasputida的putisolvin合成基因簇相似性为50%;Cluster5与BGC0000413来源的PseudomonasprotegensPf-5的pyoverdin合成基因簇相似性为4%;Cluster8与BGC0001692来源的XenorhabdusnematophilaATCC 19061的nematophin合成基因簇相似性为12%。另外Cluster6和Cluster7未比对到相似基因簇,暗示菌株AH中可能存在新物质合成基因簇,具有研究和应用潜力。

表2 菌株AH的8个次级代谢产物合成基因簇信息

注:AntiSMASH在线平台预测菌株AH的次级代谢产物合成相关基因簇,8个基因簇的信息如图。不同颜色代表不同类型的基因。Note:Secondary metabolite associated gene clusters were predicted by antiSMASH online platform.Eight gene clusters were respectively concatenated on P.putida AH genome according to the order and length.Different colors represent different types of genes as shown.图8 菌株AH的8个次级代谢产物合成基因簇Fig.8 Secondary metabolism gene clusters in P.putida AH
2.6 菌株AH对氨基糖苷类抗生素高度敏感采用平板加药法对菌株AH的抗生素敏感性进行测定发现,外源卡那霉素或庆大霉素浓度为2.5 μg/mL的条件下,菌株AH生长出现明显抑制现象;利福平浓度为10 μg/mL时,AH生长被抑制,20 μg/mL时抑制作用明显;在所有测试浓度下,氨苄霉素均未对AH生长产生影响(图9)。这表明AH菌株对氨基糖苷类抗生素(庆大霉素和卡那霉素)高度敏感,且抑菌作用存在剂量依赖性。

图9 菌株AH的抗生素敏感性测试Fig.9 Antibiotic susceptibility of P.putida AH
3 结论与讨论
该研究通过平板抑菌测试,筛选得到5株具有生防效果的菌株,其中菌株AH效果最好,经多基因测序比对,鉴定为恶臭假单胞P.putidaAH。进一步测试发现AH对植物病原细菌水稻白叶枯菌和病原真菌稻瘟病菌、纹枯病菌都有较好的抑菌活性,其抑菌谱具有一定的广谱性,具有研究价值。
在线平台antiSMASH预测发现P.putidaAH中有8个次级代谢产物合成基因簇,可能合成viscosin、putisolvin等抗菌物质。putisolvin对多种病原菌具有拮抗活性,一般通过破坏细胞膜和抑制DNA合成的机制发挥抗菌作用,也能作为生物表面活性剂影响细菌群体感应与生物膜形成[28]。但AH菌株的合成基因簇与已知基因簇比对的相似度来看,均未超过50%,仅有Cluster3与P.fluorescensSBW25的viscosin合成基因簇相似度为50%,Cluster4与P.putida的putisolvin合成基因簇相似性为50%。Cluster6和Cluster7未比对到相似基因簇,另外的Cluster1、2、5、8基因簇与已知菌株基因簇的相似度为13%、10%、4%、12%。此外,经过比对发现胺甲萘降解菌株P.putidaSimmons01、P.putidaNBRC14164菌株有6个次级代谢产物合成基因簇,耐低碳氧菌株P.putidaKT2440有7个合成基因簇[29]。这些结果暗示菌株AH的8个基因簇除合成上述已知物质,还可能合成其余未报道的物质,具有代谢多样性的特征,有较好的研究和应用潜力。
菌株AH的抗生素敏感性测试结果表明其对氨苄霉素的耐药性很强,而分析AH菌株的基因组数据发现,其中并不含有编码氨苄霉素抗性的基因,但鉴定得到多个resistance-nodulation against tested strainscell division(RND)类型的抗生素外排泵基因,这表明菌株AH可能是通过外排泵系统来阻止氨苄霉素的外源施加对细菌造成的损伤。除RND类外排泵外,AH基因组中还鉴定到small multidrug resistance(SMR)类的外排泵,靶向氨基糖苷类抗生素。而抗生素敏感性测试表明菌株AH对氨基糖苷类抗生素高度敏感,推测可能是由于相关基因表达水平较低或发生沉默而无法发挥蛋白正常功能,导致菌株AH不足以防御氨基糖苷类抗生素。菌株AH的全基因组数据为后续分子操纵提供了遗传信息,也为深层的防病机制解析提供了基础。
