快速溶剂萃取-固相萃取-超高效液相色谱串联质谱法测定土壤中19 种抗生素残留
2023-10-31戴轩宇蔡沐涵
戴轩宇, 蔡沐涵
(1.江苏省南通环境监测中心,江苏 南通 226006;2.江苏省南通中学, 江苏 南通 226006)
0 引言
抗生素作为治疗药物和预防感染药物在畜牧、水产业中被广泛应用, 而动物体内抗生素通过代谢等形式随粪便和尿液等排出体外,并最终通过堆肥、粪便还田等形式进入土壤等环境介质中[1]。 由于当前在畜牧、 水产行业中普遍存在过量使用抗生素的情况,故抗生素在土壤中累积不断增强,其通过食物链对农作物影响也不断扩大。因此,目前土壤中抗生素污染问题已成为国内、 外环境和土壤科学界共同关注的热点问题之一。 基于土壤中抗生素污染种类繁杂且多为痕量水平的特点,建立一种高灵敏度、覆盖面广的检测方法对研究土壤中抗生素污染具有重要意义。且土壤基质复杂,寻求一种高效的净化和富集方法, 是建立土壤中多种痕量抗生素检测方法的重点和难点[2]。
常用抗生素的检测方法主要包括酶联免疫法、微生物法、液相色谱法、液相色谱-质谱法、液相色谱-串联质谱法等[2-10]。 目前主流的检测方法为液相色谱-串联质谱法。该方法具有特异性强、敏感性高、检出限低等优点, 特别适合复杂基质中的痕量抗生素样品分析[3]。土壤中抗生素的净化富集方法主要包括串联固相萃取、震荡超声-固相萃取、SPE-高效毛细管电泳、QuEChERS 等[2-6]。 马丽丽等[2]采用SAXHLB 串联固相萃取法测定土壤中3 类18 种抗生素,检出限为0.07~8.9 μg/kg,加标回收率为55.8%~97.4%。胡钰等[3]采用震荡超声-固相萃取法测定土壤中7 类30 种抗生素,检出限为0.013~1.21μg/kg,加标回收率为44.8%~164%。 李兴华等[5]采用SPE-高效毛细管电泳法测定土壤中三大类13 种抗生素,检出限为1.33~3.33 μg/kg, 加标回收率为78.5%~107%。 孟明辉等[6]采用QuEChERS 法测定土壤中两大类20 种抗生素,检出限为2.0~5.0 μg/kg,加标回收率为61.4%~119%。 上述方法在低检出限、稳定的加标回收率、快速高效检测、多种类抗生素检测等方面各有优势,但难以全面兼顾。
研究选择先使用快速溶剂萃取仪进行萃取,再使用全自动固相萃取仪进行净化富集, 前处理方法快速高效,自动化程度高,适用类别广;通过UPLCMSMS 进行检测,方法特异性强、敏感性高、检出限低。 建立ASE-ASPE-UPLC-MSMS 检测方法可用于土壤中痕量水平的磺胺类、氟喹诺酮类、四环素类、大环内酯类等共19 种抗生素的同时测定。
1 试验方法
1.1 主要仪器、试剂与材料
主要仪器: 串联四极杆液质联用仪 (美国Waters,Xevo TQ-s-micro QEA0318)、全自动固相萃取仪(美国GL ASPE900)、 快速溶剂萃取仪(CEM,EDGE,EY2141)、 全自动定量浓缩仪(BUCHI,Syncore Plus)、冷冻干燥机(BUCHI,L-200)、超纯水机(美国Millipore,Milli-Q Inte A10)。
试剂与材料:①液体试剂:甲醇、乙腈(美国Merck,色谱纯),甲酸、磷酸(美国Honeywell,色谱纯);②固体试剂:无水硫酸钠、乙二胺四乙酸二钠、磷酸氢二钠十二水合化合物、 柠檬酸一水合化合物(德国Sigma,色谱纯),将27.219 g 磷酸氢二钠十二水化合物、33.621 g 乙二胺四乙酸二钠和13.029 g柠檬酸一水化合物溶解于1 000 mL 超纯水中,配制得到的Na2EDTA-Mcilvaine 缓冲液(pH 值为4);③耗材:C18 固相萃取小柱(Waters Sep-pak,500 mg 每6 mL),HLB 固相萃取小柱(Oasis,500 mg 每6 mL),HLB 固相萃取小柱(Oasis,150 mg 每6 mL),聚四氟乙烯滤膜(Waters,13 mm,0.22 μm)。
抗生素标准品:①磺胺类(SAs):甲醇中磺胺嘧啶(质量浓度为1 000 mg/L)、甲醇中磺胺甲嘧啶(质量浓度为1 000 mg/L)、甲醇中磺胺二甲嘧啶(质量浓度为1 000 mg/L)、甲醇中磺胺对甲氧嘧啶(质量浓度为1 000 μg/mL)、甲醇中磺胺间甲氧嘧啶(质量浓度为1 000 mg/L)、甲醇中磺胺氯哒嗪(质量浓度为1 000mg/L)、甲醇中甲氧苄啶(质量浓度为1000 mg/L);②氟喹诺酮类(FQs):甲醇中诺氟沙星(质量浓度为1 000 mg/L)、 甲醇中环丙沙星 (质量浓度为1 000 mg/L)、甲醇中恩诺沙星(质量浓度为1 000 mg/L)、甲醇中氧氟沙星(质量浓度为1 000 mg/L);③四环素类(TCs):甲醇中四环素(质量浓度为100 mg/L)、甲醇中金霉素(质量浓度为100 mg/L)、甲醇中土霉素(质量浓度为100 mg/L);④大环内酯类(MLs):脱水红霉素A(1 mg)、甲醇中克拉霉素(质量浓度为100 μg/mL)、甲醇中罗红霉素(质量浓度为100 mg/L)、甲醇中替米考星(质量浓度为1 000 mg/L)、甲醇中泰乐菌素(质量浓度为1 000 mg/L);⑤内标:甲醇中环丙沙星-d8(质量浓度为100 mg/L)、甲醇中磺胺甲恶唑-d4(质量浓度为100 mg/L)、甲醇中磺胺二甲基嘧啶-d4(质量浓度为100 mg/L)、甲醇中甲氧苄氨嘧啶-d3(质量浓度为100 mg/L)、甲醇中罗红霉素-d7(质量浓度为100 mg/L)。
1.2 配制标准溶液
以甲醇为溶剂,将19 种抗生素标准品配制成质量浓度为100 mg/L 的混合标准储备液于-18 ℃温度条件下储存。 使用前,以体积分数为10% 甲醇水溶液为溶剂, 将质量浓度为100 mg/L 的19 种抗生素混合标准储备液配置成质量浓度为1 mg/L 混合标准中间溶液, 将5 种抗生素内标标准品配置成质量浓度为1 mg/L 混合内标标准中间溶液,并逐级稀释成质量浓度分别为2,5,10,20,50,100,200 μg/L的系列混合标准溶液。
1.3 采集样品
依据土壤环境监测技术规范(HJ/T 166—2004)要求,选取长江下游地区农田表层土壤(深度为0~20 cm),采用单对角线五点法采集表层土壤样品,去除其中树枝、秸秆、石子、草根等异物后装入洁净的棕色玻璃瓶,于0~4 ℃温度下冷藏保存。
1.4 处理样品
先将土壤样品置于-18 ℃温度下冷冻一周后经冻干机进行干燥后研磨, 再准确称取研磨后5 g 土壤样品与10 g 无水硫酸钠均匀混合后置于60 mL Q-Cup 萃取罐中, 最后加入25 ng 抗生素内标混合物(环丙沙星-d8、磺胺甲恶唑-d4、磺胺二甲基嘧啶-d4、甲氧苄氨嘧啶-d3、罗红霉素-d7)。 选择萃取溶剂甲醇-Na2EDTA-Mcilvaine(体积分数为1 ∶1)缓冲液,萃取条件:溶剂体积为10 mL,温度为50 ℃,静置萃取2 min,润洗体积为10 mL,萃取2 次,收集全部萃取液至定量浓缩仪浓缩至1 mL,加水稀释至200 mL 后加入0.2 g Na2EDTA,再加入磷酸调节萃取液pH 值至2。
依次使用10 mL 甲醇、10 mL 超纯水及10 mL盐酸水溶液(pH 值为2)活化HLB 小柱,以2 mL/min速度将样品溶液上样至HLB 小柱。 上样完成后,以10 mL 超纯水淋洗小柱,弃去淋洗液,通氮气干燥30 min;再用10 mL 甲醇溶液分2 次分别以2 和1 mL/min速度洗脱, 洗脱液定量浓缩至近干, 用体积分数为10%甲醇-水溶液定容至1 mL,过0.22 μm 聚四氟乙烯滤膜后待UPLC-MSMS 上机分析。
1.5 分析条件
色谱柱: 沃特世ACQUITYBEH-C18 色谱柱(100 mm×2.1 mm,1.7 μm);柱温:40 ℃;流动相:A相体积分数为0.1%甲酸水溶液、B 相体积分数为0.1%甲酸甲醇溶液; 流速:0.4 mL/min。 梯度洗脱程序:0~2.5 min,10%B~15%B;2.5~5.0 min,15%~50%B;5.0 ~ 6.0 min,50% B ~ 90%B;6.0 ~ 7.5 min,90%B;7.5~8.0 min,90%B~10%B;8.0 ~ 10.0 min,10%B。
离子源:采用电喷雾离子源(ESI)质谱多反应监测模式(MRM)进行样品检测。
2 结果与讨论
2.1 优化分析条件
2.1.1 优化质谱条件
根据各抗生素分子结构特征,选用ESI+模式对19 种抗生素进行质谱分析。 对每种抗生素分别进行质谱条件优化和进行Full scan 全扫描、 子离子扫描和母离子扫描,参考化合物的基本信息,确定目标化合物的母离子和子离子对, 选择确定目标化合物的定量、定性离子对后,在MRM 模式下,对目标化合物进行锥孔电压、碰撞能量等质谱参数的优化。 经试验优化后确定的19 种抗生素的质谱分析参数见表1。
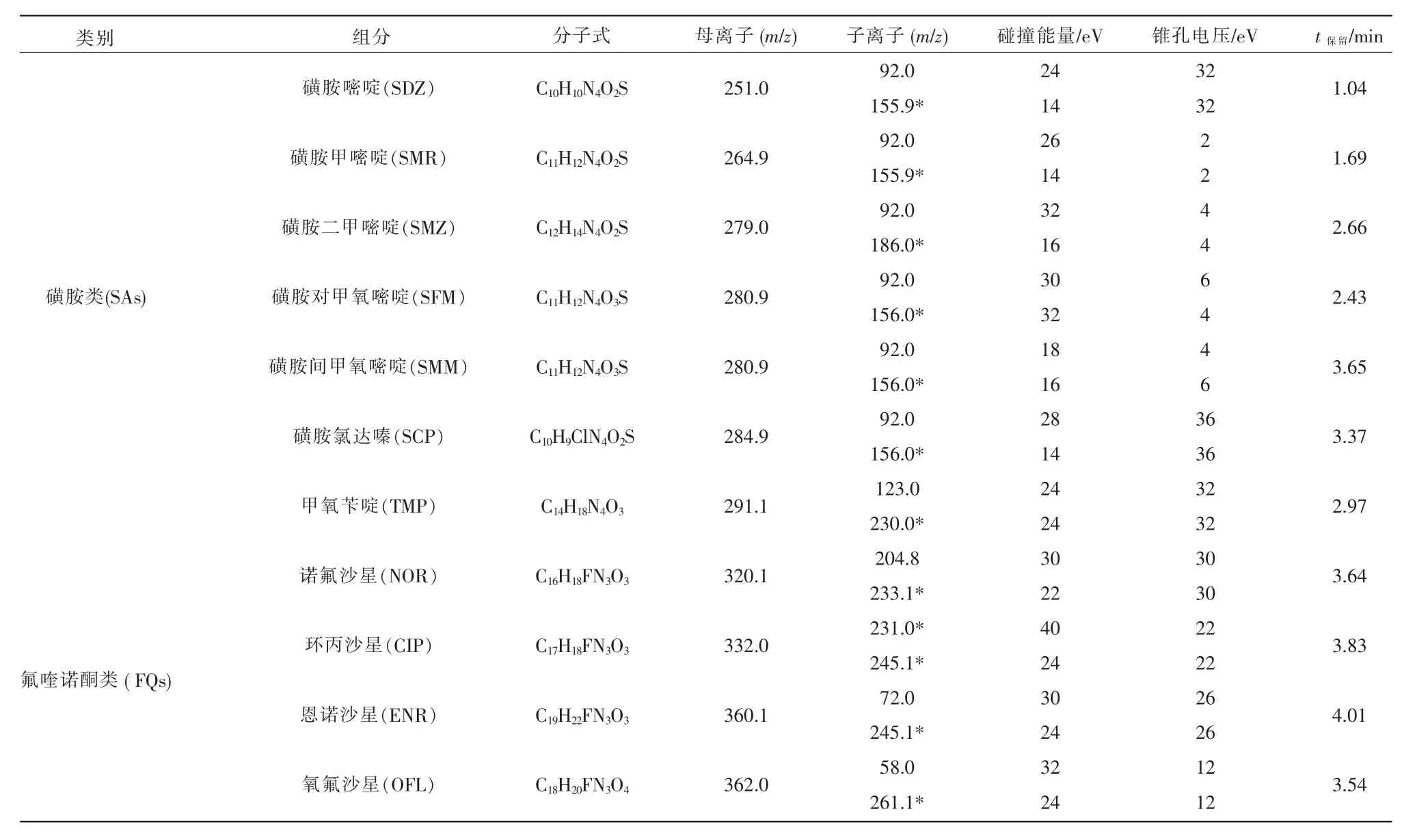
表1 19 种抗生素的质谱参数
2.1.2 优化色谱流动相
试验选择通用的C18 色谱柱。 选择的流动相A相-B 相组合分别为: 甲醇-水、 甲醇-(体积分数为0.1%)甲酸水溶液、(体积分数为0.1%)甲酸甲醇溶液-(体积分数为0.1%)甲酸水溶液等。 按照1.5 对色谱分离效果和响应情况进行比较分析。选择甲醇-水流动相组合时,部分目标化合物未出峰;选择(体积分数为0.1%)甲酸甲醇溶液-(体积分数为0.1%)甲酸水溶液流动相组合时, 各目标化合物的峰形均明显优于甲醇-(体积分数为0.1%)甲酸水溶液流动相组合。 故选取(体积分数为0.1%)甲酸甲醇溶液-(体积分数为0.1%)甲酸水溶液作为流动相组合。
2.2 优化介质浓度
19 种抗生素标准溶液的总离子流图像见图1。
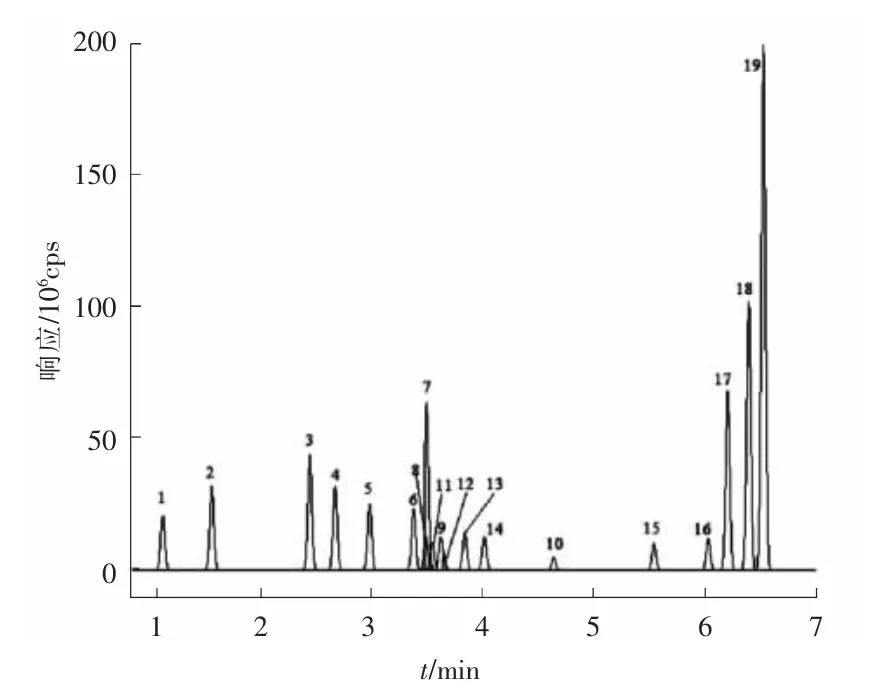
图1 19 种抗生素(质量浓度为50 μg·L-1)的总离子流
比较不同的有机相比例(体积分数分别为10%,20%,50%,100%甲醇水)下,质量浓度为50 μg/L 的混合标准溶液各目标化合物的出峰情况。 当有机相比例逐步降低时, 各目标化合物的峰形及响应值均有所改善,各目标化合物在进样介质为甲醇(体积分数为50%) 水溶液时, 响应值为2.14×106~8.63×107,在进样介质为甲醇(体积分数为10%)水溶液时,响应值为4.39×106~1.85×108。 因此选取体积分数为10%甲醇水溶液作为进样介质。
2.3 优化提取条件
选取饮用水源地周边某土壤样品检测, 该样品中各目标组分均未检出。样品经冻干研磨,添加抗生素混合标准中间溶液使得加标水平为20 μg/kg 后用于各项优化实验。
采用快速溶剂萃取方式对土壤样品中的抗生素进行提取,在不同温度(40,50,60,70 ℃)条件下,使用10 mL 不同组成的萃取剂(乙腈-水(体积分数为1 ∶1)、甲醇-水(体积分数为1 ∶1)、乙腈-Na2EDTAMcilvaine (体积分数为1 ∶1) 缓冲液、 甲醇-Na2EDTA-Mcilvaine(体积分数为1 ∶1)缓冲液),对目标化合物提取效果进行考察, 萃取温度对抗生素回收率的影响(n=3)和不同萃取剂对抗生素回收率的影响(n=3)分别见图2、图3。 由图2、图3 可以看出, 甲醇-Na2EDTA-Mcilvaine 缓冲液对磺胺类、四环素类、 大环内酯类抗生素均有很好的提取效果,而乙腈-Na2EDTA-Mcilvaine 缓冲液对氟喹诺酮类抗生素提取效果更好, 考虑到甲醇-Na2EDTAMcilvaine 缓冲液对氟喹诺酮类抗生素提取效果的影响不超过15%, 最终选取甲醇-Na2EDTAMcilvaine 缓冲液作为萃取剂。 萃取温度方面,当萃取温度为50 ℃时四环素类化合物均有较好的回收率; 当萃取温度分别为50,60 ℃时大环内酯类化合物均有较好的回收率, 但当萃取温度升高至70 ℃时,该类化合物回收率均明显下降;磺胺类及氟喹诺酮类化合物在所选温度条件下回收率均无明显差别;综合考虑选取50 ℃作为萃取温度。每次使用10 mL 萃取剂对土壤样品进行提取, 经2 次提取后,第3、第4 次的提取液中均未检测到目标化合物。因此,最终确定提取条件为使用甲醇-Na2EDTA-Mcilvaine(体积分数为1 ∶1)缓冲液在萃取温度为50℃下对土壤样品萃取2 次,每次使用10mL 萃取剂。
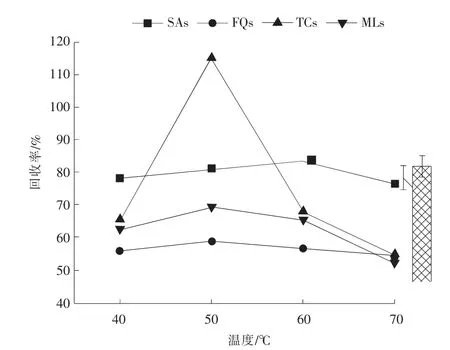
图2 萃取温度对抗生素回收率的影响(n=3)
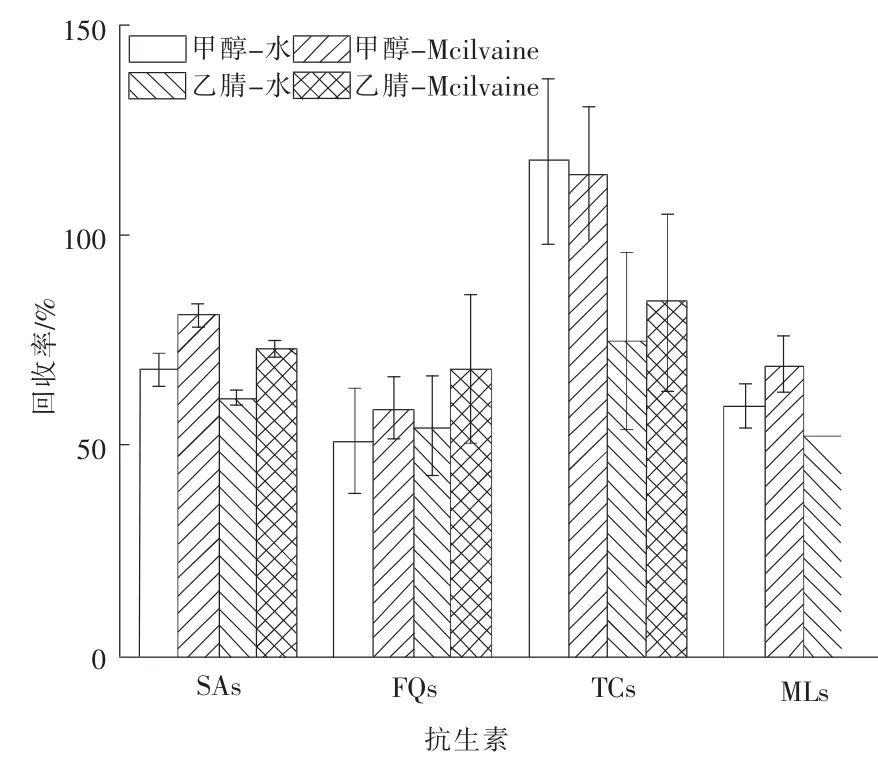
图3 不同萃取剂对抗生素回收率的影响(n=3)
2.4 优化净化条件
2.4.1 选择固相萃取柱
比较C18(500 mg 每6 mL),HLB(500 mg 每6 mL)和HLB(150 mg 每6 mL)3 种固相萃取柱对各类抗生素的萃取效果,具体见图4。
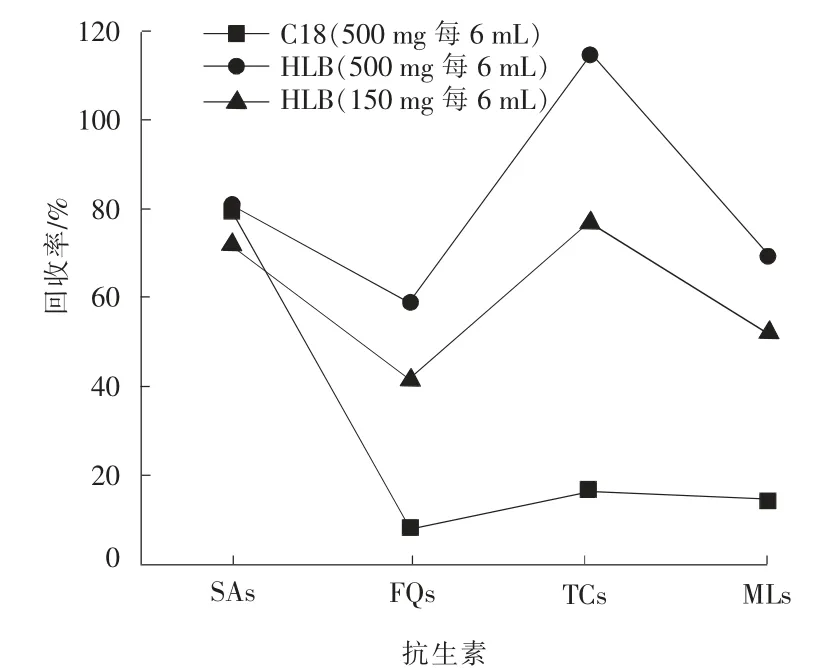
图4 不同固相萃取柱对抗生素回收率的影响(n=3)
由图4 可以看出,HLB 柱对极性和非极性化合物均有较好的吸附能力,而C18 柱对非极性化合物有较好的吸附能力,HLB 柱对大部分目标化合物的萃取效果优于C18 柱,均有更好的回收率。 而HLB(500 mg/6 mL)相较于HLB(150 mg/6 mL)固相萃取柱对目标化合物回收率更好。
2.4.2 选择萃取液pH 值
比较酸性到碱性的5 个pH 值 (pH 值分别为2,4,6,8,10)条件下对各类抗生素回收率的影响,具体见图5。
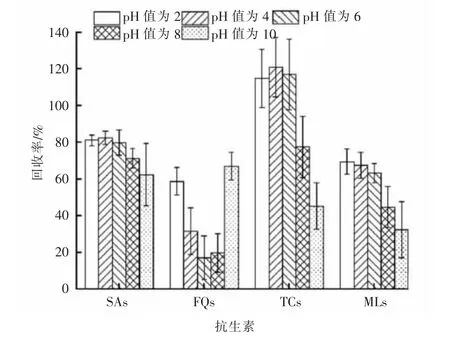
图5 pH 值对抗生素回收率的影响(n=3)
由图5 可以看出,萃取液在酸性(pH 值分别为2,4 和6)条件下,磺胺类、大环内酯类和四环素类抗生素的回收率较接近, 且均明显优于碱性条件下的回收率;萃取液pH 值分别为2 和10 时,氟喹诺酮类抗生素均有较好的回收率;因此,最终选择调节萃取液pH 值至2 后上样净化以获得较好的回收率。
2.4.3 选择洗脱液体积
在抗生素检测中常使用甲醇作为洗脱液。pH 值为2 时,比较5,8,10,12 mL 甲醇溶液对吸附在固相萃取柱上各类抗生素的洗脱效果,具体见图6。 由图6 可以看出, 各类抗生素的回收率随甲醇体积增加而升高,当甲醇体积至10 mL 后,抗生素的回收率不再变化。 最终确定甲醇洗脱液的体积为10 mL。
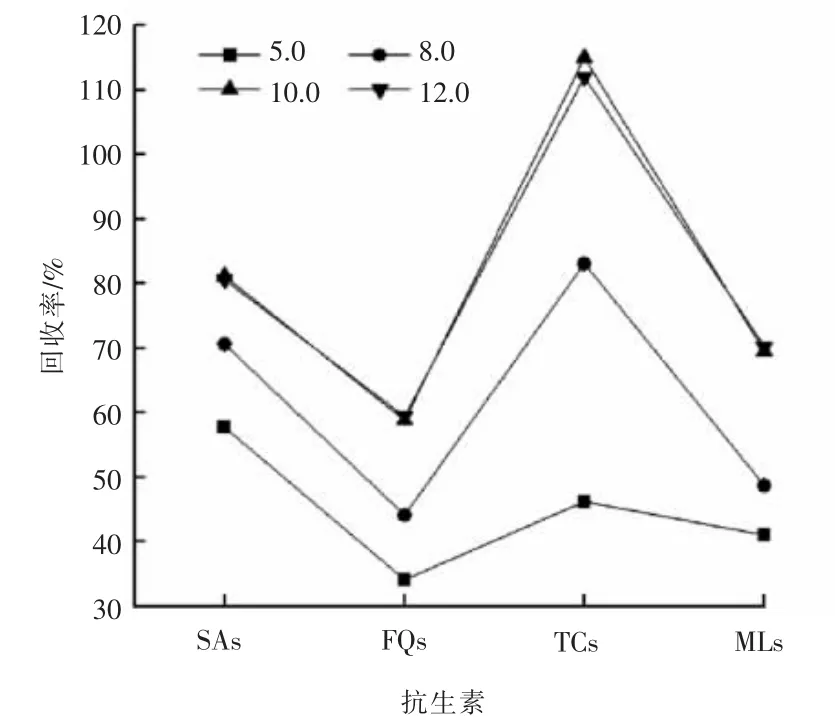
图6 洗脱液体积对抗生素回收率的影响
2.5 质量保证和质量控制评价
2.5.1 方法的线性范围与检出限
19 种抗生素的方法检出限、定量限及线性范围见表2。
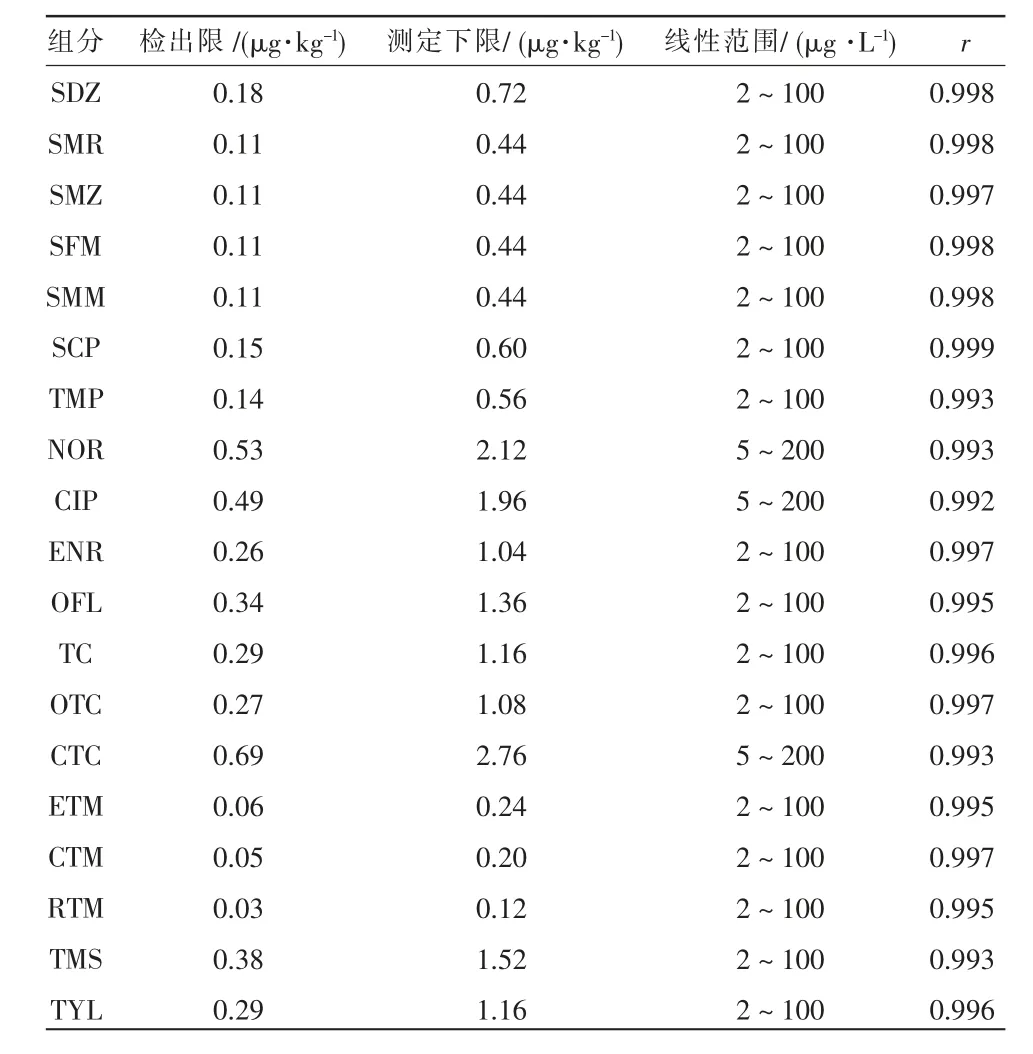
表2 19 种抗生素的方法检出限、定量限及线性范围
由表2 可以看出, 按照1.4 节检测抗生素质量浓度为2~200 μg/L 的系列混合标准溶液,19 种抗生素的标准曲线的相关系数(r)均大于0.99。 以3倍信噪比(3 S/N)计算方法检出限,19 种抗生素的方法检出限为0.03~0.69 μg/kg。
2.5.2 方法的回收率与基质效应
选取饮用水源地附近土壤样品经冻干研磨后准确称量5 g,添加抗生素混合标准溶液后使得加标水平分别为4,20 μg/kg,每个浓度水平设3 组平行,按照1.3 节对加标土样进行前处理,并按照1.4 节进行分析, 当加标质量分数分别为4 和20 μg/kg 时,比较19 种抗生素在纯溶剂和基质提取液中的响应情况,对方法的基质效应(ME)进行评估。 19 种抗生素在土壤样品中的加标回收率及基质效应见表3。 由表3 可以看出,2 种浓度下19 种抗生素的平均加标回收率(RSDs)(n=3)为45.2%~149% ,且其相对标准偏差均为2.8%~19.6%,均小于20%,说明该分析方法性能良好。 土霉素和金霉素均表现为强基质增强作用(155% ~177%),故有较高的回收率(106%~149%)。 其它17 种抗生素的基质效应范围均为86.8% ~99.2%,均表现为弱基质作用。
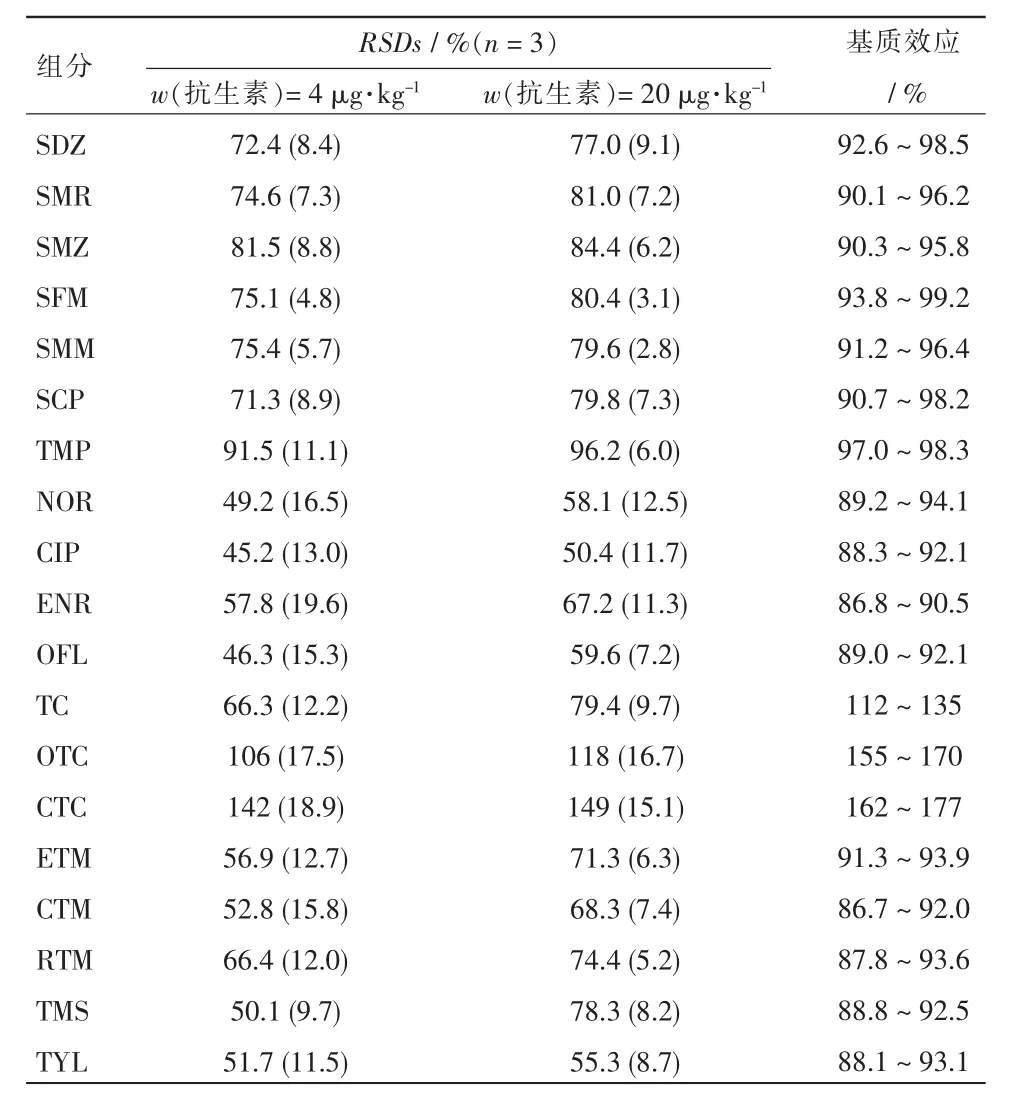
表3 19 种抗生素在土壤样品中的加标回收率及基质效应
2.6 测定农田土壤样品
采集长江下游沿岸饮用水源地周边6 个表层土壤样品及畜禽养殖粪便还田点位12 个土壤样品,在1.3,1.4 节实验条件下, 对样品中19 种抗生素残留进行分析。 土壤样品中的抗生素含量见图7。 由图7可以看出, 饮用水源地周边土壤6 个样品中均未检出目标化合物。畜禽养殖粪便还田地块12 个土壤样品中,共检出19 种抗生素中的9 种(分别为诺氟沙星、环丙沙星、恩诺沙星、氧氟沙星、土霉素、金霉素、克拉霉素、罗红霉素、泰乐菌素)。其中诺氟沙星和环丙沙星为土壤样品中含量最高的2 种抗生素, 其质量分数分别为16.0~38.4 和12.7~24.2 μg/kg。四环素类抗生素的质量分数均在2.03 ~ 15.2 μg/kg 之间, 大环内酯类抗生素的质量分数均在0.115 ~1.57 μg/kg 之间,磺胺类抗生素均未检出。抗生素检出类别和浓度水平与之前对长三角地区土壤抗生素残留水平的相关研究结果[4,11]基本一致。 氟喹诺酮类抗生素在土壤中残留水平较高,推断原因为此类抗生素在土壤中吸附性强,降解较慢,可长时间地稳定残留。
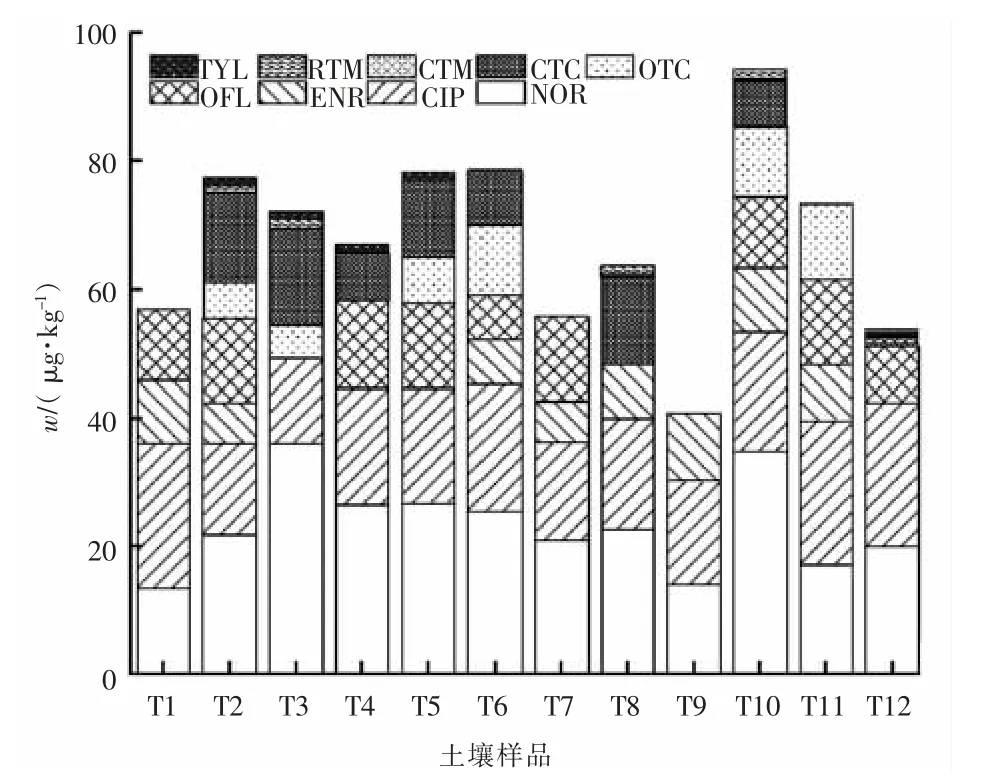
图7 土壤样品中的抗生素含量
3 结论
为同时测定土壤中痕量水平的4 类19 种抗生素,建立一种快速溶剂萃取-全自动固相萃取-超高效液相色谱/三重四级杆质谱法对长江下游地区18个点位的土壤样品进行检测, 在畜禽养殖粪便还田地块土壤样品中,检出喹诺酮类、四环素类及大环内酯类共9 种抗生素, 在饮用水源地周边土壤样品中未检出抗生素。该方法的检出限、定量限、线性范围、回收率等均满足土壤中抗生素的分析要求, 且操作简单、快速可行、溶剂用量较少,包含了目前广泛使用的各种抗生素种类[12-15],适用于土壤中多种痕量抗生素残留的同时检测。
