NF-κB (p50/p65)介导的促炎微小RNA信号转导在金黄色葡萄球菌感染中的作用
2023-10-31王天明吴志航陈全鑫易剑锋潘海邦
王天明,车 莹,崔 岩,付 琦,陈 乾,吴志航,陈全鑫,王 波,易剑锋,潘海邦
(1.甘肃中医药大学第一临床医学院,甘肃 兰州 730000; 2.甘肃省中医方药挖掘与创新转化重点实验室,甘肃中药新产品创制工程实验室,甘肃 兰州 730000); 3.甘肃中医药大学,护理学院,甘肃 兰州 730000; 4.甘肃中医药大学,甘肃 兰州 730000)
金黄色葡萄球菌(Staphylococcusaureus,SA)是导致皮肤和软组织感染的最常见病原菌,因抗菌药物的滥用,快速产生的耐药菌株严重危害人类健康。目前发现微小RNA(miRNA)在SA感染性疾病中协调了致病性基因表达,本文就当前研究领域涉及NF-κB调节的miRNA及其作用靶点,以及针对NF-κB和/或促炎性miRNA信号传导的治疗策略进行综述,为后续相关研究提供参考。
1 SA流行病学和基本特征
SA隶属于葡萄球菌属,是一种常见的致病微生物,既是一种共生细菌,也是一种人类病原体,大约30%的人被其定植[1]。SA是引起皮肤和软组织感染(SSTI)、血管内感染、肺炎、化脓性关节炎、心内膜炎、骨髓炎、异物感染和败血症的重要病原菌[2]。耐甲氧西林金黄色葡萄球菌(MRSA)分离株作为SA中常见的耐药性菌株,曾主要局限于医院、其他医疗保健环境,以及经常使用这些设施的患者。然而,自二十世纪九十年代中期以来,社区人群中MRSA感染数量激增[3]。SA感染依赖于产生启动细菌黏附到宿主组织的表面蛋白,分泌破坏宿主细胞和组织的细胞外毒素和酶,宿主免疫系统避免或失活,以及细菌的增殖并侵入到宿主细胞和组织中[4],凝固酶、透明质酸酶、脱氧核糖核酸酶和脂肪酶是SA合成以增强其致病性,并在宿主体内扩散的酶[5]。此外,肠毒素、中毒性休克综合征毒素1(TSST-1)、剥脱性毒素(ET)、溶血素、表皮细胞分化抑制剂(EDIN)和Panton-Valentine杀白细胞素(PVL)均已被鉴定为可增强SA致病性的细胞外蛋白毒素[6]。
2 SA感染中NF-κB敏感的miRNA和炎症信号传导
转录因子NF-κB于1986年由DavidBaltimore和RanjanSen报道,此后被确定为免疫系统中可诱导基因表达的关键调节因子[7]。核因子-kappaB(NF-kappaB)/REL转录因子家族在协调多种控制免疫反应的基因表达中发挥着核心作用[8]。转录因子在清除细胞质中的废物分子、炎症信号传导、分化、细胞生长、肿瘤发生和神经退行性病变中发挥重要作用[9-11]。人类先天免疫及后天免疫包含一个非常活跃的多效性NF-κB信号系统,该系统在先天免疫和后天免疫都发挥作用[11]。
在静息细胞中,预先形成的NF-κB(p50/p65)异二聚体与疏水性抑制性kappaB蛋白(IkB)结合,防止游离NF-κB与启动子结合及基因反式激活。然而,通过使用促炎介质[包括白细胞介素1β(IL-1β)、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)和内毒素等]可诱导IκB激酶(IKK)复合物位点特异性磷酸化,触发IkB分解,然后通过泛素-蛋白酶系统降解,由多个NF-κB敏感基因启动子快速激活NF-κB转录[12]。
近年来,miRNA在各种生物过程中的独特调控引起了人们的关注。miRNA是一类小的非编码RNA,长度约为19~25个核苷酸,广泛存在于真核生物中,可通过抑制mRNA转录和翻译负调控靶基因,是细胞内信号转导的关键元件[13-14]。miRNA作为基因调控因子,已在炎症、糖尿病、细胞凋亡、肿瘤和自身免疫性疾病等多个领域的疾病诊断中获得检验[15-21]。miRNA在各种类型的炎症中,表现出特征性表达的特征,并且可以极大地影响炎症细胞的行为。激活的NF-κB可上调疾病相关miRNA,包括miR-125b、miR-193b-5p、miR-128、miR-146a、miR-155、bta-miR-223、miR-30a,并参与SA感染后诱发的炎症反应[22-27](见图1)。所有NF-κB敏感的miRNA基因在其直接的5’-启动子区域中具有功能性NF-κB结合位点,SA感染后使得该miRNA基因家族对NF-κB激活和NF-κB介导的转录上调异常敏感[27-34](见表1)。
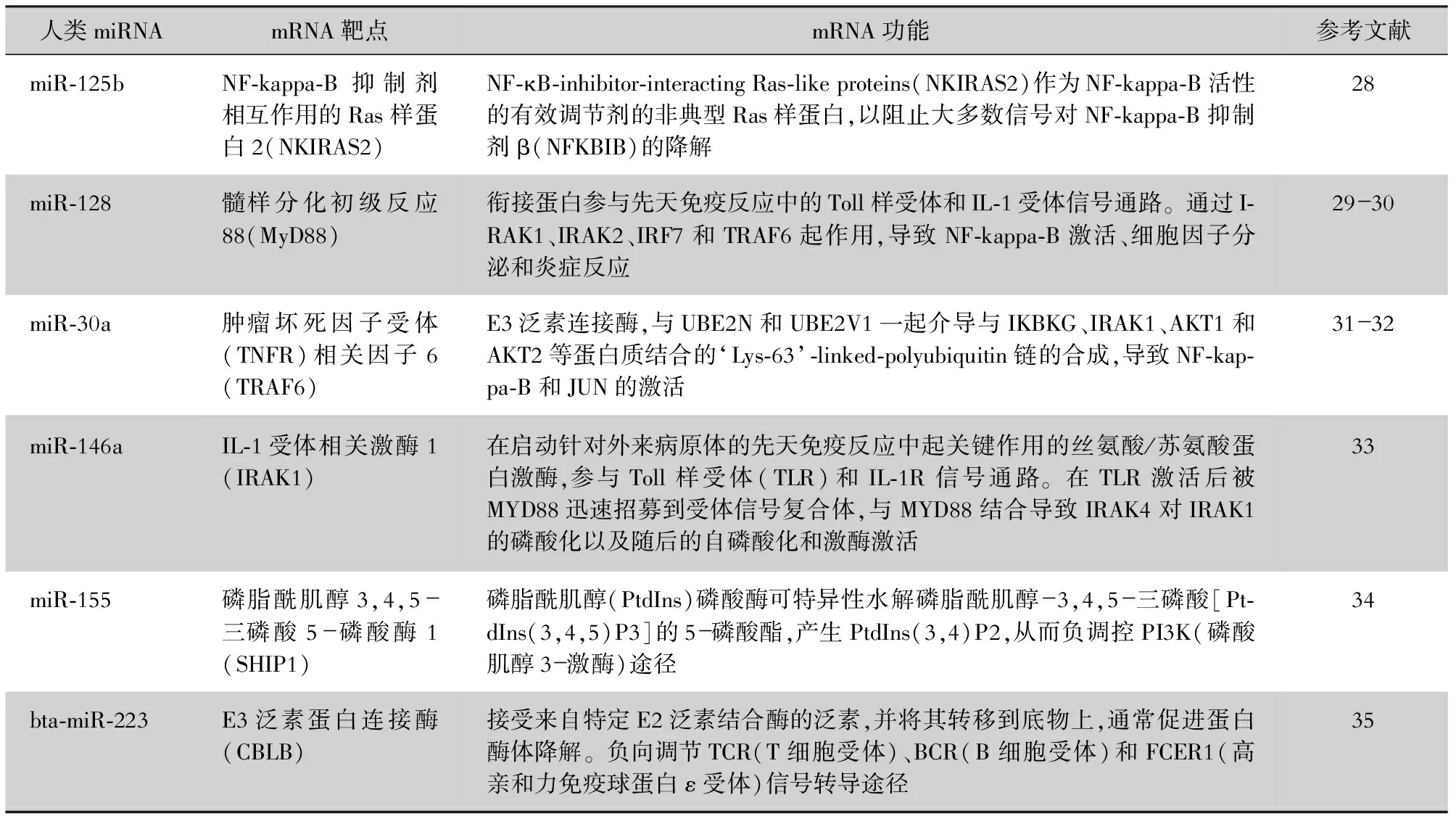
表1 NF-κB诱导的miRNA在SA感染后的靶标和功能

图1 NF-κB信号通路中miRNA作用示意图
在脂多糖(lipopolysaccharide,LPS)诱导的MAC-T细胞中,miR-125b表达显著下调;削弱LPS对NKIRAS2基因表达的抑制作用,并降低NF-κB的活性;下调炎症因子IL-6和TNF-α的表达,减轻MAC-T细胞的整体炎症反应[35]。通过荧光素酶验证MyD88-miR-128相互作用,miR-128的表达导致IκBα和NF-κB p65磷酸化减少,并导致炎症细胞因子分泌显著减少,与巨噬细胞中MyD88的缺失一致,表明miR-128通过MyD88下调,特异性地阻止炎症的进一步发展[36]。miR-30a过表达,通过miR-30a与MyD88 mRNA的3’-UTR结合来抑制其翻译,从而阻止NF-κB的激活;减弱SA诱导的氧化应激和炎症反应[37]。通过3’-UTR荧光素酶报告基因试验发现,NF-κB信号通路关键蛋白TRAF 6和IRAK 1是miR-146潜在的分子靶点,表明miR-146a可作为新的负调节因子,有助于调节免疫应答[38]。在炎症反应前12 h内,miR-155被NF-κB快速上调后靶向SHIP1,miR-155以PI3K/Akt依赖性方式激活IKK信号体复合物,形成信号放大所需的正反馈环放大炎症反应[39]。双荧光素酶报告试验[40]验证结果显示,beta-miR-223与CBLB启动子的直接结合;SA来源的脂磷壁酸刺激MAC-T细胞中CBLB的过表达,显著上调PI3K、AKT和磷酸化的NF-κB p65,而CBLB敲除具有相反的作用,证明bta-miR-223可通过靶向CBLB并抑制下游PI3K/AKT/NF-κB途径来减轻炎症进展。
3 针对NF-κB和/或促炎性miRNA信号传导的治疗策略
NF-κB信号通路主要参与癌症发生、免疫、炎症相关的人类疾病,因此已经设计和发现了大量天然和合成的NF-κB抑制剂,抑制NF-κB信号通路的激活。寻找能够干扰和/或阻断导致NF-κB激活的特定信号通路而没有多个脱靶的具有生物活性的抑制分子变得极有挑战性,许多NF-κB调节剂和阻断策略已在实验室研究和临床环境中采用或正在接受严格的评估。通常治疗性NF-κB抑制剂可能包含的基本机制、策略有:(1)阻断驱动NF-κB激活的原始生理刺激信号[41]。瑞沙托维(TAK-242)是Toll样受体4(TLR4)信号传导的小分子抑制剂,可选择性结合TLR4并干扰TLR4与其衔接分子之间的相互作用,从而阻断下游NF-κB的激活[42]。(2)靶向与NF-κB激活相关的磷酸化途径。NF-κB磷酸化以基因特异性方式控制转录[43];C25-140可靶向TRAF6 E3连接酶活性,抑制下游NF-κB磷酸化[44]。(3)调节或激活IkB复合物或其他NF-κB亚基[45]。BAY 11-7082是一种IκBα磷酸化和NF-κB抑制剂,通过TNF-α诱导的IkappaB-α磷酸化起作用,导致核因子-κB降低和黏附分子表达减少[46]。(4)阻断NF-κB易位,DNA序列识别,以及影响其活性或靶特异性的NF-κB的结合和/或修饰[47]。JSH-23抑制NF-κB p65的核易位,而不影响IκBα降解[48]。(5)可以使用化学稳定的抗miRNA策略或靶向miRNA加工酶来阻断或调节特异性上调的miRNA丰度和物种形成,从而防止产生完全活跃的和/或生物学上可用的miRNA物种[49]。在SA感染的小鼠乳腺炎模型中,硒通过诱导miRNA-146a的增加和减少TLR2/6,以及来自感染小鼠和乳腺上皮细胞的乳腺组织中的NF-κB和MAPK信号通路来减轻炎症[49]。(6)长期全身摄入低剂量NF-κB抑制剂,包括膳食给予的木脂素、二萜和倍半萜、皂甙、多糖、多酚、生物纤维等普遍有益作用的天然产物,通过慢性抑制NF-κB活性引起的炎症信号传导、致癌作用[50-52]。(7)这些治疗策略的任何组合。
4 展望
多效同源或异源二聚体转录因子NF-κB是先天免疫系统、炎症反应的主要调节剂。NF-κB复合物的一个极其重要的调节作用是促进炎症反应中的一小群致病性miRNA,进而靶向并下调一组mRNA,在SA感染中起促进炎症反应的决定性作用。这些NF-κB调节的miRNA-mRNA相关病理的相互作用将为治疗和疾病干预提供丰富的靶点。试验和人体临床试验的结合将在NF-κB和NF-κB-miRNA诱导的调节剂和药物的战略设计和应用中起决定性作用,这些调节剂和药物可更有效地治疗当前的SA感染,有望解决抗菌药物耐药及超级细菌出现的问题。
利益冲突:所有作者均声明不存在利益冲突。
