茯苓酸抑制人结肠癌细胞系HT-29增殖
2023-10-31冯娜欣何明璇刘锦燕
冯娜欣,王 鹏,何明璇,刘锦燕
保定市第二医院 肿瘤内科,河北 保定 071051
结肠癌作为消化道常见的恶性肿瘤之一,主要通过手术、放射和化学治疗(放化疗)等方法治疗,但术后易复发转移且大多化疗药物存在一定副作用[1]。近年,中医药(包括中药单体、提取物以及中药复方)因其资源丰富、不良反应少等独特优势而成为抗结肠癌治疗的研究热点[2]。茯苓酸(pachymic acid,PA)是茯苓的特有成分,茯苓饮片在临床上被用来治疗卵巢癌和乳腺癌[3-4]。PA可降低舌鳞状细胞癌细胞系CAL-27及胃癌细胞系SGC-7901增殖并诱导细胞周期阻滞和细胞凋亡[5-6]。但PA对结肠癌细胞增殖、凋亡和细胞周期的影响以及相关机制尚未见报道。故本研究选择人结肠癌细胞系HT-29作为研究对象,旨在探讨PA对结肠癌细胞增殖和凋亡的影响及可能的分子机制。
1 材料与方法
1.1 主要材料
1.1.1 实验细胞与动物:人结肠癌细胞系HT-29(美国ATCC)。24只SPF级雄性5周龄BALB/c裸鼠(体质量20~25 g)[北京维通利华实验动物技术有限公司,生产许可证号:SCXK(京)2021-0006]。
1.1.2 主要试剂:茯苓酸(PA)(MCE公司,纯度≥98.0%);RPMI 1640培养基(Gibco公司);MTT(北京索莱宝科技有限公司);Annexin V-FITC/PI凋亡检测试剂盒(北京百奥莱博科技有限公司);一抗B细胞淋巴瘤基因-2(B cell lymphoma gene-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、细胞周期蛋白D1(cyclin D1)、细胞周期蛋白依赖性激酶2(cycle protein dependent activating enzyme 2,CDK2)、Akt、磷酸化Akt(phosphorylated Akt,p-Akt)、小鼠双微体基因2(mouse double microgene 2,MDM2)、磷酸化MDM2(phosphorylated MDM2,p-MDM2)、p53、磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH)、增殖细胞核抗原(Ki-67)和切割型胱天蛋白酶-3(cleaved caspase-3)抗体(Cell Signaling Technology公司或Abcam公司);BCA蛋白质定量试剂盒(北京天根生化科技有限公司);超敏ECL底物液(武汉伊莱瑞特生物科技股份有限公司);SABC(兔IgG)-POD免疫组化试剂盒(上海康朗生物科技有限公司)。
1.2 方法
1.2.1 细胞的分组及处理:复苏HT-29细胞,常规培养。将处于对数期的HT-29细胞接种于96孔板或24孔板,分为空白组、20、40组和80 μmol/L PA组[5-6],每组设置6个复孔。48 h后用于实验检测。
1.2.2 MTT法检测HT-29细胞增殖活力:将HT-29细胞以3 000个/孔(100 μL)接种至96孔细胞板中,常规培养至80%汇合度后24、48和 72 h,加入MTT溶液(5 g/L)20 μL,4 h后添加150 μL DMSO,15 min后上酶标仪检测490 nm波长处的A值(A490 nm),A490 nm越大,增殖活力越强。
1.2.3 流式细胞仪检测HT-29细胞凋亡:将HT-29细胞以3×104个/孔(1 mL)接种到24孔板中,48 h,将各组5×104个细胞用185 μL annexin V-FITC结合液重悬,添加annexin V-FITC 10 μL和5 μL PI,室温下各避光培养10 min和5 min,上流式细胞仪检测细胞凋亡,并通过仪器自带软件分析凋亡率。
1.2.4 流式细胞仪检测HT-29细胞周期:收集各组细胞,使用100 μL RNase A重悬1×106个细胞,添加PI染色液500 μL,室温下避光培养30 min,上流式细胞仪检测周期分布。
1.2.5 Western blot测定细胞周期、凋亡以及Akt/MDM2/p53信号通路相关蛋白质表达:使用RIPA裂解液提取细胞总蛋白质,BCA法对蛋白质浓度进行定量。20 μg蛋白质用于SDS-PAGE,并电转移至PVDF膜上,室温下用5%脱脂奶粉封闭1 h,与Bcl-2、Bax、cleaved caspase-3、cyclin D1、CDK2、Akt、p-Akt、MDM2、p-MDM2、p53、GAPDH一抗在4 ℃过夜孵育,次日,加入HRP标记羊抗兔IgG二抗,室温下孵育1.5 h,ECL显色,凝胶成像分析系统和Image J软件扫描图像并分析蛋白质条带吸光度值。
1.2.6 肿瘤异种移植模型:将处于对数增殖期的HT-29细胞重悬成2×107个/mL的细胞悬液,然后使用一次性无菌注射液分别将200 μL细胞悬液皮下注射至裸鼠。注射HT-29细胞悬液1周后,24只成瘤裸鼠(肿瘤大小均100 mm3左右)随机分为对照组、腹腔注射10、30和60 mg/kg PA组[6](每组6只),每3 d给药1次,持续至第28天。给药开始后定期测量肿瘤体积[肿瘤体积=(长×宽2)/2];给药结束后麻醉裸鼠并处死,取出肿瘤,再次测量肿瘤体积和质量,随后将一部分肿瘤组织于-80 ℃冰箱冻存,另一部分于4%多聚甲醛中固定。
1.2.7 免疫组化检测肿瘤组织中Ki-67、cleaved caspase-3蛋白表达:4%多聚甲醛固定24 h后的肿瘤组织制备成常规组织石蜡切片(厚度5 μm),切片脱蜡至水后进行内源性过氧化物酶灭活(3% H2O2)、抗原热修复(柠檬酸钠缓冲液)、封闭(5% BSA),随后添加一抗(Ki-67、cleaved caspase-3抗体)4 ℃孵育过夜,PBS洗涤后添加二抗(生物素标记羊抗兔IgG)37 ℃孵育1 h,再次洗涤后滴加SABC-POD工作液,DAB显色,苏木精复染。显微镜观察并拍照,任选5个视野采用Image J软件测定平均吸光度值,并标准化为对照组。
1.2.8 Western blot检测肿瘤组织中Akt/MDM2/p53信号通路相关蛋白表达:取出冻存的肿瘤组织,提取组织中总蛋白质,参照1.2.6中方法检测肿瘤组织中Akt、p-Akt、MDM2、p-MDM2、p53蛋白表达。
1.3 统计学分析
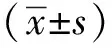
2 结果
2.1 PA对结肠癌细胞增殖的影响
与空白组比较,PA呈浓度依赖性显著降低,细胞增殖活力均显著降低(P<0.05)(表1)。

表1 各组HT-29细胞增殖活力比较
2.2 PA对结肠癌细胞凋亡的影响
PA呈浓度依赖性显著升高HT-29细胞凋亡率和蛋白Bax、cleaved caspase-3表达水平,显著降低蛋白Bcl-2表达水平(P<0.05)(图1,2,表2)。
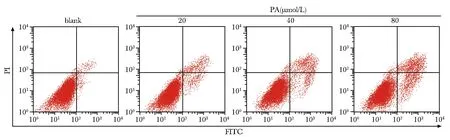
PA.pachymic acid.
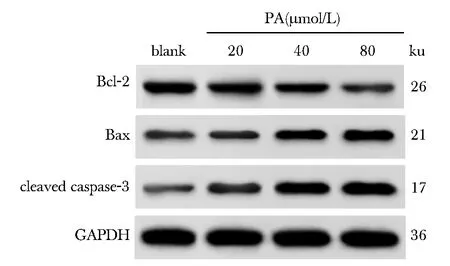
图2 Western blot检测各组HT-29细胞中Bcl-2、Bax、cleaved caspase-3蛋白表达

表2 各组HT-29细胞凋亡率和细胞中Bcl-2、Bax、cleaved caspase-3蛋白表达水平比较
2.3 PA对结肠癌细胞周期的影响
PA呈浓度依赖性显著升高HT-29细胞中G0/G1期细胞比例,显著降低S、G2/M期细胞比例和细胞中cyclin D1、CDK2蛋白表达水平(P<0.05)(图3,4,表3)。
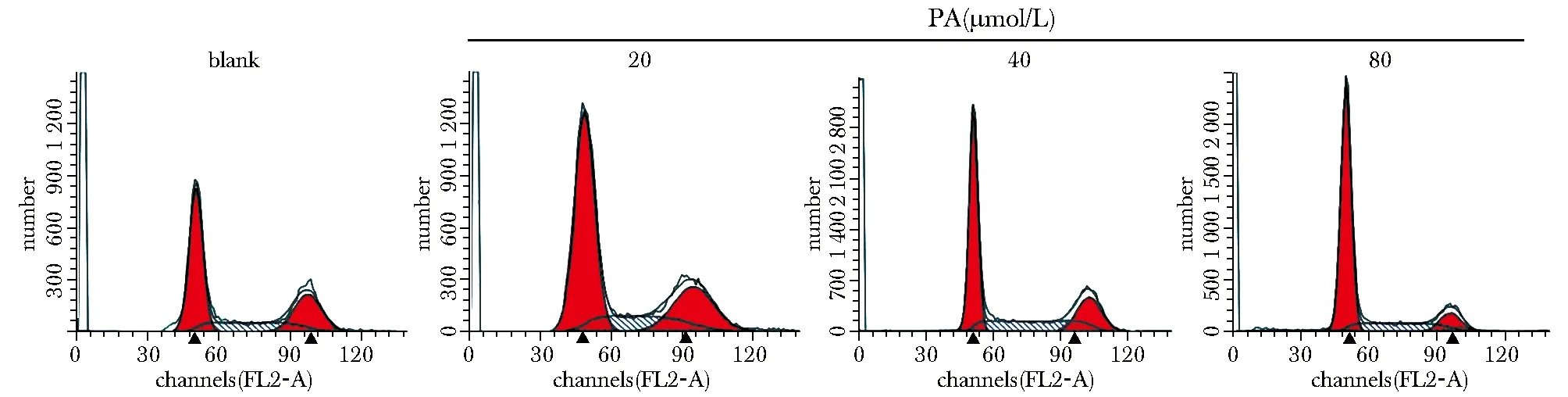
PA.pachymic acid.
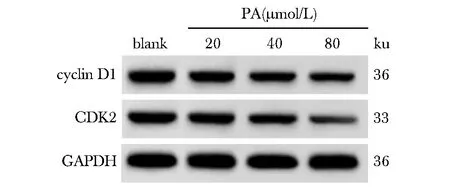
图4 Western blot检测各组HT-29细胞中cyclin D1、CDK2蛋白表达

表3 各组HT-29细胞周期分布和细胞中cyclin D1、CDK2蛋白表达水平比较
2.4 PA对结肠癌细胞中Akt/MDM2/p53信号通路的影响
PA呈浓度依赖性显著降低HT-29细胞中p-Akt/Akt、p-MDM2/MDM2比值,显著升高p53蛋白表达水平(P<0.05)(图5,表4)。

图5 Western blot检测各组HT-29细胞中p-Akt、Akt、p-MDM2、MDM2、p53蛋白表达

表4 各组HT-29细胞中p-Akt/Akt、p-MDM2/MDM2比值和p53蛋白表达水平比较
2.5 PA对结肠癌异种移植肿瘤生长的影响
PA呈浓度依赖性显著降低裸鼠肿瘤体积、质量和肿瘤组织中Ki-67蛋白表达水平,显著升高肿瘤组织中蛋白cleaved caspase-3表达水平(P<0.05)(图6,7,表5)。

图6 肉眼观察各组裸鼠肿瘤外观

图7 免疫组化测定肿瘤组织中Ki-67、cleaved caspase-3蛋白表达

表5 各组裸鼠肿瘤体积、质量和肿瘤组织中Ki-67、cleaved caspase-3蛋白表达水平比较
2.6 PA对结肠癌异种移植肿瘤组织中Akt/MDM2/p53信号通路的影响
PA呈浓度依赖性显著降低裸鼠肿瘤组织中p-Akt/Akt、p-MDM2/MDM2比值,显著升高p53蛋白表达水平(P<0.05)(图8,表6)。
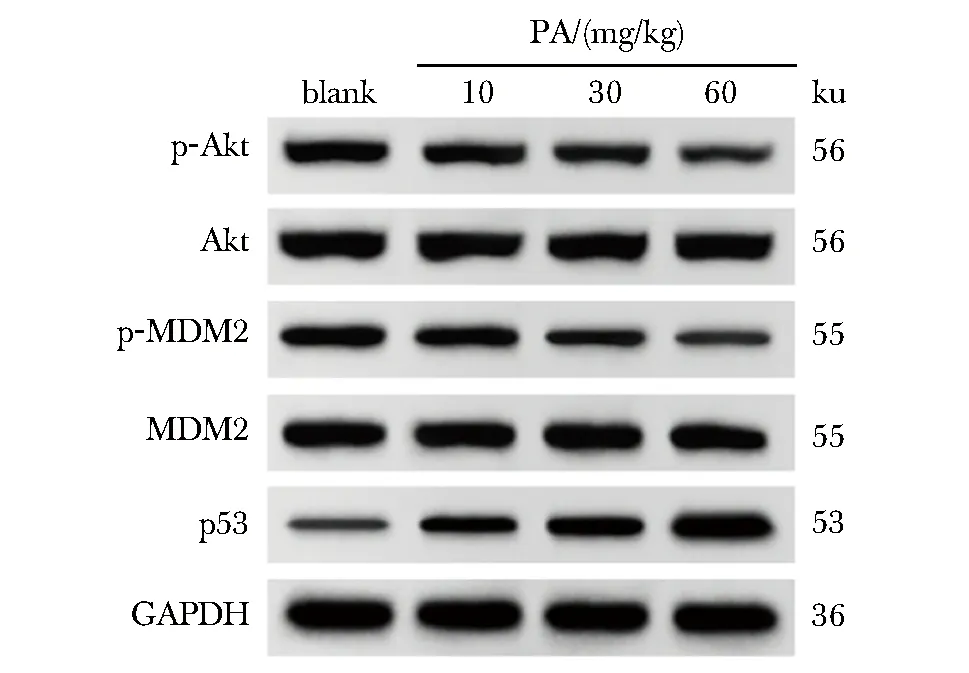
图8 Western blot检测各组裸鼠肿瘤组织中p-Akt、Akt、p-MDM2、MDM2、p53蛋白表达

表6 各组裸鼠肿瘤组织中p-Akt/Akt、p-MDM2/MDM2比值和p53蛋白表达水平比较
3 讨论
PA不仅可诱导乳腺癌G0/G1期细胞周期停滞和细胞凋亡,还能够抑制肝癌HepG2和Huh7细胞增殖和转移[7-8]。本研究发现,PA可呈浓度依赖性抑制结肠癌细胞增殖。同时体内实验显示,PA具有抑制结肠癌细胞增殖的作用,与既往研究中PA在舌鳞状细胞癌[5]、胃癌[6]、肝癌[8]等癌中的作用一致。细胞周期蛋白依赖性激酶CDK2和细胞周期蛋白cyclin D1在肿瘤细胞恶性进展和耐药性发生中发挥重要调控作用[9]。本研究中,PA可能通过下调cyclin D1、CDK2表达诱导结肠癌细胞阻滞在G0/G1期,进而抑制癌细胞增殖,与上述研究一致。
肿瘤细胞周期紊乱与其凋亡关系密切,Bcl-2(抗凋亡蛋白)与Bax(促凋亡蛋白)形成Bcl-2/Bax异源二聚体,通过抑制下游caspase-3激活来抑制细胞凋亡;caspase-3作为细胞凋亡过程中激活的关键激酶,是细胞凋亡的关键执行者,细胞凋亡信号刺激下caspase-3裂解、活化,活化的caspase-3又进一步导致caspase级联切割放大,最终诱导细胞凋亡[10]。本研究发现,PA可能通过调控Bcl-2、Bax、cleaved caspase-3表达诱导结肠癌细胞凋亡,与报道[11]相似,提示PA可能通过使HT-29细胞周期在G0/G1期发生阻滞,不再向S期、G2期转化,从而导致细胞产生早期凋亡进而阻碍其增殖,实现抗结肠癌作用。
据报道,莪术通过抑制Akt信号通路抑制肿瘤细胞增殖、侵袭和迁移,提示其具有潜在的抗肿瘤机制[12]。Akt/MDM2/p53信号通路在细胞凋亡和增殖调控中其重要作用[13]。Akt信号通路是典型的细胞内信号通路,包括结肠癌在内的许多不同类型癌的恶性与Akt信号通路异常激活有关[14-15]。Akt磷酸化p53抑制因子MDM2,促进MDM2向细胞核转运,从而抑制p53的功能[13]。本研究发现,PA可显著降低HT-29细胞和裸鼠肿瘤组织中p-Akt/Akt、p-MDM2/MDM2比值,同时升高p53蛋白表达,提示PA可能通过Akt/MDM2/p53信号通路阻碍结肠癌细胞增殖并促进细胞凋亡和细胞周期阻滞。
综上所述,本研究首次初步表明PA能够诱导结肠癌细胞凋亡和细胞周期阻滞并抑制细胞增殖,其机制可能与调节Akt/MDM2/p53信号通路有关。然而本研究仅使用一种结肠癌细胞系,且未使用Akt/MDM2/p53信号通路特异性抑制剂或激活剂进行干预等,有待后续研究中进一步弥补不足。
