合成肽VAR2特异性结合循环肿瘤细胞的检测及临床应用
2023-10-31余宏,丁利杰,刘厚聪等
全球每年大约有1 000万人死于恶性肿瘤,高达90%与癌细胞的转移扩散有关[1]。循环肿瘤细胞(circulating tumor cells,CTCs)是原发或转移性肿瘤自然脱落后在血液中循环的癌细胞,可能引起肿瘤的转移和定植。CTCs检测可用于肿瘤的诊断、评估预后和疗效[2]。但是CTC的稀有性[3]和上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)[4]使得它们很难被捕获和鉴定。目前CTCs检测技术大多受限于标志物,导致CTC 检测效率低下[5]。研究发现,硫酸软骨素蛋白聚糖(chondroitin sulfate proteoglycan,CSPG)分布在多种细胞表面,其独特修饰形式的癌胚硫酸软骨素(oncofetal chondroitin sulfate,ofCS),在多种原发性和转移性肿瘤中高表达[6],并可被疟疾蛋白VAR2CSA特异性靶向结合,有望成为检测CTCs的有效靶标[7-8]。本研究通过合成疟疾蛋白VAR2CSA功能结构域(malaria protein VAR2CSA,VAR2)多肽,建立一种新型CTCs检测技术,并应用于结直肠癌患者外周血CTCs检测,探讨该方法检测CTCs在结直肠癌诊断及分期预测中的应用价值。
1 材料与方法
1.1 材料
1.1.1 一般资料:选取2022年8月至12月在华中科技大学协和深圳医院胃肠外科和肿瘤中心收治的22例结肠癌患者为研究对象。另选取2022年8月至2023年5月本院门诊健康者22名作为对照样本。入组标准:1) 经肠镜或手术活检病理学确诊;2)排除其他恶性肿瘤史;3)患者临床资料完整。根据第八版《AJCC癌症分期手册》结直肠癌TNM分期标准,入组患者中1期3例、2期6例、Ⅲ期6例、Ⅳ期7例。研究通过伦理委员会批准(KY-2020-060-01)并签署知情同意书。
1.1.2 试剂:FITC标记的抗人CD45、DAPI染色液、FISH探针、密度梯度分离液Ficoll(均上海纳奥生物公司);DMEM-high glyxcose、RPMI-1640细胞培养基(Hyclone公司);Alexa FluorTM594标记的链霉亲和素偶联物(Thermo Fisher公司)。
1.1.3 细胞系:人结肠癌细胞系SW620、人乳腺癌细胞系MCF7、人食管鳞癌细胞系KYSE180(中国科学院细胞库)。
1.1.4 肽合成和标记:选择VAR2CSA功能结构域ID1-DBL2X-ID2a肽段序列[6],通过固相法合成生物素标记的合成肽VAR2(上海吉尔生化有限公司)。
1.2 方法
1.2.1 细胞的培养:将人乳腺癌细胞系MCF7、人结肠癌细胞系SW620及人食管鳞癌细胞系KYSE180分别用含10%胎牛血清DMEM-high glucose和含10%胎牛血清的RMPI-1640培养基,于37 ℃、5% CO2进行细胞培养。
1.2.2 外周血CTCs的富集:用基于纳米微流控技术原理的循环肿瘤活细胞捕获仪富集CTCs,按照检测说明书进行操作,主要步骤为:采集患者EDTA-K2抗凝血3 mL,加至4 mL样本密度梯度分离液上,1 700 r/min,离心30 min,小心吸取单核细胞层,加入PBS至12 mL,1 700 r/min,离心10 min,去除上清,加入10 mL PBS对细胞重悬。将细胞悬液加入CTCs细胞捕获仪的微流控芯片分选装置中,上机自动分选,收集CTCs富集细胞悬液。
1.2.3 免疫荧光原位杂交(immunostaining-fluorescenceinsituhybridization,imFISH)检测CTCs:将CTCs富集细胞悬液均匀涂在玻片上,4%多聚甲醛固定,滴加核型标志物 8号染色体探针(chromosome 8 centromeric probe,CEP8)10 μL,于杂交仪中变性(75 ℃,12 min)、杂 交(37 ℃,3 h)。滴加100 μL抗 CD45抗体,室温孵育1 h,加10 μL DAPI复染,于荧光显微镜下观察、计数。将显示异倍体核型的CEP8+/CD45-/DAPI+的细胞计为CTCs(CEP8荧光探针信号点≥3个)。
1.2.4 合成肽VAR2标记检测CTCs:在制备好的玻片标本上滴加生物素标记的VAR2合成肽10 μL,室温作用30 min,加入Alexa Fluor 594 标记的链霉亲和素抗体5 μL,室温作用40 min。滴加FITC标记的 CD45抗体作用1 h,加 DAPI复染,于荧光显微镜下观察、计数。将VAR2α+/CD45-/45DAPI+的细胞计为 CTCs。CTCs≥2个/3 mL的患者定义为 CTCs检测阳性。
1.2.5 肿瘤细胞掺入回收实验:培养收获肿瘤细胞悬液后计数,用PBS稀释制备浓度为10 000个/mL的细胞悬液,取不同数量的肿瘤细胞(50、100、200个)掺入3 mL的健康人外周血中形成模拟肿瘤患者血液样本,与imFISH方法比较,验证VAR2合成肽对CTCs检测的回收效率(检测到的肿瘤细胞与掺入肿瘤细胞的比率)。
1.2.6 流式细胞测量术检测肿瘤细胞:培养收集制备1×105个不同肿瘤细胞悬液,分别加入20 μL的生物素标记VAR2合成肽,室温孵育30 min,PBS洗涤,加入1 μL Alexa Fluor 594标记的链霉亲和素抗体,室温孵育30 min,PBS洗涤,流式细胞仪检测细胞平均荧光强度(Mean Fluorescent Intensity,MFI),表示VAR2合成肽与肿瘤细胞的结合能力。
1.3 统计学分析
2 结果
2.1 合成肽VAR2与不同肿瘤细胞特异性结合能力
合成肽VAR2可以与MCF7、SW620、KYSE180不同组织来源的肿瘤细胞呈现特异性膜染色(红色),而与外周血单个核细胞(peripheral blood mononuclear cell,PBMC)无非特异性结合(图1A)。与PBMC比较,合成肽 VAR2可与肿瘤细胞形成特异性结合荧光峰(图1B),而且合成肽VAR2与MCF7、SW620、KYSE180不同肿瘤细胞结合的MFI明显高于与PBMC的结合(图1C)。
2.2 合成肽VAR2检测不同肿瘤细胞掺入回收效率
合成肽VAR2检测100个SW620、MCF7、KYSE180细胞掺入回收率均较高(图2A),与imFISH法检测法比较,差异无统计学意义(图2B)。合成肽VAR2检测50、100、200个3种不同肿瘤细胞回收率与掺入肿瘤细胞的数量没有明显相关性(图2C)。

A.100 different tumor cells doping recovery experiments; B.comparison of recovery rates between VAR2 synthetic peptide method and imFISH method C.comparison of the recovery rates of different numbers of SW620,MCF7 and KYSE180 cells.
2.3 合成肽VAR2检测临床结直肠癌患者外周血CTCs
结直肠癌患者外周血CTCs免疫荧光呈现特异性膜染色红色VAR2+/CD45-/45DAPI+(图3),合成肽VAR2检测CTCs的总阳性率为63.6%(14/22),明显高于健康受试者组CTCs阳性率的0.0%(0/22) (P<0.05)。比较不同病理分期的结直肠癌患者CTCs检测结果,侵袭深度T3~T4期、区域淋巴结转移N1~N2期、有远处转移M1期患者及临床进展晚期Ⅲ~Ⅳ期患者的 CTCs 阳性率均分别明显高于对应的T1~T2期、无淋巴结转移N0期、无远处转移M0期及 Ⅰ~Ⅱ期早期患者(P<0.05)(表1),CTCs阳性率与侵袭深度、淋巴结转移、远处转移及临床分期有关。
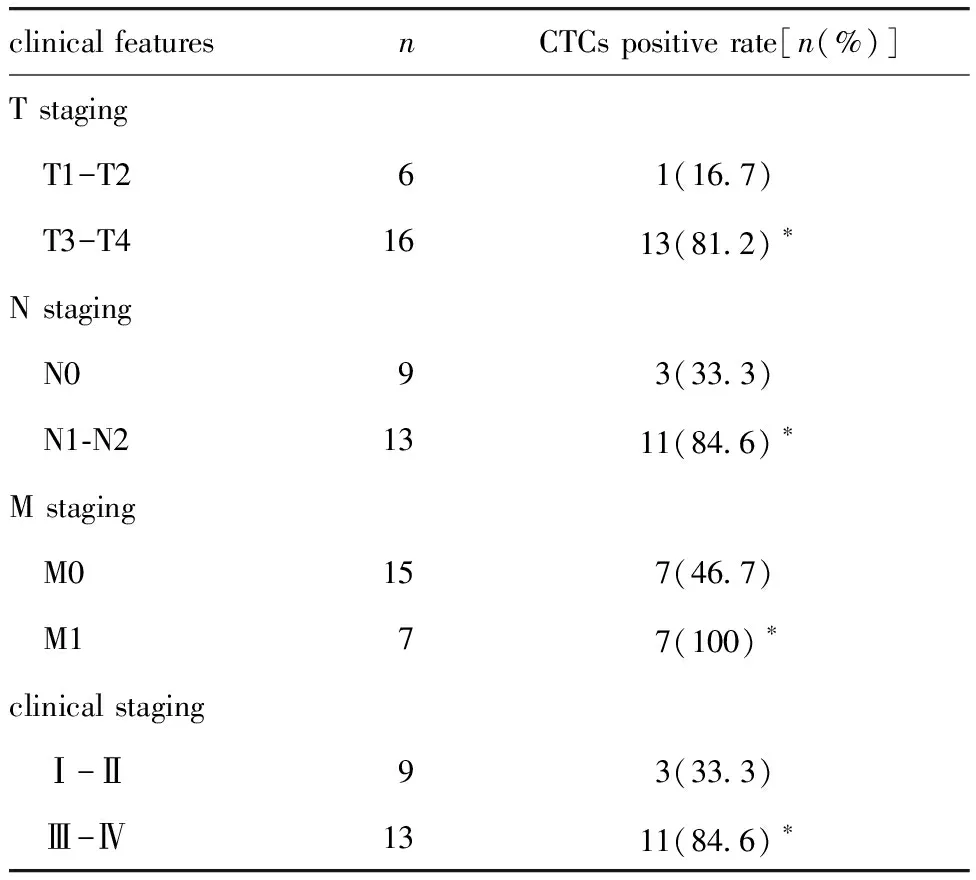
表1 结直肠癌外周血CTCs阳性率与TNM分期的关系
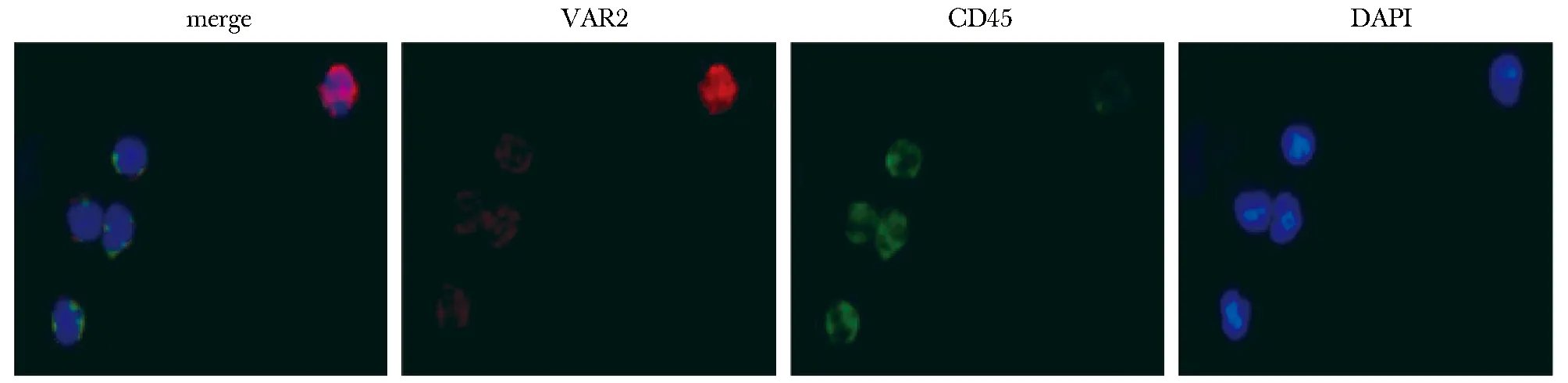
图3 合成肽 VAR2特异性结合结直肠癌患者外周血CTCs免疫荧光鉴定
3 讨论
CTCs检测作为一种实时监测的非侵入性肿瘤诊断方法,具有一定的独立预测预后的价值[9]。目前常用免疫细胞化学法检测CTCs表面的上皮细胞标志如细胞角蛋白、EpCAM,但由于肿瘤可能发生上皮细胞-间充质转化 (EMT)、失去标志物的表达导致漏检[10-11];而一些非上皮性肿瘤不表达EpCAM,可致检测假阴性[12]。常用的imFISH可有效鉴定非血源性非整倍体CTCs,但检测操作繁琐,实验条件要求较高[13]。
研究发现,几乎所有肿瘤细胞都表达癌胚硫酸软骨素(ofCS),可被VAR2CSA特异性靶向结合,且不受肿瘤细胞EMT的影响,具有较高的捕获和检测效率[8]。由于功能结构域多肽与靶蛋白的结合亲和力与抗体相当[14],本研究选择具有完整ofCS结合特异性的VAR2CSA功能结构域ID1-DBL2X-ID2a肽段序列[6],建立了VAR2合成多肽检测CTCs的方法。结果显示VAR2合成肽可与MCF7、SW620、KYSE180等不同肿瘤细胞特异性结合,而与外周血中PBMC细胞无非特异性结合,适用于不同组织来源、非抗体依赖性的CTCs检测。
在不同肿瘤细胞掺入回收实验中,合成肽VAR2检测KYSE180、SW620细胞的回收效率高于MCF7,而流式分析显示VAR2合成肽与MCF7结合水平明显高于SW620细胞,提示检测CTCs回收效率不仅取决于VAR2合成肽与肿瘤细胞的结合,还可能受到掺入血液时暴露于机体免疫细胞的作用等影响,与利用VAR2CSA检测循环中胶质瘤细胞的报道[15]一致。此外,合成肽VAR2检测不同肿瘤细胞回收效率与其掺入数量没有明显相关性,显示该检测体系有较好的稳定性。合成肽VAR2检测与imFISH法比较,两种方法检测肿瘤细胞回收效率相近,但是VAR2合成肽法检测流程简便省时,临床实用性更有优势。
本研究进一步利用VAR2合成肽检测22例不同分期结直肠癌患者的CTCs总阳性率为63.6%,高于健康受试者组CTCs阳性率的0.0%。且CTCs的阳性率与结直肠癌病灶侵袭深度、是否淋巴结转移、远处转移和临床分期等有关,与报道[16]一致。这表明VAR2合成肽检测CTCs对于肿瘤患者临床分期、病情评估具有一定的临床应用价值。
本研究中所纳入的临床样本量和肿瘤细胞种类较少,具有一定的局限性。后续需进一步补充间充质来源的肿瘤细胞、扩大临床样本量,并通过动态监测肿瘤患者治疗前后CTCs数量变化,探索VAR2合成肽检测CTCs在肿瘤转移、病情监测及预后评估中的应用前景。
