和田地区羊源肺炎克雷伯菌的分离及生物学特征鉴定
2023-10-30郭良帅
郭良帅
(塔里木大学动物科学与技术学院/新疆兵团塔里木动物疫病诊断与防控工程实验室,新疆阿拉尔 843300)
肺炎克雷伯菌(Klebsiella pneumonia,KP)属于肠杆菌科(Enterobacteriaceae),为革兰氏阴性杆菌,广泛分布于人和动物肠道以及自然环境中[1],肺炎克雷伯菌作为仅次于大肠杆菌的人畜共患条件致病菌,可引起人和动物伤口感染、肺炎、脑膜炎、泌尿系统发炎[2,3]。关于肺炎克雷伯菌感染鸡[4]、牛[5,6]、犬[7]、水貂[8]、大熊猫[9]等动物有较多的报道,均造成一定经济损失,因此及时了解动物感染肺炎克雷伯菌的血清型、携带毒力基因及耐药情况,对治疗及预防肺炎克雷伯菌具有重要意义。
羊养殖业是和田地区的主要支柱产业,随着规模化养殖的不断发展,由肺炎克雷伯菌引起的羊呼吸道疾病时有发生,试验从和田地区某规模化养殖场采集25 份具有呼吸道症状病死羊胸腔积液及肺脏组织,进行细菌分离培养,通过革兰氏染色、生化试验、16S rRNA 基因扩增、溶血酵素(khe)基因检测鉴定方法确定肺炎克雷伯菌,采用荚膜血清学检测、毒力基因检测、小鼠致病性试验评估分离株危害,进行药敏试验了解耐药情况,以期为和田地区防控肺炎克雷伯菌提供理论支持。
1 材料与方法
1.1 材料
1.1.1 病料采集 从和田地区某规模化养殖场采集25 份具有呼吸道症状病死羊胸腔积液及肺脏组织,将样本进行编号,置于-20 ℃保存。
1.1.2 试验动物 40 只昆明小白鼠,小鼠体重均在25 g左右。
1.1.3 主要试剂 普通琼脂、营养肉汤、麦康凯肌酮醇阿东醇羧苄青霉素琼脂(MIAC)均购自青岛高科技工业园海博生物技术有限公司;核酸染料、PCR Mix 均购自北京全式金生物技术有限公司;引物均由生工生物工程(上海)股份有限公司合成。
1.1.4 药敏纸片 药敏纸片批号为20200919,由杭州天和微生物试剂有限公司生产。
1.2 方法
1.2.1 细菌的分离与纯化 将25 份病死羊胸腔积液及肺脏组织样本划线接种于MIAC 选择性培养基,置于37 ℃恒温培养箱中培养12~24 h,挑取紫红色、有沉淀环的单菌落接种于麦康凯培养基上,置于37 ℃恒温培养箱中培养12~24 h,挑取单菌落进行纯培养,对纯培养菌株进行革兰氏染色并镜检。
1.2.2 细菌生化试验 根据肺炎克雷伯菌的生化反应特点,选取氧化酶、阿拉伯糖、乳糖、麦芽糖、木糖、甘露醇、山梨醇、肌醇、柠檬酸盐、MR、VP、精氨酸、鸟氨酸、苯丙氨酸、硫化氢、吲哚、明胶酶鉴定分离株种类,具体操作步骤及结果判定依照生化试验鉴定管说明书。
1.2.3 16S rRNA 基因检测及系统进化树的构建参考文献[10]中细菌16S rRNA 引物并合成,上游引物27 F:5′-AGAGTTTGATCCTGGCTCAG-3′;下游引 物1 492 R:5′-GGTTACCTTGTTACGACTT-3′。PCR 反应体系(25 μL):2×EasyTap PCR SuperMix 12.5 μL,上、下游引物各1.0 μL,去离子水8.5 μL,纯化菌液2.0 μL。PCR 反应条件为94 ℃预变性5 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸90 s,共35个循环;72 ℃再延伸10 min。取适量PCR 产物点样电泳后,用凝胶成像仪检测试验结果,阳性产物送至公司测序。对测序结果进行比对,利用DNA Star 软件进行同源性比较,确定细菌种属。
1.2.4khe基因扩增 参照Neuberger 等[11]引物扩增肺炎克雷伯菌的特异性基因溶血酵素(khe)基因,引物序列为F:5′-TGATTGCATTCGCCAC-TGG-3′;R:5′-GGTCAACCCAACGATCCTG-3′。扩增片段大小为428 bp,PCR 反应体系(25 μL):2×EasyTap PCR SuperMix 12.5 μL,上、下游引物各1.0 μL,去离子水8.5 μL,纯化菌液2.0 μL。PCR 反应条件为94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共30 个循环;72 ℃再延伸10 min。取适量PCR产物电泳后,用凝胶成像仪检测,阳性产物送至公司测序。对测序结果进行比对。
1.2.5 荚膜血清型检测 参考文献[12]合成肺炎克雷伯菌常见荚膜血清型引物,引物序列见表1。对分离株进行血清型分型检测,PCR 反应体系(25 μL):2×Tap PCR MasterMix 12.5 μL,上、下游引物各0.5 μL,DNA 模板2.0 μL,dd H2O 9.5 μL。PCR反应程序为94 ℃预变性5 min,94 ℃变性1 min,51~55 ℃退火1 min,72 ℃延伸30~60 s,共35 个循环;72 ℃再延伸10 min。
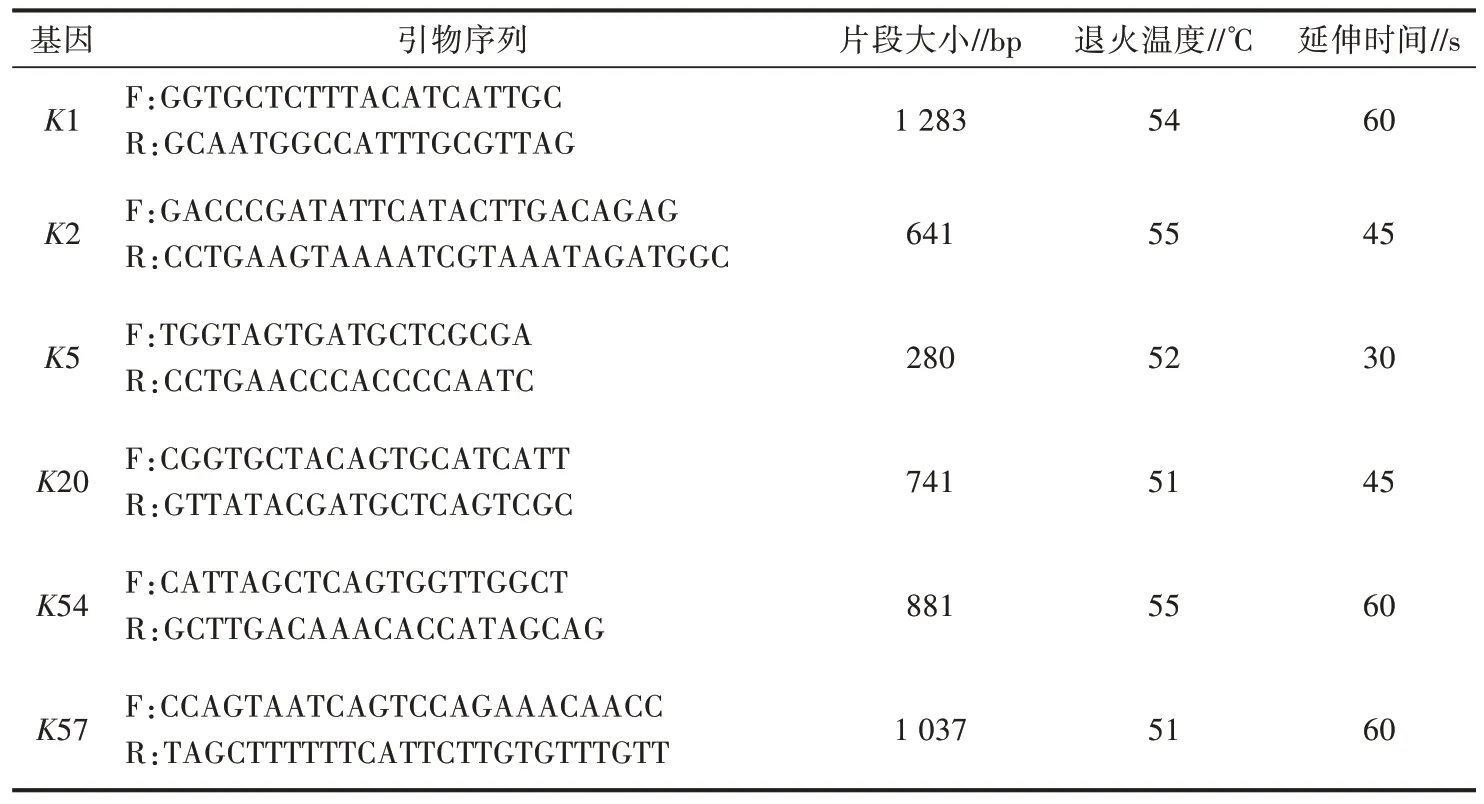
表1 血清型引物序列
1.2.6 毒力基因检测 参考文献[13-15]合成肺炎克雷伯菌6 类16 种毒力基因的引物序列,引物序列见表2。PCR 反应体系(25 μL)为2×Tap PCR MasterMix 12.5 μL,上、下游引物各0.5 μL,DNA 模板2.0 μL,dd H2O 9.5 μL。PCR 反应程序为94 ℃预变性5 min,94 ℃变性1 min,48~57 ℃退火1 min,72 ℃延伸30~60 s,共35 个循环;72 ℃再延伸10 min。
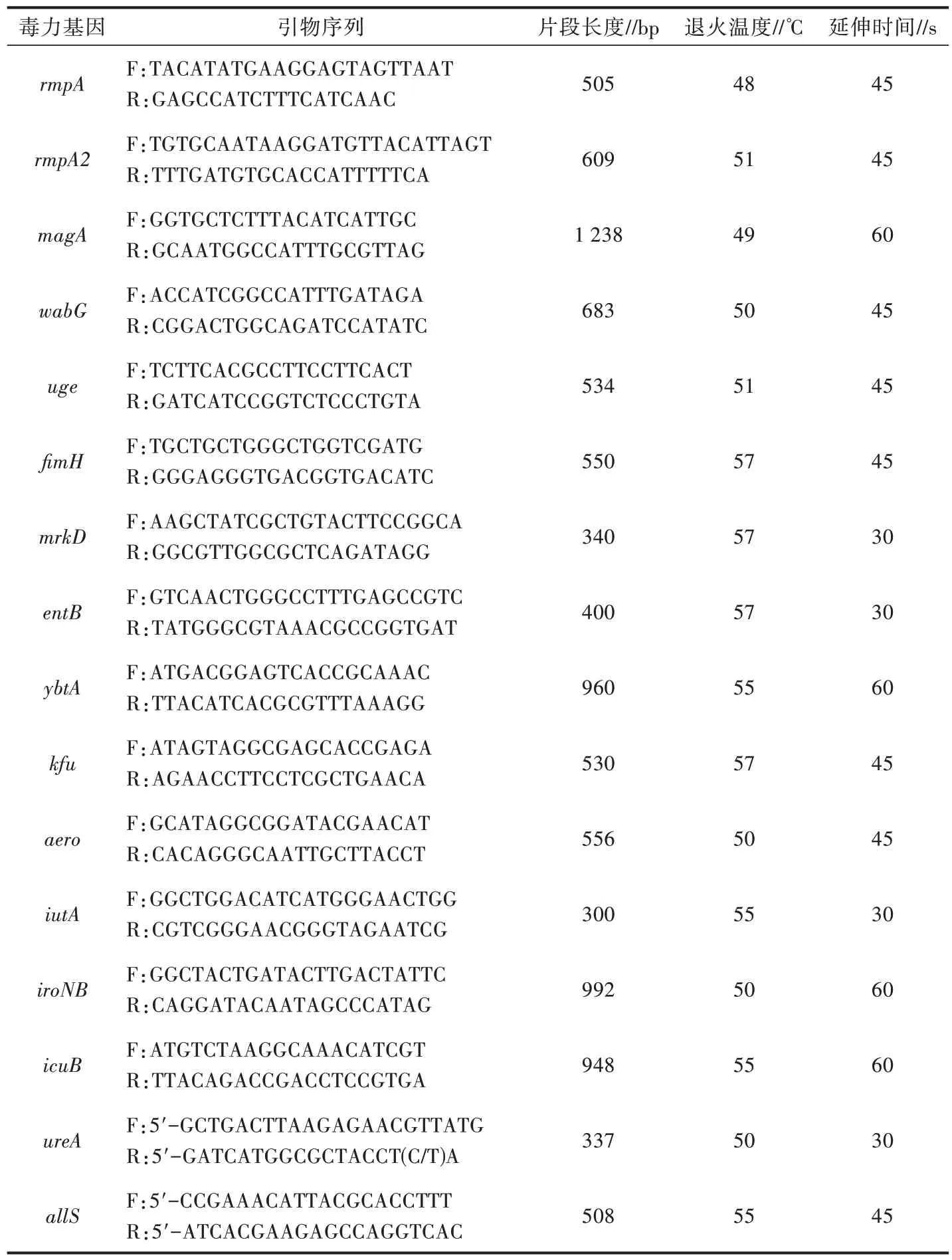
表2 毒力基因引物信息
1.2.7 药敏试验 采用纸片扩散法检测分离株对临床常用的22 种药物耐药性的敏感性,按照临床实验室标准化协会(CLSI)制定的标准作为判断依据(表3)。
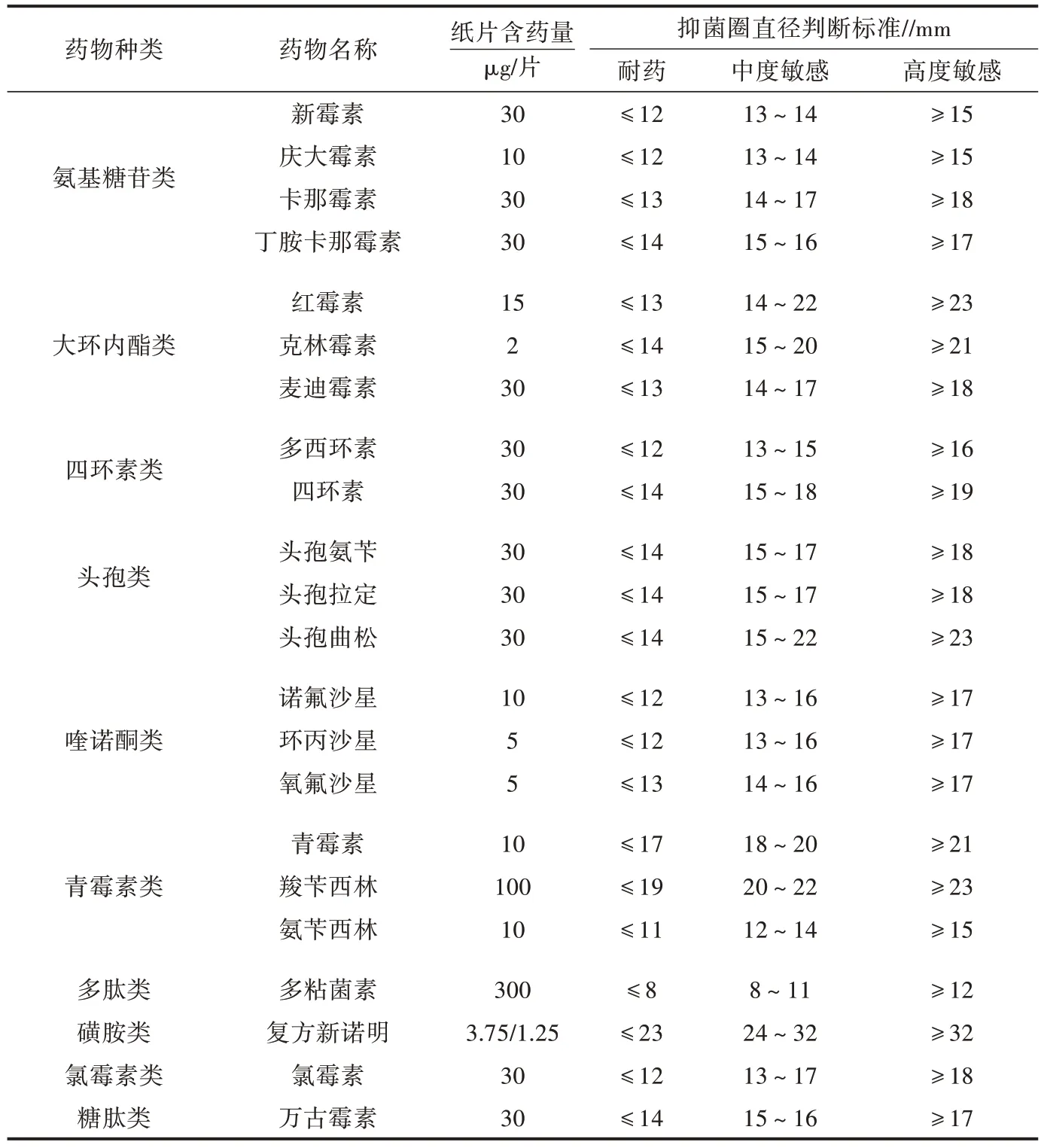
表3 药物敏感性判定标准
1.2.8 小鼠致病性试验 将分离菌株分别接种于营养肉汤中,置于37 ℃、180 r/min的摇床振摇12~18 h,以分光分度计为检测工具,将菌液经过生理盐水稀释成1×108CFU/mL 作为试验菌液。将40 只小鼠随机分为试验组与对照组,每组5 只,4 组试验组,4 组对照组;试验组各小鼠腹腔注射0.2 mL 菌液,对照组注射等量的无菌生理盐水,观察小鼠的发病与死亡情况并做好记录。对死亡小鼠进行解剖并取病变组织进行细菌分离。
2 结果与分析
2.1 细菌分离培养结果
将病死羊胸腔积液及肺脏组织进行细菌分离培养,初步筛选出4 株疑似肺炎克雷伯菌,分别命名为KLB-1、KLB-2、KLB-3、KLB-4,4 株 分 离 株 均 在MIAC 选择培养基上长出圆形、紫红色、有沉淀环的单菌落(图1A),在麦康凯培养基上长出圆形、粉红色的菌落(图1B);革兰氏染色镜检结果均为两端钝圆革兰氏阴性菌(图1C)。
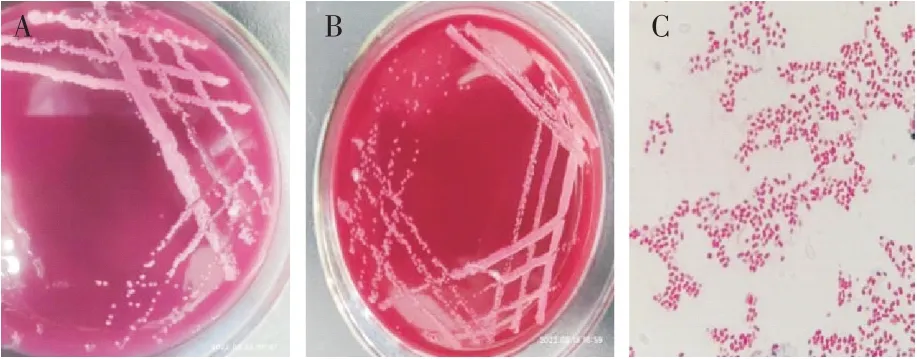
图1 分离菌株在MIAC 培养基(A)、麦康凯培养基(B)的菌落形态及革兰氏染色镜检(C)(1 000×)
2.2 细菌生化鉴定结果
经生化鉴定管检测显示,阿拉伯糖、乳糖、麦芽糖、木糖、甘露醇、山梨醇、肌醇、柠檬酸盐、MR、明胶酶呈阳性,氧化酶、VP、精氨酸、鸟氨酸、苯丙氨酸、硫化氢、吲哚呈阴性(表4)。4 株分离菌株的鉴定结果均符合肺炎克雷伯菌的生化特性。
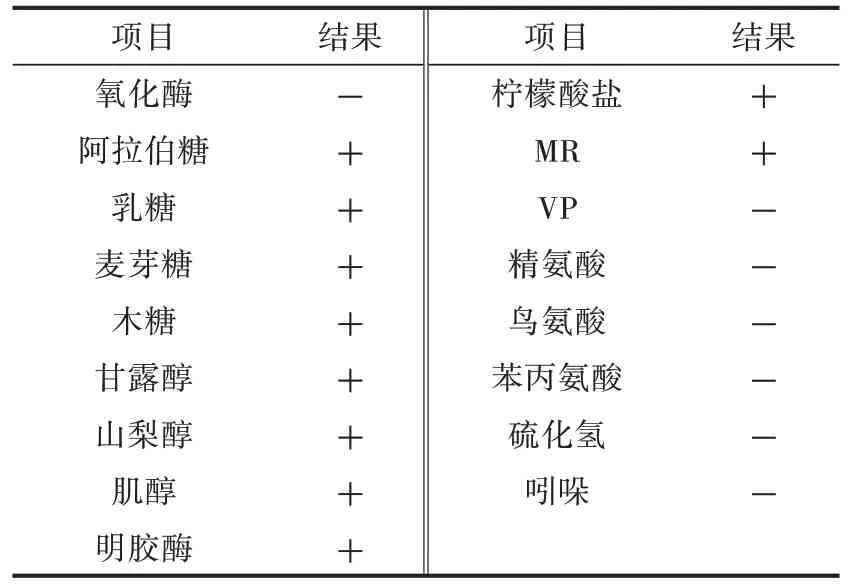
表4 分离株生化鉴定
2.3 16S rRNA基因检测及系统进化树的构建
使用16S rRNA 通用引物对4 株分离菌株进行PCR 扩增,电泳结果出现4 条1 500 bp 左右的条带(图2),符合预期目的片段大小。测序结果显示,4株分离株与GenBank 数据库中多个肺炎克雷伯菌参考株核苷酸相似性在97.4%~99.8%(图3),进一步明确分离菌株为肺炎克雷伯菌。从构建的系统进化树来看,分离菌株KLB-1、KLB-2、KLB-3、KLB-4 与登录号为KJ465988.1 的亲缘关系较近(图4)。
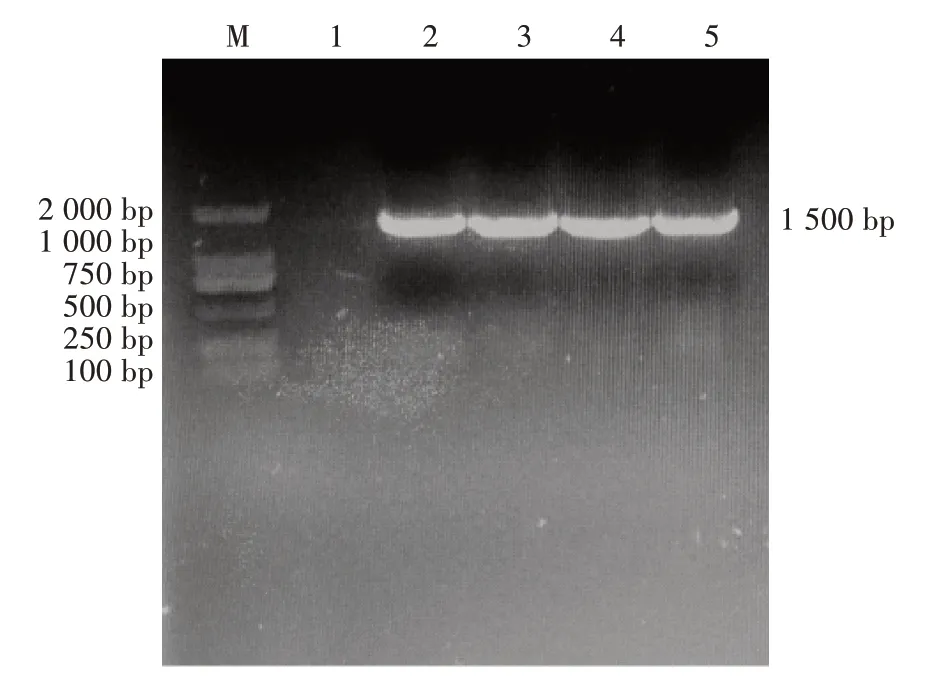
图2 分离菌株16S rRNA 基因PCR 扩增电泳结果
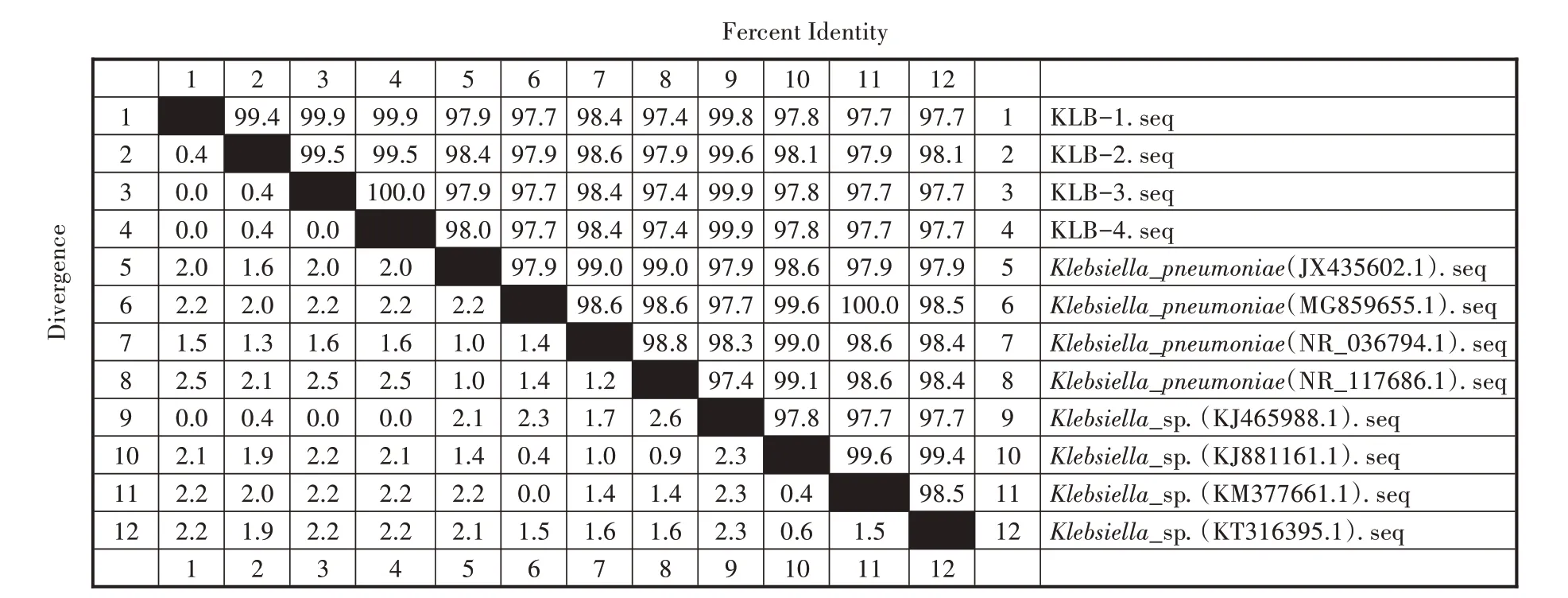
图3 基于16S rRNA 基因序列的相似性比对
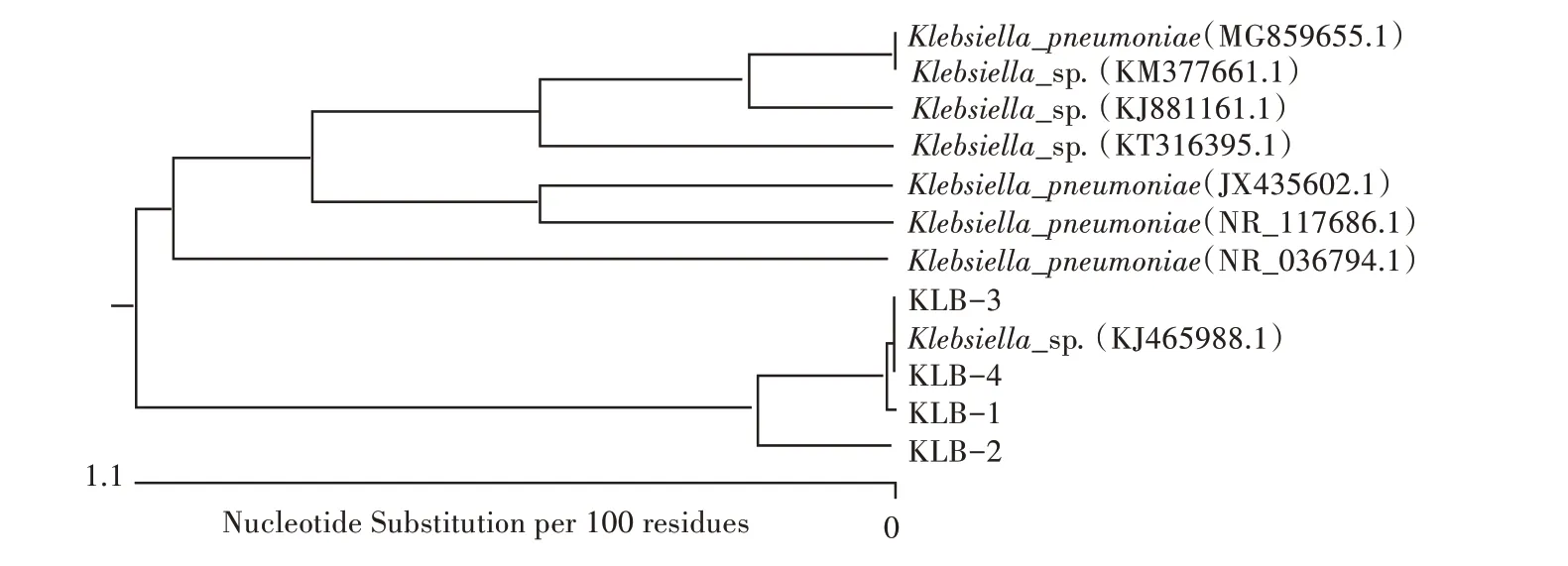
图4 基于16S rRNA 基因序列系统进化树
2.4 khe基因扩增结果
通过PCR 扩增4 株分离菌株特异性khe基因,电泳结果显示,出现428 bp 左右清晰且单一的条带(图5),与预期目的片段大小一致,进一步确定4 株分离菌株为肺炎克雷伯菌。
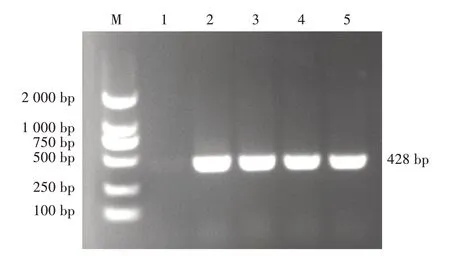
图5 肺炎克雷伯特异性khe基因电泳结果
2.5 荚膜血清型检测结果
通过PCR 检测明确4 株分离菌株血清型,将PCR 产物进行琼脂糖凝胶电泳,电泳结果显示,4 株分离菌株扩增条带均在1 283 bp 左右(图6),表明4株分离菌株均为K1 型。
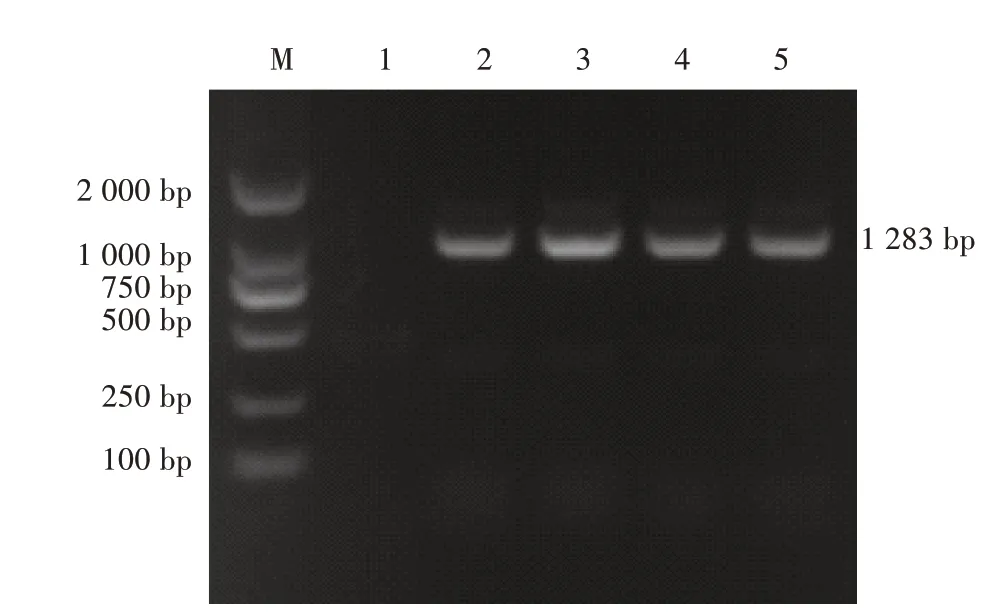
图6 分离菌株荚膜血清型PCR 鉴定电泳结果
2.6 毒力基因检测结果
对4 株分离菌株进行16 种毒力基因检测,共检出12 种毒力基因(图7)。uge、fimH、mrkD、entB、ybtA、iutA、ureA检出率为100%,wabG、areo检出率为75%,kfu、allS检出率为50%,magA检出率为25%,rmpA、rmpA2、icuB、iroNB检出率为0(表5)。

图7 分离菌株毒力基因电泳结果
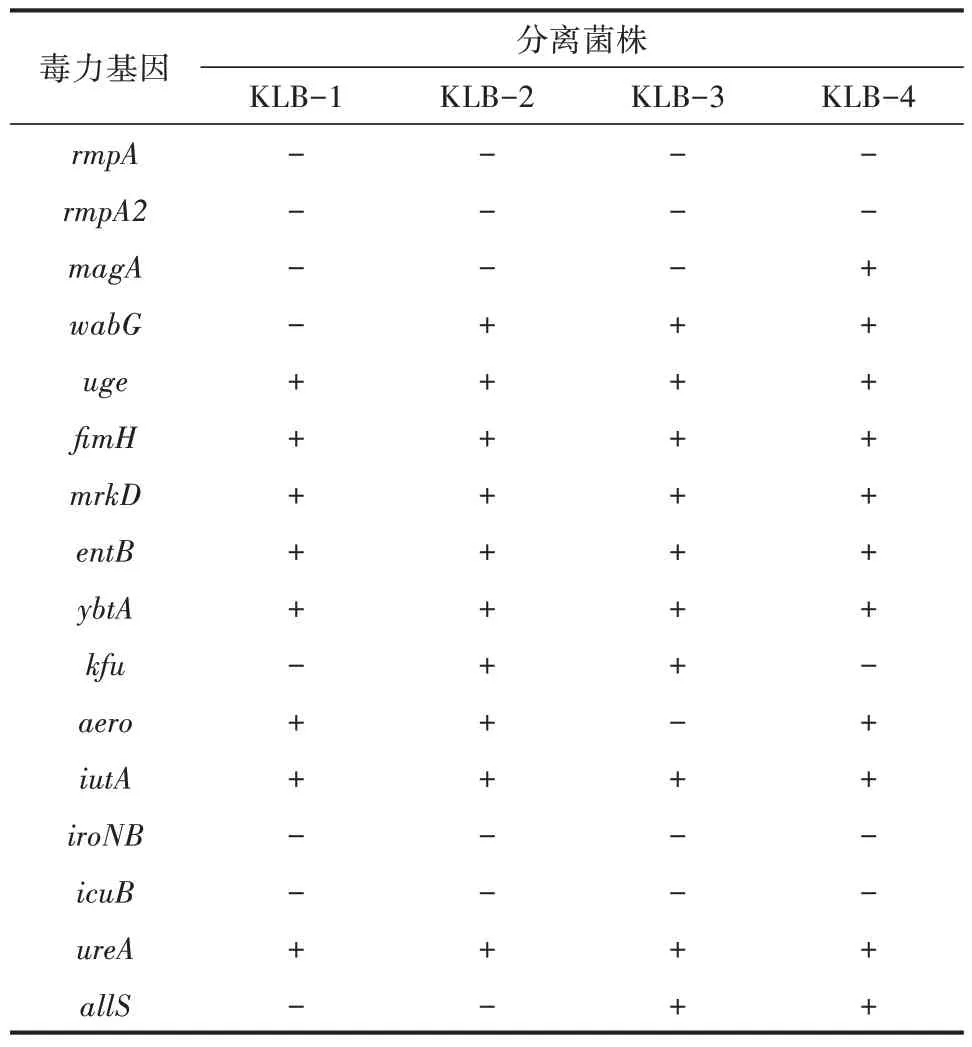
表5 毒力基因检测结果
2.7 药敏试验结果
22 种药敏试验结果显示,4 株分离菌株均对头孢曲松、氯霉素敏感,对多西环素、四环素、头孢氨苄、头孢拉定、诺氟沙星、环丙沙星、氧氟沙星不同程度敏感,对多粘菌素中度敏感,对新霉素、庆大霉素、卡那霉素不同程度耐药,对丁胺卡那霉素、红霉素、克林霉素、麦迪霉素、青霉素、羧苄西林、氨苄西林、复方新诺明、万古霉素耐药。对药敏试验数据统计分析发现,KLB-1、KLB-3 对10 种药物耐药,KLB-2、KLB-4 对12 种药物耐药,4 株分离株呈不同程度的多重耐药性(表6)。
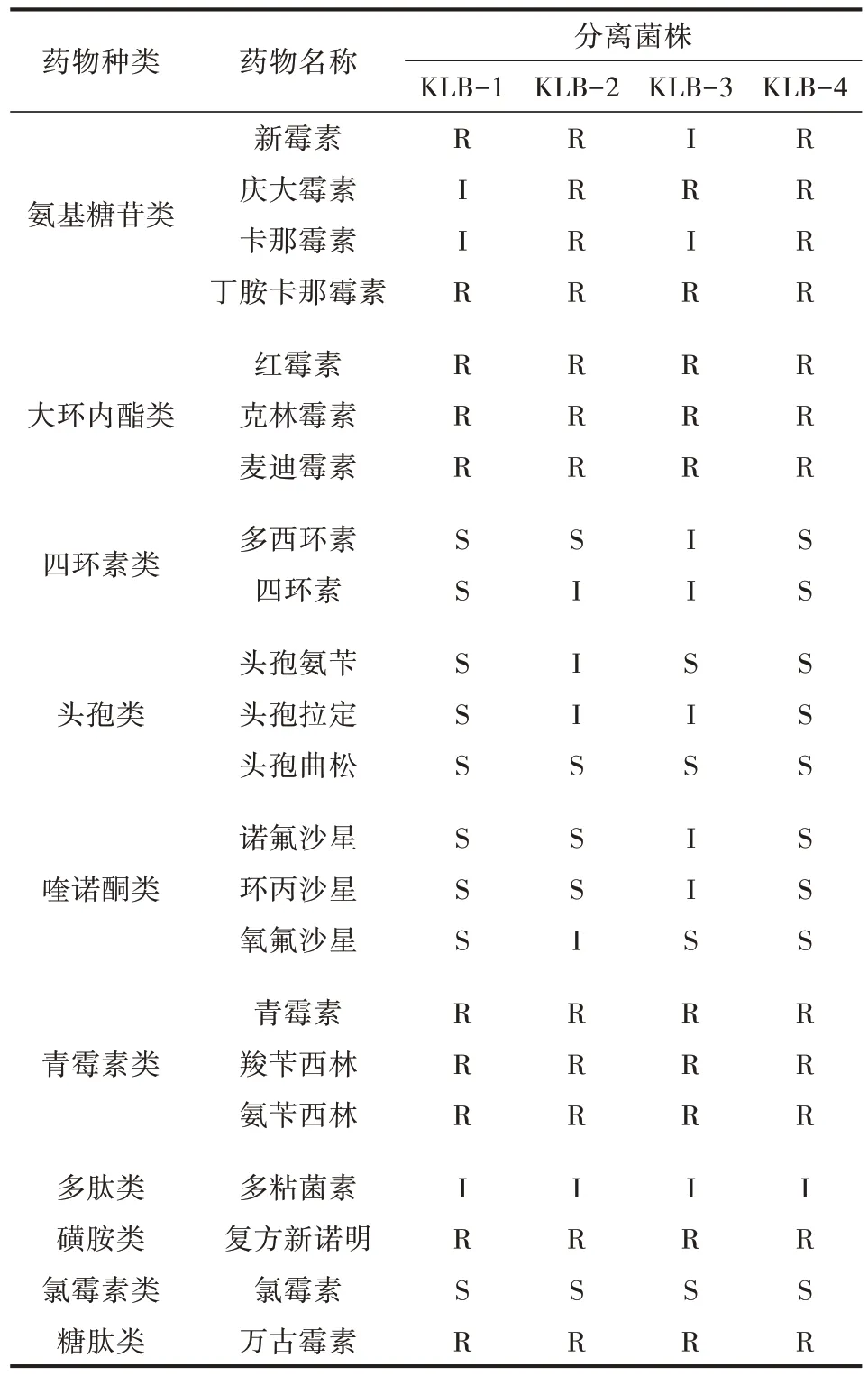
表6 药敏试验结果
2.8 小鼠致病性试验结果
试验组小鼠注射菌液及生理盐水6 h 后出现精神不振、扎堆畏寒现象;在12~24 h 内不断出现小鼠死亡情况,24 h 后,4 组小鼠死亡率分别为80%、100%、100%和100%。对照组小鼠未出现异常表现及死亡情况。剖解死亡小鼠肝脏均出现不同程度的淤血、肿大、质脆,脾脏淤血肿大。无菌采取肝脏、脾脏进行细菌分离培养,将单菌落进行khe基因PCR检测,检测结果均为阳性。表明分离菌株对小鼠均具有较强的致病性。
3 小结与讨论
随着规模化羊养殖业的不断发展,羊场呼吸性疾病[16]、腹泻性疾病[17]依然是阻挡羊养殖业健康发展的主要问题,其中不乏由肺炎克雷伯菌引起的呼吸性疾病,江都某养羊场200 头胡羊因感染肺炎克雷伯菌出现流鼻涕、咳嗽、呼吸急促等症状,最终造成30%死亡率[18]。范培超等[19]为了调查内蒙古通辽市某羊场发病羊死亡的原因,对疑似致病菌进行分离、鉴定及部分生物学特性研究,最终确定肺炎克雷伯菌是该羊场发病羊死亡的致病菌。赵洁雅等[20]从绵羊肺炎病例的病料中检测到克雷伯菌,最终确定该病情的病原为羊肺炎克雷伯氏菌。本研究对25 份具有呼吸道症状病死羊胸腔积液及肺脏组织中成功分离出4株肺炎克雷伯菌,分别命名为KLB-1、KLB-2、KLB-3、KLB-4。
khe基因是肺炎克雷伯菌体外溶血酵素基因,是鉴定肺炎克雷伯菌的金标准,为保证本研究的准确性,采用khe基因作为靶基因进一步确认。
肺炎克雷伯菌荚膜血清型主要有K1、K2、K5、K20、K54 和K57,其中K1、K2 为主要血清型,与细菌的侵袭性有关[21],本研究对4 株羊源肺炎克雷伯分离菌株进行血清学鉴定,结果显示4 株分离菌株均为K1 型,与张文举等[22]、左伟等[12]报道的优势血清型有一定差异,造成差异的原因可能是地域不同、感染宿主不同。
为了解4 株分离菌株毒力基因携带情况,本研究通过PCR 检测方法对4 株分离菌株进行16 个毒力基因检测,检测结果显示共检出12 种毒力基因,uge、fimH、mrkD、entB、ybtA、iutA、ureA检 出 率 为100%,wabG、areo检出率为75%,kfu、allS检出率为50%,magA检出率为25%,rmpA、rmpA2、icuB、iroNB检出率为0。分离菌株均呈多重毒力基因型,最多携带11 种毒力基因,与王哲红[6]报道的结果相近,肺炎克雷伯菌临床分离菌株携带多种毒力因子,引起相关感染。
随着抗生素在临床及养殖中泛用、滥用,多重耐药性的肺炎克雷伯菌的检出率不断升高。本研究对4 株分离菌株进行耐药性检测,结果显示,4 株分离株均对多粘菌素中度敏感,对新霉素、庆大霉素、卡那霉素不同程度耐药,对丁胺卡那霉素、红霉素、克林霉素、麦迪霉素、青霉素、羧苄西林、氨苄西林、复方新诺明、万古霉素耐药。与黄旭俊等[18]、范培超等[19]报道的分离菌株的耐药情况相比,本研究所分离出的4 株肺炎克雷伯菌具有更高的耐药性,可能与不同羊场用药方案有关。贾丽等[23]在治疗试验中采用了恩诺沙星和麻杏石甘散中西药结合应用于肺炎克雷伯菌,并取得了良好的治疗效果。因此,在选择治疗肺炎克雷伯菌的方案时,可结合传统中兽医治疗方案,不仅可以达到良好的治疗效果,同时可利用中草药不易产生耐药性减缓肺炎克雷伯菌耐药性的增长。
