铜死亡相关基因SLC31A1在肾细胞癌中的功能及预后价值
2023-10-30樊佳郑良建袁梦珍詹庭亭张榕珂张军
樊佳,郑良建,袁梦珍,詹庭亭,张榕珂,张军
(成都市第三人民医院肿瘤科,四川 成都 610000)
肾细胞癌是常见的泌尿道恶性肿瘤,大约15%的肾细胞癌患者诊断时已发生远处转移[1]。随着早癌筛查的不断普及,肾细胞癌的死亡率有了很大改善[2]。但由于肿瘤的异质性,肾细胞癌的复发率仍较高[3]。因此,预测肾细胞癌预后并指导个体化精准治疗方案,探索新的生物标志物显得尤为重要。铜死亡是一种新型细胞程序性死亡方式[4]。铜在正常范围内是一种机体代谢必须的辅助因子,当铜离子在细胞内含量超过阈值时会与线粒体中的脂酰化蛋白结合。脂酰化蛋白的聚集和铁硫簇蛋白的丢失共同诱导了蛋白质毒性应激反应,最终导致细胞铜死亡的发生[5]。本研究以免疫微环境相关性的角度出发,发现SLC31A1与部分肾细胞癌免疫浸润细胞呈正相关。SLC31A1是一种存在于细胞膜上的铜转运蛋白,在以往的研究中被发现与顺铂的耐药相关[6]。SCL31A1被认为与乳腺癌、肺腺癌、胰腺癌的预后相关[7-9]。但SCL31A1在肾细胞癌中的作用尚不清楚。基于此,本研究拟通过生物信息学分析和细胞实验的干湿结合方法共同探讨SCL31A1在肾细胞癌的预后生存和细胞功能中的作用。
1 材料与方法
1.1 数据来源
从UCSC Xena数据库(https://xena.ucsc.edu/)下载癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中的RNA-seq数据和临床数据[10]。
1.2 铜死亡相关基因在正常组织和肿瘤组织中表达差异分析
使用R语言中的“limma”包完成铜死亡基因在正常组织和肿瘤组织中的表达差异分析[11]。
1.3 免疫组化图像
铜死亡相关基因在正常肾组织和肾癌中的免疫组化图像下载自The human protein atlas (HPA)数据库[12]。
1.4 肿瘤免疫浸润分析
使用ssGSEA计算肾癌患者免疫细胞浸润得分[13],使用Spearman相关性分析计算免疫细胞浸润得分与铜死亡相关基因表达之间的关系。
1.5 临床分期相关性分析
使用R语言计算并比较不同临床分期组之间SLC31A1的表达情况,使用ggplot包进行数据可视化。
1.6 生存与独立预后分析
使用Kaplan-Meier (KM)分析SLC31A1表达和预后之间的关系。独立预后分析采用单因素与多因素COX分析。P<0.05为差异有统计学意义。
1.7 细胞实验相关药品及试剂盒
细胞培养基采用DMEM (Hyclone,USA);10%胎牛血清(FBS) (Hyclone,USA);抗生素采用青-链霉素双抗(索莱宝);胰酶(美国 Gbico);RNA提取采用总RNA提取试剂盒(上海飞捷);RNA逆转录采用Takara逆转录试剂盒。RT-qPCR采用Takara荧光实时定量qPCR试剂盒;细胞转染采用LipofectamineTM3000转染试剂(赛默飞);转染用培养基opti-MEM(美国 Gbico);转染细胞筛选采用嘌呤霉素(索莱宝);克隆形成实验固定细胞采用4%多聚甲醛(索莱宝);克隆染色采用草酸铵结晶紫染色液(索莱宝)。
1.8 细胞培养及RT-qPCR实验
将HK-293T细胞(Human embryonic kidney 293 cell)、786-O细胞(Renal cell carcinoma 786-O cell)、A498细胞(Human kidney carcinoma A498 cell)和769-P细胞(Renal cell carcinoma 769-P cell)置于5% CO2的37 ℃恒温孵箱中采用完全培养基培养。RNA提取:每例样本胰酶消化约5×106个细胞,采用硅胶柱纯化技术试剂盒提取总RNA。逆转录采用RT-qPCR技术将RNA提取物逆转录为cDNA。逆转录体系:2 μg总RNA提取物溶解于16 μL无酶水然后加4 μL ScriptTM Master Mix。实时荧光定量PCR:每组样品设置4个复孔。PCR体系为:cDNA 5 μL、无酶水3.2 μL、TB II SYBR®Premix ExTaqTM1 μL、前引物与后引物各0.4 μL。
1.9 肾癌细胞中过表达SLC31A1分子
SLC31A1过表达质粒购买自吉凯基因(上海吉凯基因医学科技股份有限公司)。采用6孔板进行细胞转染,在6孔板中细胞密度至70%~90%开始转染,主要体系为A:125 μL opti-MEM+5 μL lipo3000,B:125 μL opti-MEM+1~2.5 μg DNA+2~5μL P3000。将A和B轻柔混匀30 min后加入6孔板上清开始进行转染。24 h后采用嘌呤霉素筛选转染成功并转录过表达质粒的769-P细胞。
1.10 克隆形成实验及划痕实验
769-P野生型细胞株及SLC31A1过表达细胞株消化后分别置于6孔板中用于克隆形成实验及划痕实验。克隆形成实验细胞密度1 000个/孔,培养7 d或肉眼发现明显克隆形成后取出孵箱,弃培养基后PBS洗3遍,多聚甲醛固定后PBS洗3遍,随后数清楚各孔中克隆个数并完成统计学分析。划痕实验细胞密度1 000个/孔,待细胞贴壁后用枪头于孔中央划出划痕,于划痕后0 h和24 h观察划痕修复情况。
1.11 统计学分析
使用GraphPad Prism 8.0软件对数据进行统计学分析。两组间比较采用独立样本t检验;临床分期相关分析采用秩和检验(Kruskal-Wallis test);评估对肾细胞癌预后采用Kruskal-Meier分析,影响预后因素采用COX分析。P<0.05为差异有统计学意义。
2 结果
2.1 铜死亡相关基因在肾细胞癌中的表达情况
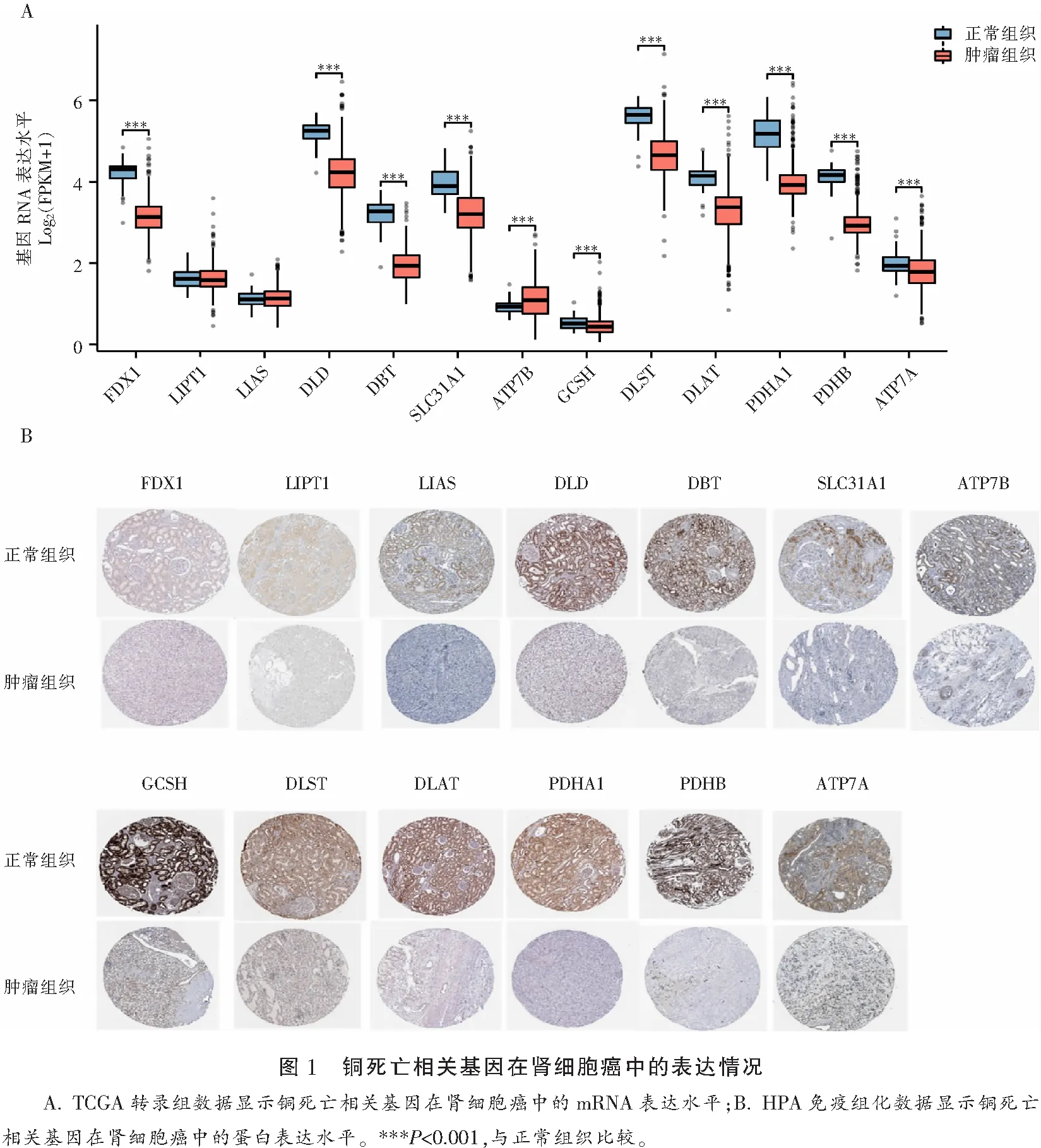
TCGA数据库转录组数据显示除ATP7B在肿瘤组织中呈相对高表达外,FDX1、DLD、DBT、SLC31A1、ATP7A、GCSH、DLST、DLAT、PDHA1、PDHB在肿瘤组织中表达水平均低于正常组织,差异具有统计学意义(P<0.05)。HPA数据库免疫组化数据集验证了TCGA的转录组数据,FDX1、DLD、DBT、SLC31A1、ATP7A、GCSH、DLST、DLAT、PDHA1、PDHB在肿瘤组织中的蛋白水平均低于正常组织(P<0.05)。见图1。
2.2 铜死亡相关基因在肾细胞癌中与肿瘤浸润免疫细胞的关系
在肾细胞癌中LIPT1、LIAS、GCSH、PDHA1、ATP7B等铜死亡相关基因主要与浸润免疫细胞负相关。而SLC31A1主要与浸润免疫细胞呈正相关,且正相关免疫细胞种类最多。SLC31A1与包括巨噬细胞、自然杀伤细胞、树突状细胞及B细胞等17种免疫细胞正相关(P<0.05)。见图2。

2.3 SLC31A1与肾细胞癌的临床分期相关性
鉴于SLC31A1在肾细胞癌中免疫浸润细胞呈正相关,通过TCGA转录组数据和临床信息对SLC31A1与肾细胞癌患者临床分期的相关性进行了进一步分析。结果显示在T分期中,SLC31A1在T3-4期中的表达水平低于T1期,差异有统计学意义(P<0.05)。在M分期中,SLC31A1在有转移M1期中的表达水平低于无转移M0期,差异有统计学意义(P<0.05)。SLC31A1在N分期中差异无统计学意义。在TNM分期中,SLC31A1在Ⅲ期及Ⅳ期的表达水平低于I期,差异有统计学意义(P<0.05)。见图3。
2.4 SLC31A1在肾细胞癌中的预后价值
为进一步探索SLC31A1在肾细胞癌中的预后价值,通过对TCGA的转录组数据与临床数据进行分析。生存分析显示,SLC31A1高表达肾细胞癌患者的PFS优于SLC31A1低表达的患者[HR:0.43(0.31~0.60),P<0.05]。SLC31A1高表达肾细胞癌患者的OS也同样优于SLC31A1低的患者[HR:0.51(0.38~0.70),P<0.05]。森林图结果显示SLC31A1在单因素和多因素COX分析中都是肾细胞癌预后的独立保护因素(P<0.05)。见图4。
2.5 SLC31A1在肾正常细胞与肾癌细胞系中的表达
通过RT-qPCR检测SLC31A1在肾正常细胞与肾癌细胞系的表达结果与免疫组化一致,SLC31A1在肾正常细胞HK293T的表达水平高于肾癌细胞系786-O、A498及769-P,其中SLC31A1在769-P细胞中的表达最低。故选用769-P细胞进行后续实验。见图5。
2.6 肾癌细胞模型中过表达SLC31A1
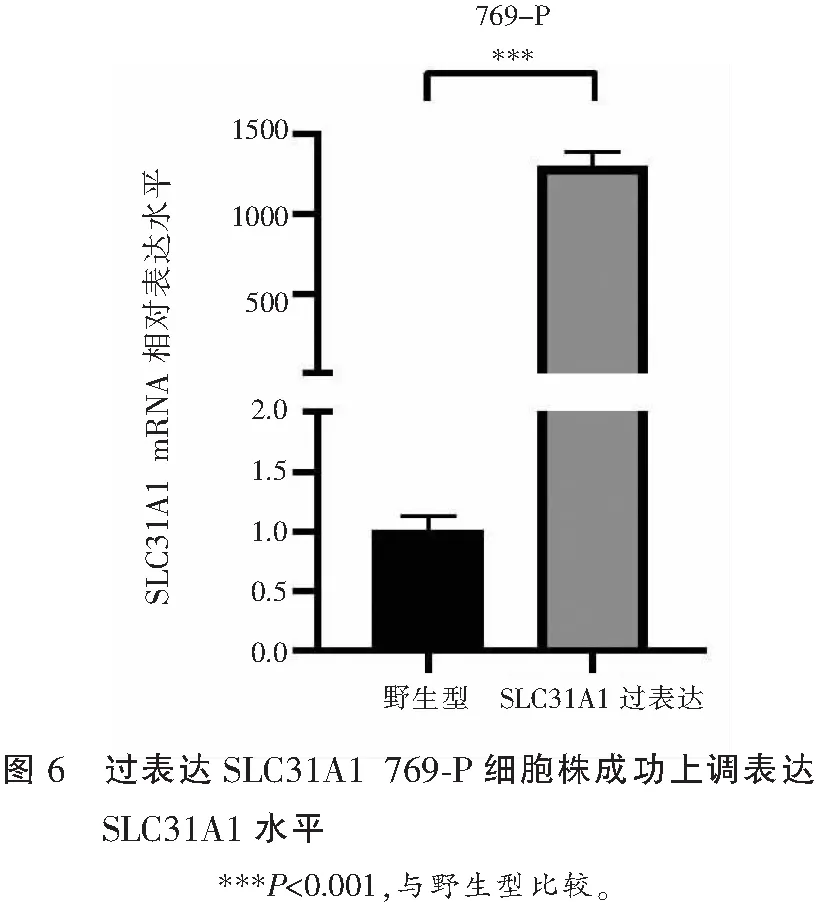
对SLC31A1表达量最低的肾癌细胞769-P转染SLC31A1过表达质粒并通过RT-qPCR检测SCL31A1的表达情况,结果显示转染过表达质粒后769-P细胞中SLC31A1的表达高于野生型769-P细胞,成功构建过表达SLC31A1 769-P细胞株。见图6。
2.7 过表达SLC31A1抑制肾癌细胞的增殖、侵袭能力
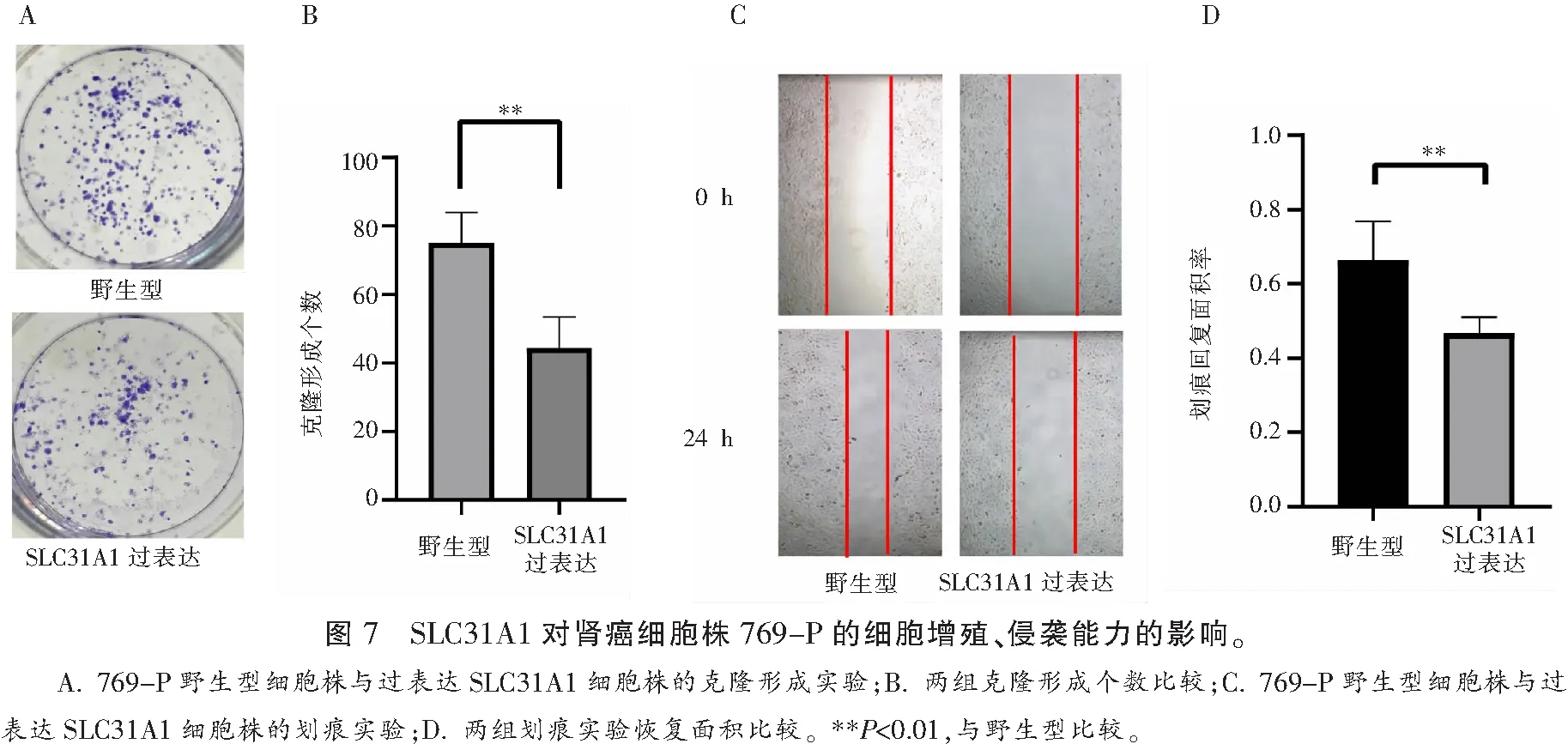
采用克隆形成试验和划痕实验检测并比较野生型769-P细胞株和过表达SLC31A1的769-P细胞株的细胞增殖和侵袭能力。克隆形成实验结果显示过表达SLC31A1的769-P细胞克隆形成数量低于野生型的769-P细胞,差异有统计学意义(P<0.05)。划痕实验结果也显示类似的趋势,过表达SLC31A1的769-P细胞株相对于野生型,其划痕修复能力下降,差异有统计学意义(P<0.05)。
3 讨论
肾细胞癌作为常见的泌尿道恶性肿瘤,复发转移仍是主要的失败模式[14]。细胞死亡一直是探索生物标记物的主要研究领域,多种程序性细胞死亡被发现在肿瘤预后及免疫预测上具有重要价值,包括焦亡、铁死亡等[15-16]。铜死亡作为新型细胞死亡方式,在作为生物标记物的作用并不明确。
铜死亡相关基因已在多种肿瘤中被发现与肿瘤的预后和免疫作用相关,如Hu等[17]发现铜死亡基因与肺腺癌的预后显著相关。Lv等[18]发现在铜死亡相关基因LIPT1、PDHA1和SLC31A1与黑色素瘤的预后显著相关,其中LIPT1与黑色素瘤的瘤内免疫抑制细胞Treg呈负相关。Li等[19]通过对胃癌转录组和单细胞测序数据分析发现,铜死亡相关基因可用于将胃癌分为两种不同的免疫微环境亚组,并建立预后模型准确判断胃癌的预后。
本研究全面分析SLC31A1在肾癌预后中的预测价值和肾癌细胞系的主要功能。我们发现在mRNA表达水平上,除了LIPT1,LIAS和ATP7B外的铜死亡相关基因在肾细胞癌中相对于正常组织呈低表达。来自HPA的数据也证实了这一点。这说明肾细胞癌的发生发展可能抑制了铜死亡相关基因的表达。我们在随后的免疫浸润细胞相关性分析中发现,SLC31A1与多达17种免疫浸润细胞正相关,包括了固有免疫中的巨噬细胞、树突状细胞等抗原提呈细胞,也包括适应性免疫中的CD4+T细胞、γδ T细胞及B细胞等肿瘤杀伤细胞。这可能是由于SLC31A1诱导铜死亡后产生免疫源性细胞死亡导致的。因此,本研究将重点研究SLC31A1在肾细胞癌中的作用。
临床特征相关性分析显示,SLC31A1表达水平与T分期、M分期和TNM分期负相关,说明SLC31A1可能在一定程度上具有抑制肾细胞癌侵袭或转移的能力。这种抑制能力可能实现了对生存分析的获益,随后的生存分析显示,SLC31A1高表达的患者无论是PFS还是OS都显著优于SLC31A1低表达的患者。单因素和多因素的COX分析森林图也显示SLC31A1是肾细胞癌预后独立保护因素。
为进一步验证SLC31A1对肾细胞癌侵袭增殖的抑制作用,本研究在肾细胞癌细胞系中对SLC31A1的表达水平进行调控。由于SLC31A1在肾细胞癌中呈低表达且可能的抑制癌细胞增殖功能,故上调了SLC31A1在肾细胞癌细胞系的表达水平,并观察其侵袭增殖能力。结果发现SLC31A1过表达的肾癌细胞相对于野生型细胞的克隆形成和划痕修复能力出现了被抑制的现象。这从体外实验层面证实了SLC31A1具有抑制肾细胞癌增殖侵袭的功能。
SLC31A1是一种存在于细胞膜上的高亲和力铜转运蛋白,SLC31A1的上调可以正向调整铜离子进入细胞内从而导致铜死亡的发生[20]。因此,SLC31A1对肾细胞癌的抑制作用的机制可能与铜死亡的发生相关,这种抗原性细胞死亡模式同时可能也是SLC31A1与免疫细胞浸润正相关的主要原因。
综上,SLC31A1可能具有对肾细胞癌侵袭增殖的抑制作用。另一方面,SLC31A1同样为作为一个强有力的预后生物标志物用于预测肾细胞癌患者的预后,有助于肾细胞癌的临床决策。
