再妊娠妇女妊娠中晚期及产褥期骨代谢状况研究
2023-10-30赵珏王慧齐彩霞王琪琦郭心
赵珏 王慧 齐彩霞 王琪琦 郭心
正常情况下,骨形成与骨吸收处于动态平衡以维持骨的正常生理结构,而女性处于妊娠期特别是妊娠中晚期时,因胎儿生长发育需求,从母体摄取的营养元素与微量元素大量增加,导致母体骨矿被消耗[1]。若孕期补钙不足可导致骨吸收与骨形成失衡,造成骨量丢失,进而妊娠期骨代谢异常,增加母儿不良结局[2]。有研究显示,产褥期女性雌激素处于低水平,而哺乳需求导致其每日要丢失一定量的钙,故易发生骨量丢失[3]。产褥期骨代谢的研究报道较少,研究结论也有所差异,但提示了骨代谢异常可贯穿于女性整个妊娠期及哺乳期。近年我国进一步优化生育政策,2021 年鼓励“三孩”,为妇产科的围产期保健工作带来了新的挑战[4]。国内鲜少对再妊娠妇女妊娠期和产褥期骨代谢状况进行研究,导致临床解决再妊娠妇女围产期骨代谢异常问题存在较多的争议和疑惑。因此,本研究拟通过观察再妊娠妇女妊娠中晚期及产褥期的骨代谢相关指标的变化情况,了解再妊娠妇女围产期的骨代谢特点,为解决临床有争议或困惑的问题提供研究数据,并为妇女围产期补钙提供一定的指导,现报道如下。
对象与方法
一、研究对象
采用前瞻性队列研究,以2019 年4 月至2022年4 月于本院进行定期产检的孕妇作为研究对象,孕妇及其家属均对本研究知情并签署同意书。纳入标准:①孕26 周前于本院建卡;②年龄25~40岁;③孕期肝功能、凝血功能等检查均正常;④单胎、宫内妊娠;⑤产后计划母乳喂养。排除标准:①伴有影响消化道功能疾病(如糜烂性胃炎、胃溃疡);②具有习惯性流产史;③伴有精神障碍疾病;④临床骨代谢指标检查前服用钙剂;⑤近期伴有感染性疾病;⑥妊娠前伴有骨质疏松、骨代谢疾病。剔除及脱落标准:①因各种原因未进行妊娠中期(22~27+6周)、晚期(28~34 周)、产褥期(产后42~50 d)追踪;②因自身原因主动退出本次研究;③研究期间出现严重性孕期不良事件(如流产、严重性并发症需终止妊娠)。根据孕妇自我报告的产次情况分为再妊娠孕妇(再妊娠组,距离上次妊娠时间≥2 年,妊娠1~2 次)及初妊娠孕妇(初妊娠组),同时每组按照年龄段划分为3个层次(25~30 岁、31~35 岁、36~40 岁)。采用两样本均数的计算公式计得所需样本量为86 例,考虑到研究过程中可能出现10%左右的脱落样本量,确定样本量至少为190 例,最终纳入样本量为200例。按照随机数字表法将患者分为再妊娠组和初妊娠组,每组100 例。本研究方案经本院医学伦理委员会审核批准(批件号:20181103)。
二、方 法
1.研究方案设计
入组孕妇分别于妊娠中期(22~27+6周)、晚期(28~34 周)、产褥期(产后42~50 d 内)各行1 次血清骨代谢指标检测,包括甲状旁腺激素(PTH)、骨钙素N 端中分子片段(N-MID)、25-羟维生素D3[25( OH)D3]、β-胶原降解产物(β-CTX)、Ⅰ型前胶原羧基端前肽(PICP);第一次骨代谢指标检测完成后,所有孕妇均给予600 mg 钙和125 U维生素D3口服,每日1 次,然后于孕妇定期产检时评估其补钙情况,并参照《孕前和孕期保健指南(2018)》适当调整孕妇补钙或饮食方案(孕前期开始每日补充钙剂至少600 mg),直至分娩[5]。于产褥期对再妊娠妇女进行骨密度(BMD)检测并记录妊娠期并发症情况[如亚临床甲状腺功能减退(甲减)、妊娠期糖尿病(GDM)]。
2.血清代谢指标的检测
所有检测项目均由医院检验中心完成测定。采集所有入组对象清晨(7~9 点)空腹(空腹时间>8 h)外周静脉血2 份各3~5 mL,以2 500 r/min 分离心10 min,取血清,其中一份采用放射免疫法在2 h内完成血清PTH 检测,试剂盒购自深圳迈瑞生物医疗电子股份有限公司;另一份置于2~8 ℃冰箱内保存,采用电化学发光法于5 d 内上机测定N-MID、PICP、β-CTX、25(OH)D3水平,检测仪器为德国罗氏Cobas E602 全自动电发光免疫分析仪及配套试剂。本院血清骨代谢指标参考值范围:PTH 15~65 ng/L,N-MID 11.0~46.0 μg/L,PICP 绝 经 前15.1~58.6 ng/L、绝经后20.3~75.3 ng/L,β-CTX 绝经前< 573.0 ng/L、绝经后< 1 008.0 ng/L;25(OH)D3< 12.0 μg/L 为维生素D3缺乏,12.0~< 20.0 μg/L 为维生素D3不足,20.0~50.0 μg/L 为维生素D3正常,25(OH)D360.0~120.0 μg/L 提示存在不良反应风险,25(OH)D3>200.0 μg/L 提示中毒。
3.BDM 的测定
再妊娠产妇于产褥期接受双能X 线骨密度仪(莱福医疗设备有限公司,LM-LUX 型)检查,具体方法:受检者取仰卧位,下肢置于腰椎检查垫上,双上肢自然放置于胸前,右侧下肢内旋15~25 °,双脚固定于仪器专用模具两侧;调整仪器参数:电压140 kV,电流2.5 mA,扫描长度为16 cm,扫描宽度为11 cm,扫描时间为16 s,扫描部位包括正位腰椎(L1~L4)及左侧股骨颈,获得理想图像后利用仪器软件自动获得BMD,所有测量均由同一名经验丰富的技术人员在同一台机器上按标准流程操作完成。参照《原发性骨质疏松症诊疗指南(2017)》判断其骨量情况,T-值≥-1.0 为骨量正常;T-值<-1.0 为骨量异常。其中T-值=(实测值-同种族同性别正常青年人峰值BMD)/同种族同性别正常青年人峰值BMD 的标准差[6]。
4.妊娠期相关并发症评估方法
参照《成人甲状腺功能减退症诊治指南》,实验室检查如发现血清TSH 增高、FT4正常则评定为亚临床甲减(包括较少出现的甲减,即血清TSH 增高、FT4降低,也归为亚临床甲减)[7]。另外于孕24~28周及孕28 周后行75 g OGTT,空腹及服糖后1 h、2 h 的血糖值分别< 5.1、10.0、8.5 mmol/L。任何一点血糖值达到或超过上述标准即诊断为GDM[8]。
三、观察内容
比较不同妊娠情况及不同年龄段孕妇的孕中晚期、产褥期的骨代谢指标情况,记录再妊娠孕妇骨代谢异常情况及与骨代谢相关妊娠期并发症情况,分析不同骨代谢状况下再妊娠孕妇妊娠期并发症的发生情况。
四、统计学处理
使用SPSS 25.0 软件分析数据。用Shapiro-Wilk 正态性检验分析计量资料正态性;符合正态分布者以表示,2 组间比较采用t 检验,多组间比较采用单因素方差分析,组间两两采用LSD-t检验;不符合正态分布者用M(P25,P75)表示,3 组间比较采用Kruskal-Wallis H 检验;重复测量的计量资料用广义估计方程进行分析。计数资料用百分比表示,行χ2检验或连续性χ2校正。采用GraphPad Prism 8.0 绘制箱式图、柱状图。P < 0.05为差异有统计学意义。
结 果
一、研究对象的一般情况
本研究共纳入205 例孕妇,再妊娠组102 例、初妊娠组103 例,其中观察组2 例主动退出研究,对照组2 例主动退出研究、1 例失访,均予剔除。最终纳入200 例,其中再妊娠组100 例、初妊娠组100例。再妊娠组中25~30 岁17 例、31~35 岁55 例、36~40 岁28 例,孕 前BMI(21.89±2.30)kg/m2,受教育程度为高中及以下14 例、大专52 例、本科及以上34 例。初妊娠组中25~30 岁20 例,31~35 岁50例,36~40 岁30 例,孕前BMI(21.70±2.29)kg/m2,受教育程度为高中及以下17 例、大专55 例、本科及以上28 例。2 组孕妇的年龄、孕前BMI、受教育程度比较差异均无统计学意义(P 均> 0.05)。
二、不同妊娠情况妇女在孕中晚期及产褥期的血清代谢指标情况比较
2 组在孕晚期、产褥期的N-MID、β-CTX 水平均比妊娠中期升高,25(OH)D3、PICP 水平均比孕中期降低(P 均< 0.05);2 组在产褥期的PTH、β-CTX 水平均比孕晚期升高,25(OH)D3、PICP水平均比孕晚期降低(P 均< 0.05);但在孕中晚期及产褥期,2 组的PTH、N-MID、25(OH)D3水平比较差异均无统计学意义(P 均> 0.05);再妊娠组妊娠中晚期、产褥期的β-CTX 水平高于初妊娠组,PICP 水平低于初妊娠组(P 均< 0.05)。见图1。
三、不同年龄段再妊娠妇女血清代谢指标情况比较
不同年龄段再妊娠妇女妊娠中期、晚期及产褥期的血清PTH、N-MID、β-CTX、PICP 水平比较差异无统计学意义(P > 0.05);25~30 岁年龄段再妊娠妇女在妊娠中晚期、产褥期的25(OH)D3水平均较高(P < 0.05)。见表1。
四、不同骨代谢状况下再妊娠妇女妊娠期并发症情况
100 例再妊娠妇女中24 例出现骨量异常,占24.0%。骨量异常者的亚临床甲减、GDM 发生率均高于骨量正常者(P < 0.05)。见表2。
讨 论

图1 不同妊娠情况妇女妊娠中晚期及产褥期血清代谢指标比较

表1 不同年龄段再妊娠妇女妊娠中晚期及产褥期血清代谢指标情况比较
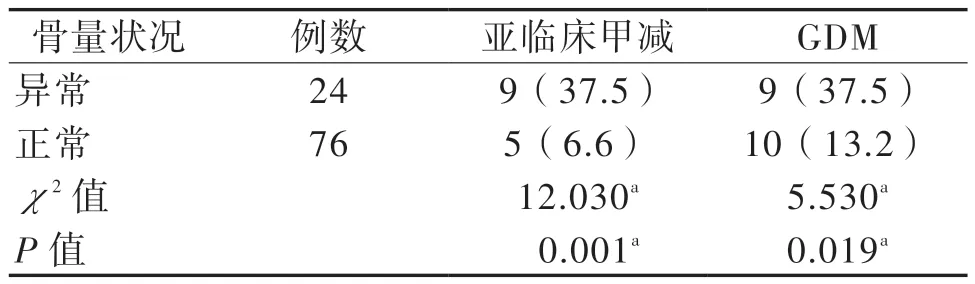
表2 不同骨代谢状况下再妊娠妇女妊娠期并发症情况[例(%)]
本研究显示,妊娠中晚期、产褥期产妇的骨代谢指标紊乱,妊娠情况与β-CTX、PICP 水平有关。因妊娠早期,雌激素、催乳素等含量升高,促进成骨细胞分化、增殖和成熟,而成骨细胞可增加钙吸收导致骨盐形成,故妊娠早期一般不会出现明显的骨丢失。妊娠中晚期时母体的骨吸收加快,且胎儿对钙需求增加,可能促使母体骨密度降低,易造成母体骨代谢紊乱。临床研究证实妊娠次数越多,骨丢失越多,越容易发生骨质疏松症,一般骨量丢失在产后1~4 年后逐步恢复正常,但女性再次妊娠时间一般在初次分娩2 年后,这导致了产妇随着产次的增加其骨量丢失的风险增加[9]。
但本次研究也显示,在妊娠中晚期、产褥期,妊娠次数与25(OH) D3、PTH、N-MID 的变化无关。25(OH)D3的合成主要受营养、光照等影响,而妊娠次数与25(OH)D3的关系目前尚不明确,仍需探讨。虽然PTH 既刺激骨形成也刺激骨吸收,但其水平变化同时也受到多种因素的影响,比如妊娠期用药、应激反应、环境改变、营养状况等。N-MID 可直接反映成骨细胞的活性,其水平的变化同样受到多种因素的影响,如PTH、药物、营养状况等影响。但临床研究发现,N-MID 是一项灵敏度、特异度较高的指标[10]。其在本研究中变化不明显的具体原因不明确,还需深入分析。
年龄对骨密度的影响已经达成了共识,但不同妊娠年龄段再妊娠妇女的妊娠中晚期与产褥期的骨代谢变化研究较少。本研究显示再妊娠妇女的年龄与25(OH)D3有关。女性20~30 岁时骨量储备尚未达峰值,表现为骨转换较为活跃;孕期母体为满足胎儿生长发育及维持自身钙的稳定表现为相对较低的骨密度;31~35 岁年龄段的骨量维持最为稳定,可在一定程度上缓解孕期的骨量丢失程度;而36~40 岁年龄段可出现少量骨丢失,孕期可发生骨代谢紊乱[11]。但本研究中25~30 岁的再妊娠妇女在妊娠晚期和产褥期25(OH)D3水平最高,与上述理论存在一定的矛盾。这可能由于25(OH)D3含量表达虽然可能影响骨密度,但大多数再妊娠妇女以最好的状态进行备孕,在妊娠早期通过调整饮食满足妊娠期对钙及其他微量元素的需求;且年龄相对较小的孕妇进行户外活动可能相对较多,这导致了25~30 岁的再妊娠妇女体内25(OH)D3含量相对较高。
本研究还显示,骨量丢失与GDM、亚临床甲减存在一定的关系。胰岛素可与成骨细胞表面受体相结合刺激成骨细胞核苷合成,促进骨胶原合成,增加骨骼中钙沉积,当胰岛素水平不足可导致成骨细胞数量减少,骨基质及骨转化下降;胰岛素具有抑制腺苷酸环化酶的作用,其含量降低时,腺苷酸环化酶抑制作用减弱,环磷酸腺苷合成增多,可刺激骨吸收[12-13]。妊娠期亚临床甲减可导致脂代谢异常,促使骨矿物质含量降低,引起骨量丢失,但其具体的机制尚不明确[14]。
综上所述,再妊娠妇女妊娠中晚期及产褥期的β-CTX 水平高于初妊娠妇女,PICP 水平低于初妊娠妇女。年龄、妊娠次数可影响部分骨代谢指标水平,且骨量异常者的妊娠期并发症发生率较高。
