镍催化下乙腈为氰源的芳基三氟甲磺酸酯氰化反应
2023-10-30沈增明
周 堃, 沈增明
(上海交通大学 化学化工学院,上海 200240)
芳香腈广泛存在于天然产物、药物分子、先进功能材料、农药和染料中[1].除此之外,氰基在有机合成中作为重要中间体,可以高效地转化成酰胺、胺、醛、四唑以及羧酸类衍生物[2].近30年来,过渡金属催化的氰化反应研究不断涌现,极大地丰富了氰化反应的路径.最为经典的是过渡金属催化的芳香族卤代烃转化为芳香族腈类化合物的研究,使用的氰源主要为氰化钾(KCN)[3-5]、K4[Fe(CN)6][6-8]、三甲基腈基硅烷(TMSCN)[9-10]和丙酮氰醇[11-13]等.采用金属氰化物的反应大多具有速度快、条件温和、收率高的特点.但是,金属氰源也存在许多缺陷:①剧毒性;②过渡金属与氰根负离子有着较强的配位作用,容易使催化剂失活;③使用金属氰化物,会造成大量金属离子的浪费并造成环境污染.目前金属钯催化的芳基卤代烃氰化反应取得了很大进展[14-15],但由于钯的价格较为昂贵,科学家们逐渐将目光转向廉价金属催化的氰化反应.深入研究发现镍不仅价格低廉,而且在催化芳基卤代烃和芳基磺酸酯的官能团转化方面具有优异的反应活性,因此,镍催化剂在氰化反应中也体现出显著优势[16-20].然而,目前关于镍催化的芳基磺酸酯氰化反应的报道还很少[21-24].因此,开发出一种有效实用的方法来合成芳基腈依然是目前有机合成领域中的热门研究方向.
近10年来,沈增明课题组一直致力于开发乙腈作为绿色、廉价、低毒的氰源来实现高效的氰化反应.将简单的有机腈作为氰源可以解决催化剂失活和金属氰化物具有剧毒的问题,目前在这一方面已取得一定进展[25-27].关于镍催化的简单有机腈作为氰源,Luo等[28]报道在钯或镍的催化下,使用乙腈作为氰源,在160 ℃加热条件下,使C—C键发生断裂,实现了芳基卤代物的氰化反应.然而,该方法明显的缺陷是其反应条件苛刻,使用大量配体,而且底物普适性较差.之后,Yu等[22]发现在镍催化下,含有β-H的烷基腈可以被用作氰基化试剂来实现芳基卤代烃和芳基三氟甲磺酸酯的氰化反应.但是,在该工作中像乙腈这种没有β-H的氰源并不能反应.而本文第一次实现镍催化下使用乙腈作为有机氰源的芳基三氟甲磺酸酯的氰化反应,该反应中添加剂Zn(OTf)2起到至关重要的作用.相比较Yu等[22]的工作,本文提出了一种完全不同的反应机理.
1 实验部分
1.1 反应条件的优化
图1展示了先前的相关工作[22, 28]与本文工作中氰化反应的方法.为了实现本文所提反应方法,首先对反应条件进行优化.
如表1所示,首先,以4-苯基三氟甲磺酸苯酯作为模板底物(2a),在含有物质的量分数为0.1的 Ni(OTf)2和物质的量分数为2.5的 Zn粉的体系下,对一系列的配体进行筛选(条目1~4),其中包括1, 4-双(二苯基膦)丁烷(dppb)、1,2-双(二苯基膦)乙烷(dppe)、1,1′-双(二苯基膦)二茂铁(dppf)和1,3-双(二苯基膦)丙烷(dppp). 当筛选到物质的量分数为0.1的dppp时,以70%的产率得到了目标氰化产物4-氰基联苯(3a,见条目4).而当使用其他镍催化剂,如Ni(acac)2和NiCl2时,产率有所下降(条目5~6).为进一步提高反应的产率,尝试向体系中加入添加剂(条目7~11).可以看出,当使用物质的量分数为0.2的 Zn(OTf)2时,目标氰化产物3a的产率可以提升到88%(条目11).随后在该条件下,将锌粉的用量减少至物质的量分数为2,目标产物的产率几乎维持不变(条目12).而当体系中不存在锌粉时,反应不能顺利启动(条目13),说明Zn粉对反应是必须的.最后,对反应的温度进行调整(条目14~15),当反应温度为100 ℃时,得到最高的产率89%(条目 14).该反应条件作为最优条件,即物质的量分数为0.1的Ni(OTf)2作为催化剂,物质的量分数为0.1的dppp作为配体,物质的量分数为2的Zn粉作为还原剂,物质的量分数为0.1的 Zn(OTf)2作为添加剂,0.7 mL CH3CN作为溶剂和氰源,在氮气保护下,100 ℃加热反应60 h.
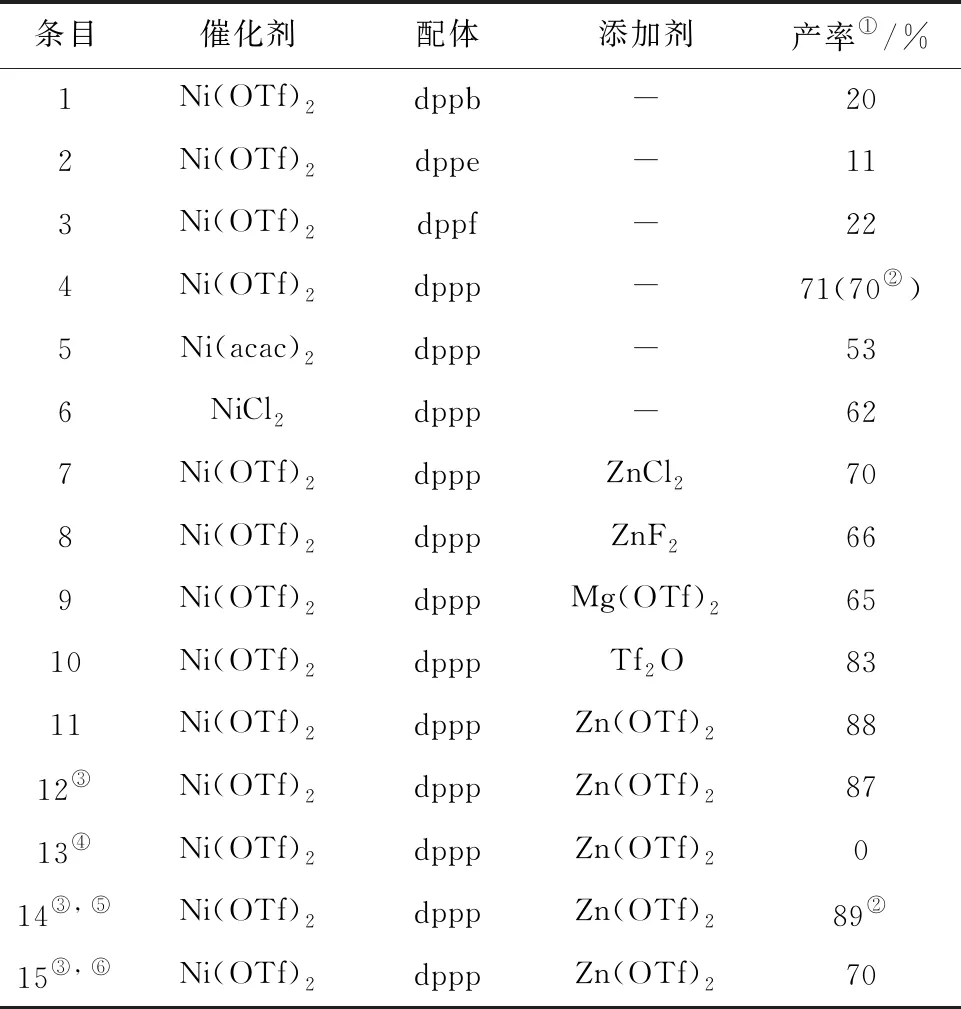
表1 芳基三氟甲磺酸酯氰化反应的条件筛选
1.2 反应的底物拓展
得到反应的最佳条件后,对含有各种不同取代基的三氟甲磺酸酯取代的苯及其衍生物进行普适性和局限性研究,如图2所示.反应条件为:氮气条件下,将0.3 mmol底物,物质的量分数为0.1的 Ni(OTf)2,物质的量分数为0.1的dppp,物质的量分数为0.2的Zn(OTf)2和物质的量分数为2的锌粉在0.7 mL乙腈中,100 ℃下加热搅拌60 h;对于三氟甲磺酸-1-萘酯的底物,反应条件需降温至80 ℃,并使用物质的量分数为0.5的Zn(OTf)2代替物质的量分数为0.2的Zn(OTf)2.图中,89%等为分离产率.
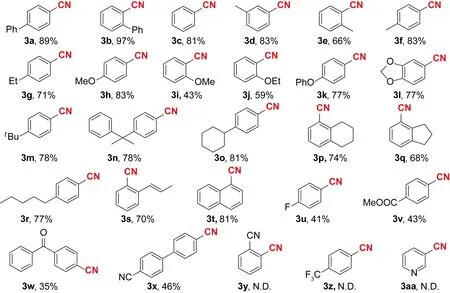
图2 芳基三氟甲磺酸酯氰化反应的底物拓展
由图可见,当含有给电子取代基的芳基三氟甲磺酸酯作为底物,无论取代基是位于苯环的邻位、间位还是对位,产物都具有优秀的产率.例如,在苯环的邻位、间位或对位具有Ph、Me、MeO、EtO、t-Bu等基团的底物,能以良好至优异的产率生成氰化产物 (3a~3r).在苯环的邻位上带有烯丙基的底物(2s)以70%的产率生成产物(3s).当降低反应温度并增加添加剂的用量时,三氟甲磺酸-1-萘酯可以成功地以81%的产率转化为1-萘腈(3t).当苯环上存在吸电子取代基时,反应不完全,产率有所下降,如氟原子、酯基和羰基等,分别以中等或较低产率生成相应的氰化产物(3u~3x).然而,该反应也存在一定局限性,当苯环的邻位或对位含有强吸电子取代基如氰基(2y)和三氟甲基(2z),反应60 h后原料大量剩余,未检测到目标氰化产物的生成(N.D.).此外,该反应对于杂环类底物(2aa),反应60 h后原料大量剩余,也未检测到目标氰化产物的生成.
2 反应机理分析
完成条件筛选和底物拓展工作后,对镍催化下使用乙腈实现芳基三氟甲磺酸酯氰化反应的可能机理进行探索,推测反应可能经历如下过程.如图3所示,首先,二价镍被体系中的锌粉还原并与体系中的dppp发生配位生成Ni(0)复合物4,其中dppp作为配体在反应中可以起到稳定催化剂中间体的重要作用.随后,Ni(0)复合物4与底物芳基三氟甲磺酸酯2发生氧化加成反应生成二价镍络合物5.此时,若体系中存在水分子,则络合物会与水发生质解生成副产物6.如果二价镍络合物5与体系中的锌粉进一步发生还原,则可生成一价镍络合物7与三氟甲磺酸锌.这里生成的一价镍络合物7会与乙腈发生C≡N插入,生成含有Ni(I)的亚胺中间体8,其中,Ni(I)与亚胺中的氮原子相连.然后,含有Ni(I)的亚胺中间体与添加剂Zn(OTf)2发生金属交换,生成含有Zn的亚胺中间体9进而发生关键的β-碳消除,生成目标芳基腈产物3和甲基锌10.此时,体系中生成的甲基锌10与乙腈分子会再发生一次插入生成亚胺11,此时该亚胺11遇水则会水解生成丙酮[28].与此同时,先前发生转金属后的一价镍络合物13,则被体系中的锌粉进一步还原生成Ni(0)复合物4,随后重新启动下一次催化循环.
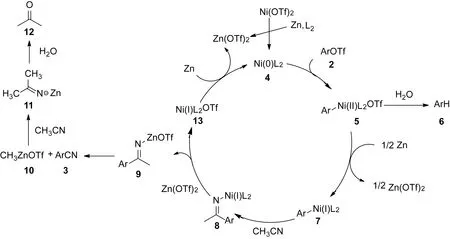
图3 机理推测
3 结语
综上所述,在镍催化下使用乙腈作为氰源,成功地实现芳基三氟甲磺酸酯的氰化反应.该反应摒弃传统的金属氰源和复杂的有机氰源,采用绿色、廉价的乙腈溶剂作为氰源,不仅避免催化剂的失活,而且解决金属氰化物的剧毒所带来的实验操作安全问题.以芳基三氟甲磺酸酯作为底物,对催化剂、配体、添加剂、温度等条件进行筛选,以物质的量分数为0.1的Ni(OTf)2作为催化剂,物质的量分数为0.1的dppp作为配体,物质的量分数为2的 Zn作为还原剂,物质的量分数为0.2的 Zn(OTf)2作为添加剂,实现芳基腈的高效合成.在该反应条件下研究底物的普适性与局限性,发现给电子取代基的底物在反应中展现出高效的反应性.最后,推测芳香腈的生成可能经历亚胺中间体的β-碳消除.未来将展开更深入的机理研究工作,以便更好地理解该反应和探索其应用前景.
