西兰花在PEG模拟干旱胁迫条件下的生理响应分析
2023-10-30李晓鹏袁九香
邵 勤,陈 娜,李晓鹏,袁九香
(1.宜春学院 生命科学与资源环境学院,江西 宜春 336000;2.南昌市农村社会事务服务中心,江西 南昌 330000)
干旱对农作物造成的损失在所有非生物胁迫中居首位,是限制植物生长发育的关键环境因子。近些年,由于灾害性天气的发生及水资源的短缺等问题频发,并影响了农作物的产量和品质,因此掌握农作物的抗旱性、研究农作物的耐旱机理引起了人们的广泛关注[1]。目前,对干旱胁迫的研究方法主要是采用聚乙二醇(PEG)对幼苗进行模拟试验,通过检测植物幼苗各项生理生化指标的变化情况,从而研究干旱对幼苗生长的响应情况及抗旱性强弱。近些年来,PEG作为水分胁迫材料在花椰菜、白菜、甘蓝型油菜等十字花科作物的抗旱性研究上得到了广泛的应用[2]。
西兰花(Brassica oleraceaL.var.botrytisL.)是十字花科芸薹属蔬菜,以食用花球为主。近年来,随着西兰花营养成分和功能成分的确定,显示其营养价值很高,具有补肾益精、补脾和胃、清理血管、抗衰老等特殊疗效而价格逐年上涨。西兰花在我国大部分地区均有种植,种植面积和产量位居世界第1位。西兰花是一种秋冬蔬菜,喜温暖湿润的气候条件,各营养生长时期对水分极为敏感,忌干燥,尤其在夏秋季栽培过程中极易受干旱天气的影响,缺水对出苗率、移苗成活率等的影响较大,最终影响其产量和品质[3],目前,关于西兰花耐旱机理的报道较少。为此,本研究通过PEG溶液模拟不同程度土壤干旱胁迫西兰花幼苗,并检测其体内渗透调节物质含量、生物膜伤害程度及抗氧化特性,分析和探讨了西兰花幼苗在干旱胁迫下的生理响应,以期为了解西兰花的耐旱机制、筛选耐旱种质、培育抗旱品种及推广应用提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料
以西兰花品种“青锦”为试材,杂交一代中早熟品种(70~75 d),耐热、耐寒,田间性状表现稳定,采购于宜春市种子市场。
PEG6000、蒽酮等为分析纯,购自西格玛奥德里奇(上海)贸易有限公司;抗逆系列—生化试剂盒(北京索莱宝):超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、脯氨酸(Pro)、抗坏血酸过氧化物酶(APX)。
1.2 试验设计
1.2.1 材料种植 筛选饱满、均匀的西兰花种子进行清水常温浸种,催芽后播于盛有基质的塑料平底育苗盘(540 mm×270 mm×60 mm)中,每盘约100粒,覆膜培养,要求阳光充足,基质相对湿度75%,等出芽后揭开薄膜继续培养,待移栽。整个试验于2022年10月—2023年1月在宜春学院农学基地温室大棚内进行。
1.2.2 材料处理 (1)准备沙子洗净晾干,装入直径8 cm的塑料瓶中,共50份,待用;(2)西兰花苗长至2叶1心时,选择大小一致且长势较好的幼苗,将根洗净移栽6株至塑料瓶中;(3)渗透胁迫处理:PEG6000浓度分别为0(CK)、5%、10%、15%、20%的溶液各100 mL进行胁迫处理(60株),其中胁迫时间设置为0、1、3、5、7 d,待植株表现不同程度的症状时,随机选取10株植株上部功能叶片(大小相当、症状一致的中上部成熟叶),测定各项生理指标,6次重复。
1.3 指标测定
(1)叶片相对含水量:饱和质量法测定[4];(2)叶片细胞膜相对透性:电导法测定[5];(3)可溶性糖:蒽酮比色法测定[6];(4)可溶性蛋白:考马斯亮蓝G-250法测定[7];(5)丙二醛:硫代巴比妥酸显色法测定[8];(6)超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX):按照北京索莱宝科技有限公司试剂盒步骤进行测定。
1.4 数据分析
用Excel 2016和SPSS 19.0软件对数据进行统计和分析。
2 结果与分析
2.1 PEG胁迫对西兰花幼苗叶片相对含水量的影响
叶片相对含水量(Relative water content, RWC)是反映干旱胁迫下植物叶片水分状况重要指标[9-10]。由图1可知,不同浓度PEG处理后,西兰花幼苗的RWC随着胁迫时间的延长、胁迫浓度的增加而呈下降的趋势。其中,处理1 d后有所降低,各处理与对照之间差异不明显,说明西兰花幼苗能适应短时间的胁迫;从第3天开始,叶片相对水分含量呈下降趋势,不同浓度PEG胁迫比对照分别下降了8.30%、12.7%、25.4%、32.15%,依据Hsiao[11]的方法将相对含水量降低分为轻度(8%~10%)、中度(10%~20%)和严重胁迫(20%以上),则5% PEG处理达到了轻度胁迫,10% PEG处理达到中度胁迫,15%~20% PEG处理达到了严重胁迫;第7天,叶片相对含水量比对照分别降低了9.70%、35.30%、41.20%、51.30%,除了5% PEG处理外,均达到了严重胁迫程度,并观察到叶片开始萎蔫,影响了植株的正常生长。
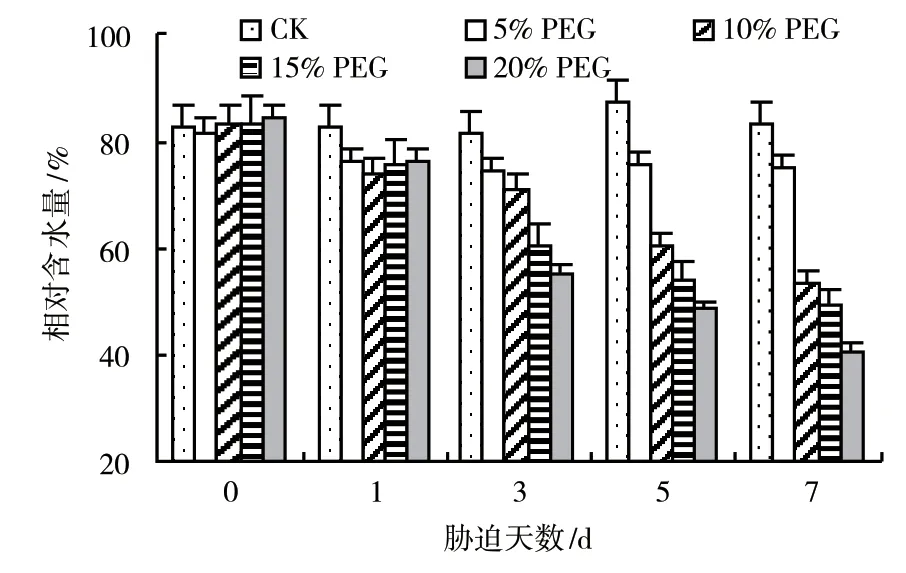
图1 PEG胁迫对西兰花幼苗叶片RWC的影响
2.2 PEG胁迫对西兰花幼苗叶片脯氨酸含量的影响
叶片脯氨酸含量(Proline, Pro)是反映植物适应逆境胁迫的重要指标之一,在植物抗旱生理中发挥着重要作用[12]。本研究对西兰花幼苗的PEG胁迫完全符合这个结论。
由图2可知,西兰花幼苗叶片的脯氨酸含量随着PEG胁迫浓度的增加、胁迫时间的延长而呈上升趋势,即使在5%低浓度PEG胁迫下,与对照相比,均有显著的增加,并随着PEG胁迫时间的延长和浓度的增加而表现更明显。在胁迫7 d后,其余3个高浓度PEG胁迫处理下的叶片脯氨酸积累得越来越多,最高达101.28 μg/g,4个处理分别比对照增加了101.20%、107.97%、129.18%、139.49%。
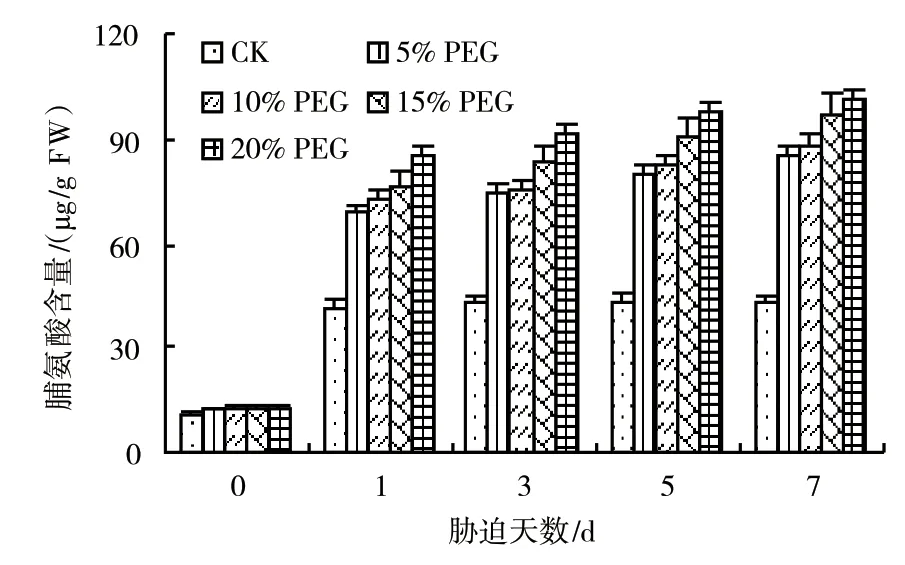
图2 PEG胁迫对西兰花幼苗叶片Pro含量的影响
2.3 PEG胁迫对西兰花幼苗叶片细胞膜相对透性的影响
植物细胞膜对维持细胞正常代谢起着重要作用,其质膜透性的变化是检测植物细胞结构和功能完整性的可靠指标[13]。
在PEG胁迫下,西兰花幼苗的相对电导率(Relative electric conductivity, REC)变化如图3所示。西兰花幼苗的膜透性随着PEG浓度的增加和胁迫时间的延长而呈上升趋势,其中5% PEG胁迫1 d,与对照差异不明显,说明西兰花“青锦”具有较强的抗旱性。但随着胁迫时间的延长,尤其是在10%、15%、20% PEG高浓度胁迫条件下,与对照相比,差异显著,且REC表现为增加的趋势,说明PEG渗透胁迫导致西兰花幼苗的叶片质膜在生长过程中受到了损伤,进而影响了其正常的生理代谢过程。
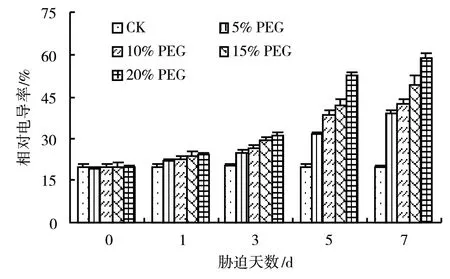
图3 PEG胁迫对西兰花幼苗叶片REC的影响
2.4 PEG胁迫对西兰花幼苗叶片可溶性糖含量的影响
在逆境胁迫条件下,植物体内积累的可溶性糖(Soluble Sugar, SS)是一类重要的渗透调节物质,其含量的增加能提高细胞汁液的浓度,降低细胞水势,从而提高植物的吸水能力[14]。
由图4可知,在5%低浓度PEG胁迫下,西兰花幼苗叶片中可溶性糖含量与对照差异不显著,随着PEG浓度的增加,叶片可溶性糖含量逐渐提高。从第3天开始,可溶性糖含量呈升高趋势,比对照增加了31.9%~43.2%;第5天的叶片可溶性糖含量继续稳定增加,说明西兰花已经产生渗透调节作用;但到第7天则明显下降,说明渗透调节能力是有限度的,其中较长时间和较高浓度PEG胁迫会导致西兰花幼苗叶片生理代谢紊乱。

图4 PEG胁迫对西兰花幼苗叶片可溶性糖含量的影响
2.5 PEG胁迫对西兰花幼苗叶片可溶性蛋白质含量的影响
可溶性蛋白(Soluble protein, SP)是重要的渗透调节物质和营养物质,它们的增加和积累能提高细胞的保水能力,对细胞的生命物质及生物膜起到保护作用,经常用作筛选植物抗性的指标之一[15]。
由图5可知,随着PEG浓度的增加和胁迫时间的延长,可溶性蛋白含量逐渐下降(第5天最低),与对照相比,分别下降了26.0%、31.7%、40.3%、42.5%,然而第7天的可溶性蛋白含量有所上升,总体呈现先降后升趋势,说明经过一定时间的PEG胁迫处理后,西兰花幼苗则通过叶片可溶性蛋白含量的增加以维持正常的生理代谢平衡。
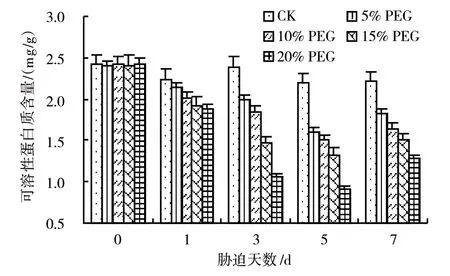
图5 PEG胁迫对西兰花幼苗叶片SP含量的影响
2.6 PEG胁迫对西兰花幼苗叶片丙二醛含量的影响
丙二醛(Malonic dialdehyde, MDA)是膜脂过氧化的主要产物,能够抑制细胞保护酶活性和降低抗氧化物的含量,加剧膜脂的过氧化作用,其含量变化与细胞膜脂过氧化程度的高低呈正相关[16-18]。
由图6可知,在不同浓度PEG胁迫下,MDA含量出现了明显的变化,并随着胁迫时间的延长和浓度的增加而呈上升趋势,与对照相比,差异明显。随着胁迫时间的延长,4种浓度PEG干旱胁迫处理的MDA含量变化趋势一致,西兰花幼苗在遭到胁迫时,表现出强烈的生理反应,且始终保持增加,这表明在PEG胁迫处理过程中,胁迫时间的延长对细胞膜的伤害更严重。

图6 PEG胁迫对西兰花幼苗叶片MDA含量的影响
2.7 PEG胁迫对西兰花幼苗叶片抗氧化物质的影响
植物体内存在活性氧清除系统,细胞内活性氧含量处于动态平衡的状态,可以减少氧自由基对植物的伤害,其活性氧的清除主要是通过有关酶和一些抗氧化物质,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等[19]。
由表1可知,在PEG胁迫下,西兰花幼苗体内的SOD酶活性随着PEG浓度的增加和时间的延长而呈先上升后下降的变化趋势。其中,SOD酶活性在5%PEG胁迫1 d时有小幅度的增强,随后降低且与对照差异不明显;10% PEG在胁迫1和3 d时均有小幅度增强,但在胁迫5 d时达到最大值86.40 U/g FW,显著高于对照,随后下降;15% PEG在胁迫1 d时明显增强,并在胁迫3 d时达到最大值94.15 U/g FW,随后开始大幅度下降,在胁迫7 d时降低至56.15%,明显低于对照;20% PEG胁迫开始后就得到了增强,在胁迫3 d时达到最大值108.31 U/g FW,随后开始大幅度下降,在胁迫7 d时降至42.18 U/g FW,显著低于对照。由此可知,西兰花幼苗在短时间、低浓度胁迫时,其叶片SOD酶活性的增加可以有效清除自由基,从而保护叶片免受过度伤害。
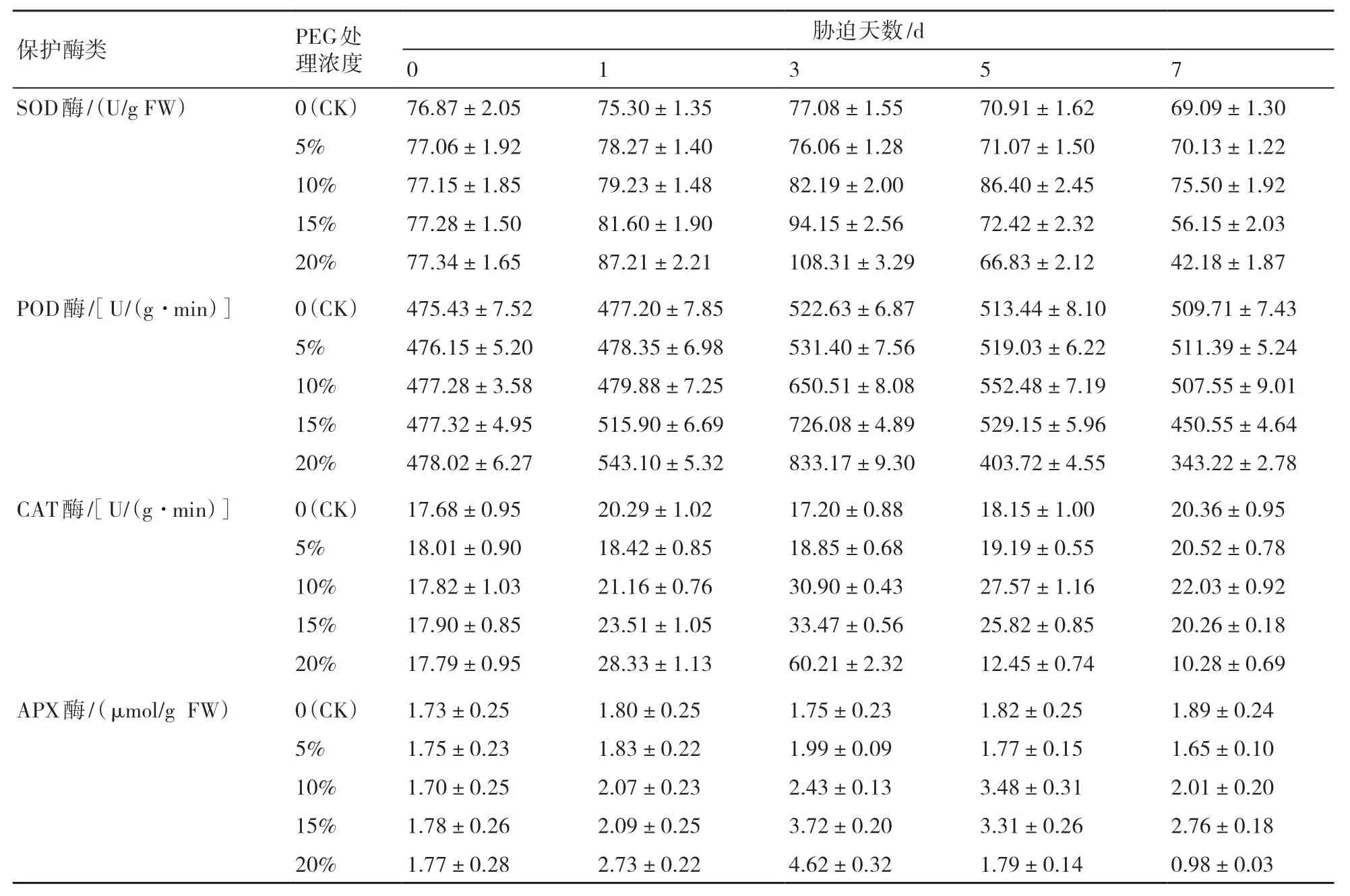
表1 PEG胁迫下西兰花幼苗叶片SOD、POD和 CAT酶活性的影响
随着PEG胁迫时间的延长,不同PEG浓度胁迫下的POD、CAT酶活性基本呈现先升高后下降的趋势。5%和10% PEG胁迫下,POD、CAT酶活性小幅增加,胁迫后期与对照差异不显著。15% PEG胁迫下,POD、CAT酶活性均在胁迫中期(3 d)达到最大值,后期开始下降,并显著低于对照。20% PEG胁迫下,从一开始就急剧增强,显著高于对照;在胁迫3 d时达到最大值,随后开始急剧下降,胁迫5 d时显著低于对照,在胁迫7 d时的POD、CAT酶活性分别低至343.22、10.28 U/(g·min)。
对照叶片中APX酶活性在PEG胁迫过程中保持相对稳定,4种浓度PEG胁迫均呈先增加后降低的变化趋势。5% PEG胁迫3 d时显著高于对照,随后开始降低,在胁迫7 d时趋于对照的水平;10%PEG在胁迫1 d时开始升高,在胁迫5 d时达到最大,胁迫7 d时下降至对照的水平;15% PEG在胁迫1 d时就迅速升高,并在胁迫3 d时达到最大值,随后开始下降,但酶活性仍高于对照的水平;20%PEG在胁迫3 d时达到最大值,之后开始大幅度降低,在胁迫7 d时APX酶活性显著低于对照。
从上述SOD、POD、CAT、APX等4种抗氧化酶活性的变化可知,随着胁迫时间的延长,4种酶活性均呈先增加后下降的变化趋势,说明西兰花幼苗在一定浓度的PEG胁迫下能提高这些保护酶的活性,以清除植物体内的自由基和活性氧,进而减轻植株受伤害的程度,有效地保护了西兰花幼苗正常生长,但随着PEG浓度的增加和胁迫时间的延长,对植株的伤害越来越严重,因而对幼苗造成了严重的损伤。
2.8 PEG模拟干旱胁迫下西兰花幼苗生理效应的综合评价
将处理后的各项指标进行相关性分析,得到相关系数矩阵。对PEG模拟干旱处理后西兰花幼苗的10个指标进行相关性分析(表2),结果表明:西兰花幼苗叶片的RWC与SP呈极显著正相关,与Pro、REC、SS、MDA呈极显著负相关,表明可以用RWC、Pro、REC、SS、SP、MDA等指标来评价PEG对西兰花幼苗的胁迫程度。
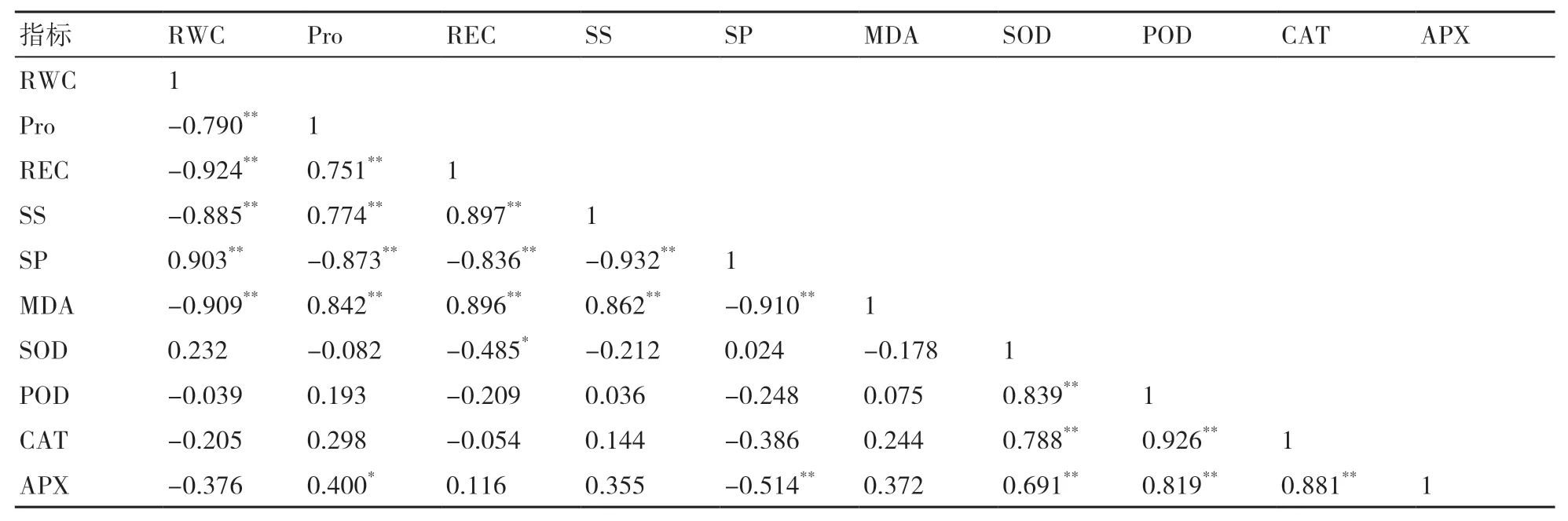
表2 不同处理西兰花幼苗各项指标的相关性分析
对PEG模拟干旱胁迫条件下不同处理对西兰花幼苗的生理响应特性进行综合评价,将PEG胁迫处理后相关的10个指标进行主成分分析,提取初始特征值>1的2个主成分,其特征值分别为5.652和3.485。第1、第2主成分的方差贡献率分别为56.517%、34.851%,累计方差贡献率达到91.368%,符合分析要求。
由表3可知,第1主成分综合了RWC、Pro、REC、SS、SP、MDA这6个指标的信息,第2主成分综合了SOD、POD、CAT、APX指标的信息。综合得分的计算公式:F综=(第1主成分得分×56.517+第2主成分得分×34.851)/91.368。
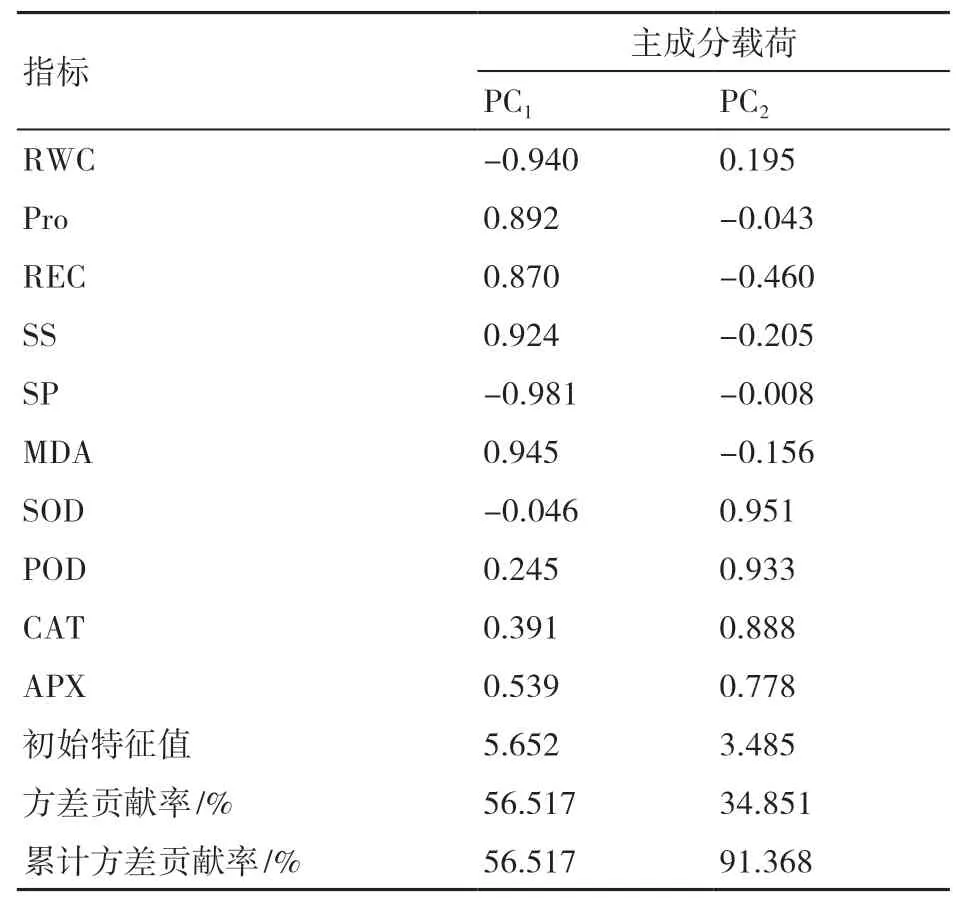
表3 主成分分析的总方差解释
由表4可知,西兰花幼苗在不同浓度PEG胁迫下的综合得分分别为-1.167(5% PEG)、0.850(10%PEG)、0.718(15% PEG)、0.810(20% PEG)。因此,PEG模拟干旱胁迫下对西兰花幼苗的生理特性影响排名依次是10% PEG>20% PEG>15% PEG>5% PEG。
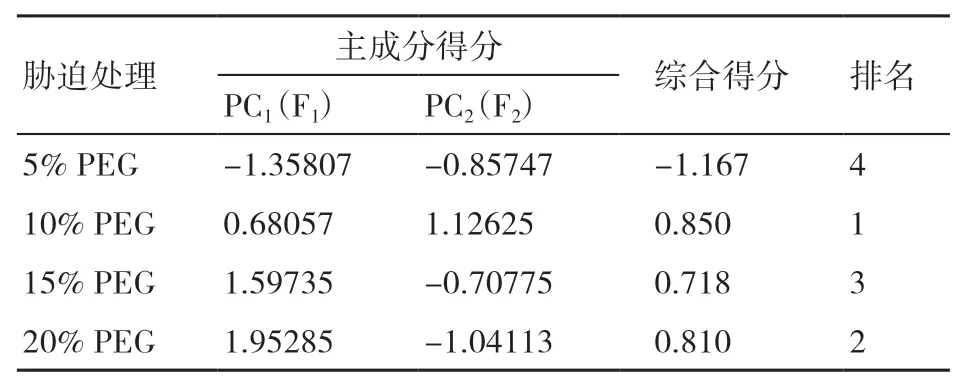
表4 不同浓度PEG胁迫处理下西兰花幼苗的综合得分及排名
3 讨论与结论
叶片相对含水量是反映植物体内水分亏缺程度的生理参数之一[20]。本研究认为,西兰花幼苗叶片相对含水量随着渗透胁迫时间的延长而降低,5% PEG浓度处理表现轻度胁迫,10% PEG浓度处理达到中度胁迫,15%~20% PEG浓度处理达到了严重胁迫,说明西兰花幼苗在轻度渗透胁迫下具有一定的保水能力,但高浓度、长时间的渗透胁迫会使西兰花幼苗严重失水而受到伤害。
脯氨酸是植物蛋白质的组成成分之一,在植物中广泛存在于游离态,研究表明:在干旱、盐胁迫等非生物胁迫条件下,植株叶片的脯氨酸含量显著增加,植物体内脯氨酸的含量在一定程度上可以反映植物的抗逆性[21]。本研究结果可知,西兰花幼苗叶片脯氨酸含量随着PEG胁迫浓度的增加、胁迫时间的延长而呈上升趋势,在5%低浓度PEG胁迫也有较显著的增加,并随着时间的延长而显著增加。研究显示高浓度PEG胁迫下脯氨酸积累越来越多,最高达101.28 μg/g,分别比对照增加了101.20%、107.97%、129.18%、139.49%。说明PEG胁迫诱导了西兰花幼苗体内脯氨酸的大量积累,具有一定的抗旱能力。
植物细胞膜对维持细胞微环境的正常代谢起着重要的作用,正常情况下细胞膜的渗透性具有选择性。研究表明,当植物受到干旱、水淹、盐、冷冻等胁迫时,可以通过测定相对电导率来鉴定植物细胞结构和功能的完整性[22]。本研究分析了PEG渗透胁迫下西兰花幼苗叶片的相对电导率,结果发现,西兰花幼苗低浓度胁迫条件下与对照差异不显著,说明其具有一定的抗旱性,但随着PEG胁迫时间的延长和浓度的增大,其相对电导率变化极显著,说明在PEG模拟干旱胁迫下,西兰花幼苗细胞受到了一定的伤害,其伤害程度与胁迫浓度呈正相关。
植物细胞会积累一些可溶性物质来进行渗透调节,以提高植物抗逆性。研究表明,可溶性糖含量的增加,能降低细胞原生质的渗透势,增强保水力,稳定生物大分子结构,降低细胞酸性以及解除氨毒[23]。本研究表明,与对照相比,叶片可溶性糖含量增加了31.9%~43.2%,胁迫7 d后则明显下降,说明渗透调节能力是有一定限度的,较高浓度的PEG、较长时间的胁迫均会使西兰花幼苗失去生理调节能力,因此推测在低浓度、短时间胁迫条件下,可溶性糖得到积累而维持西兰花幼苗正常的代谢过程。
可溶性蛋白与植物细胞的渗透调节有关,高含量的可溶性蛋白能维持较低的细胞渗透势,减轻干旱胁迫所造成的伤害,延缓胁迫条件下植物叶片的衰老进程[24]。本研究表明,可溶性蛋白呈先降后升的变化趋势,说明在一定的干旱胁迫时间内,可以诱导叶片产生更多的可溶性蛋白,以抵御PEG胁迫所带来的伤害,这样才能维持西兰花幼苗正常生长。
MDA具有很强的细胞毒性,对膜和细胞中的许多生物功能分子如蛋白质、核酸和酶等均有很强的破坏作用,并参与破坏生物膜的结构与功能[25]。本研究表明,MDA含量随着PEG胁迫时间的延长与浓度的增加而呈上升趋势,与对照相比,差异显著。随着时间的变化,4种浓度胁迫的MDA含量变化趋势一致,西兰花幼苗在遭受PEG胁迫时,表现出强烈的生理反应,且始终保持增加,从PEG胁迫对细胞膜造成的伤害程度来看,长时间干旱胁迫造成的损伤则更为严重。
在抗氧化酶体系中,SOD酶活性与植物的抗氧化能力呈正相关。有研究表明,在轻度干旱胁迫时SOD酶活性开始升高,重度干旱或者胁迫时间的延长,SOD酶活性呈下降趋势或者先降低后升高的变化趋势,变化情况较为复杂。前人在研究不同作物幼苗膜质过氧化中发现,轻度干旱胁迫和中度干旱胁迫下的POD、CAT酶活性均呈上升趋势,且与植物材料的种类和抗旱的敏感程度相关[26],本研究结果与前人得出的结论一致。
在植物耐旱性研究中发现,植物的抗旱能力取决于植物体内的APX酶活性,表明APX酶也是活性氧清除系统的一部分[27]。本研究结果可知,在胁迫初期的APX酶活性变化不大,随着PEG浓度的增加和胁迫时间的延长,APX酶活性先升高后降低,表明西兰花可以通过增加APX酶活性来抵御质膜的过氧化过程,减少对植株的伤害。
综上所述,在PEG干旱胁迫处理下,高浓度对各项指标的影响比低浓度的大,其原因在于PEG能影响原生质膜,改变膜透性,其细胞膜成分会部分改变,进而影响植物的正常生理代谢。西兰花幼苗通过增加抗氧化酶活性,共同抵御氧化胁迫造成的伤害。西兰花“青锦”幼苗可以抵抗中等程度的PEG干旱胁迫(10%),可以在半干旱地区或轻度缺水地区引种,不仅丰富了西兰花的抗性种质材料,也为今后西兰花标准化育苗、苗期肥水一体化等管理提供一定的理论依据。
