“导学导思”教学法在高中化学教学中的应用
2023-10-29刘丹刘宏伟黄亚君
刘丹 刘宏伟 黄亚君
《普通高中化学课程标准》《基础教育课程改革纲要》和人教版新教材编写要求,都体现了教师在教学过程中要培养学生自主学习能力的理念。在“双减”背景下,不能以抢占时间和题海战术为手段提高学生成绩,而是要采取有效方法提高学习质量。我们秉承学校“自主学习,主动发展”的办学特色,不断推进化学课程教学改革,其中“导学导思”是提高学生自主学习能力的有效方法。
一、导学目标培养学生自主学习的习惯
(一)导学提纲是实现导学的载体
主要内容:学习目标、学习指导、问题研究、反馈梳理四个板块。实施要求:指导自学方法、检查自学结果、示自学成果。案例:水溶液中离子浓度的大小比较导学案。学习目标:回顾代表性的盐溶液的酸碱性,进一步掌握离子浓度的大小比较,了解守恒关系。以强碱氢氧化钠溶液滴入弱酸醋酸溶液为例,通过对反应过程的溶质进行分类、探究、质疑、画图像等形成创新思维。
(二)创设教学情境,将学生带入主动学习状态
目的:将学生带入学习情境,并通过问题引导激励学生思考。方法:小实验、媒体资源、图表材料、实践活动、小故事、易混易错问题等。
任务1:温故—思考—交流。提出问题:25℃时,CH3COONa、NaHSO3、Na2SO3、NaHCO3四种盐溶液存在的PH和离子浓度的大小比较?
课堂活动:变传统的由教师找问题为由学生自己发现问题。教师鼓励学生开动脑筋,指出学生存在的问题,培养学生自主创新学习能力,提高学生学习效果。设计意图:本节课是复习课,教学遵循培养学生自主学习能力的目标进行课程设计,学生通过自学就能掌握的知识不再赘述,鼓励学生大胆质疑和发表自己观点,使思维得到锻炼,信心得到提升,教师只需要讲解学生不懂的知识。
二、导思核心培养学生主动学习的能力
(一)问题是锻炼学生思维的有效手段
设问:体现层次性和引导性,突出教师的引导、提示作用。追问:训练深刻性和逻辑性,突出对原因和过程的考查。变问:训练灵活性与丰富性,突出改变条件或错误解答的分析。互问:训练完整性与创新性,突出个别化教育与质疑意识训练。
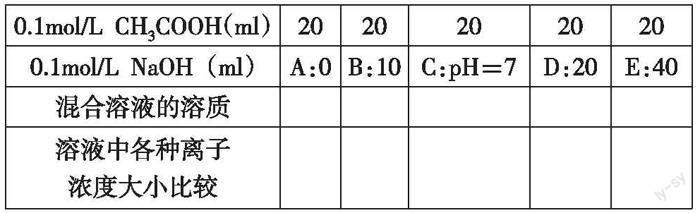
任务2:分类—质疑—探究。提出问题:25℃时,向20mL浓度为0.1mol/L的CH3COOH溶液中逐滴加入0.1mol/L的NaOH溶液,完成下表,并描出A、B、C、D、E点坐标画出图像(横坐标是NaOH的体积,纵坐标是pH)。
课堂活动:甲乙丙丁戊组学生有不同的见解,甲组学生认为要根据溶质成分把溶液分成单一溶质和混合溶质,乙组学生认为应根据溶液的酸碱性把溶液分成了酸性溶液、中性溶液和碱性溶液,丙组学生将曲线变化的过程看作一个整体理解溶液离子浓度的大小。对D点的讨论,丁组学生认为是 CH3COONa 溶液,而戊组学生认为不需要考虑溶质的成分,只要利用电荷守恒关系,借助溶液的酸碱性就可以对离子浓度大小进行排序。
设计意图:打破教师直接呈现某溶液或事先把溶液不同情况总结好呈现给学生的情况,而是给学生创造更多思考、交流的机会,使学生体会到知识的魅力;让学生画出曲线辨析反应过程,认识到量变可以引起质变,从动态的角度比较离子浓度大小。
(二)问题的设计提升学生内驱力
选择问题要依据课标和课本、突出重点、循序突破难点。开发问题要提出或挖掘深层次的问题,并进行理解、联系、变析。解决问题要有针对性,要考虑到群体、形式、频次、验收。
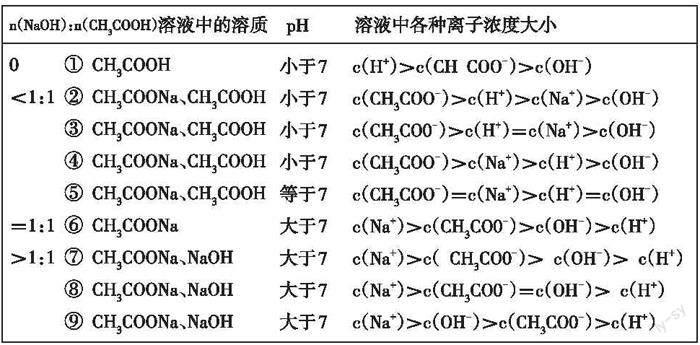
任务3:变化—思考—探疑。提出问题:25℃时向20mL0.1mol/L的CH3COOH 溶液中逐滴加入0.1mol/L的NaOH溶液,n(NaOH):n(CH3COOH)各区间溶液中溶质、pH、离子溶度的大小如何?
课堂活动:学生探讨、辨析电解质溶液中c(CH3CO0-)、c(H+)、c(Na+)、c(OH-)四种主要离子浓度大小排序变化,虽然它们大小关系发生了改变,但是电荷守恒、物料守恒和质子守恒关系不变。设计意图:由上题图像到此题表格的转换,教师可以深入地检验学生对离子浓度大小关系的掌握情况,有效地对学生的薄弱环节加以点拨,引导学生在提出问题的基础上探索疑问、解决疑问;由图与表间的转换,打破学生思维上的局限,学生探疑后,教师及时引导学生进行归纳总结,提炼解决这类问题的一般思路和方法。
任务4:答疑—解惑—归纳。通过本节课的学习,学生归纳、解决“电解质溶液中离子浓度大小比较”的一般思路和方法。
课堂活动:小组抢答。单一溶质的电解质溶液,根据电离或水解的程度就可以排出离子浓度大小顺序。如果出现既电离又水解的酸式盐,要根据溶液的酸碱性判断电离和水解程度的相对大小,或根据水解常数和电离常数判断谁大谁小。如果是混合溶质的电解质溶液,看相互反应和不反应来确定结果。
教师总结:比较电解质溶液中离子浓度大小,实质上就是要综合运用守恒关系、电离与水解程度、溶液酸碱性等知识,处理好易电离或易水解的离子浓度大小变化,从而准确地判断离子浓度大小。
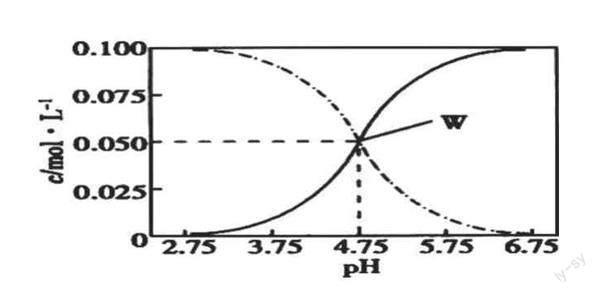
任务5:理解—挖掘—验收。例题:25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol/L的一组CH3COOH、CH3COONa混合溶液,溶液中c(CH3COOH)、c(CH3C00-)与pH的关系如图所示。对有关溶液中离子浓度定量关系的叙述进行判断。
课堂活动:课堂检测。利用电荷守恒、元素守恒关系和数学技巧解题。设计意图:学习的最终目标就是学以致用,通过本节课的复习,让学生通过归纳和总结重新建构和反思知识,突破原有的认知局限和学习难点;再围绕曲线变化,有意设计一道类似的曲线变化过程中离子浓度关系的判断题,加深学生对此类问题的理解,让学生发现学科之间不是孤立的,而是有关联的,学科间是一个有机的知识体系。
三、教学反思是教师专业发展与成长的动力
(一)关注过程,动态生成
本节课的设计主要从两种反应物由少到多的变化过程去理解各离子浓度大小关系,以NaOH溶液逐滴加到CH3COOH溶液的典型问题为例去分析,把看似静止的浓度大小比较变成动态的生成过程,让学生重新思考考题的难点,形成对电解质溶液中离子浓度大小比较的一般思路和方法。
(二)关注疑问,积极鼓励
在疑问中蕴藏着学生的智慧与创造。教师在教学中设置许多疑点并留有充分质疑空间,让学生产生好奇心,提出不同的见解。
(三)关注方法,学科关联
在运用守恒法理解离子浓度大小的同时,又借鉴了数学等元替换的思想,使讓学生感受到学科间知识关联的重要性。
学起于思,没有思考的学习不是真正的学习;思源于疑,没有疑问的学生不具有创造性。“导学导思”教学法不是学生依据教师设定的轨道按部就班地走,而是让学生在自主学习轨道上不断提升学习能力的智慧教学方法。教师要在教学中搭建阶梯、问题引领、鼓励探讨、适时解惑,把更多的主动权交给学生,成为学生学习的引导者和促进者。 (焦 佳)
