泡桐丛枝病对内生真菌群落及其结构的影响
2023-10-28黄静李烜桢范国强
黄静,李烜桢,范国强
(河南农业大学林学院,河南 郑州 450002)
植物内生真菌(fungal endophytes)是指存在于健康植物组织中,其生活史的某一阶段或全部阶段都在植物的各组织、器官内度过,而不使其宿主植物表现出明显感染症状的一类真菌[1]。几乎所有植物组织中都存在内生真菌,这些真菌在植物养分获取、生长发育、调节抗逆性等方面具有重要作用[2]。植物内生真菌被认为是植物病害的调节器。一方面,某些内生真菌可抑制病原菌对植物的侵染,从而减轻植物病害;另一方面,一些内生真菌可能对病原菌的种群发展有着促进作用[3]。因此,深入认识和挖掘内生真菌资源对于植物保护具有重要意义[1]。
丛枝病是泡桐(Paulownia)常见的病害,也是影响泡桐种植业健康发展的重要障碍因素[4]。丛枝病由植原体引起,症状主要表现为局部枝条呈丛生状,严重者可导致泡桐整株枯死[4]。植原体是一种无细胞壁的细菌,目前尚不能人工培养[5],这给丛枝病的防治带来很大的困难。随着分子生物学尤其是高通量测序技术的发展,人们可在不进行人工培养的情况下探明内生微生物的存活状况,进而为了解丛枝病与内生真菌群落关系提供了有力的工具。基于高通量测序的微生物组研究可产生海量的测序数据,选择正确的数据分析方法十分重要,而传统的统计学方法已经无法满足大样本量的分析[6]。机器学习能够对物种水平的操作性分类单元进行有效且准确分类,并且可以找出能够区分组间差异的关键物种,因此在微生物组研究中日益受到重视[7]。
白花泡桐植株中含有丰富的内生真菌。有学者通过纯培养手段从白花泡桐根、茎、叶中分离出19株内生真菌[8]。然而,这些研究都是基于传统的微生物分离培养方法进行的。在丛枝病胁迫下,泡桐内生真菌群落组成有何变化,目前尚不清楚。本研究选取健康和患丛枝病的泡桐植株,分别采集叶、枝和根样品,分析不同样品中植原体和内生真菌群落组成状况,旨在深入了解丛枝病与内生真菌群落组成的关系,从而为开发泡桐丛枝病微生物防治技术奠定理论基础。
1 材料与方法
1.1 样地概况
样品采自河南省禹州市泡桐基地。该基地建立时间为2017年,面积为1 hm2,品种为白花泡桐,株距和行距分别为4和5 m。树高约为5~6 m,其中10%的泡桐树表现出丛枝病症状。
1.2 样品采集
2021年10月,随机选取6棵健康和6棵患有丛枝病的泡桐植株进行采样(表1)。对于健康植株(HL、HB、HR),每棵树剪下1枝完整枝条;对于发病植株(SL、SB、DR),每棵树剪下1枝发病枝条。每个枝条的最大直径约为1 cm,用无菌刀将枝条切下10 cm的小段作为枝样品。在每个枝条上用无菌刀片随机切下10个叶片作为叶样品。在泡桐根部5~10 cm土层中随机采集直径为1 cm的根作为根样品。所有样品均保存于-80 ℃冰箱中。

表1 样品代号和采集器官Table 1 Sample name and collection organ
1.3 巢氏PCR
采用巢氏PCR分析不同样品中植原体的存活状况[9]。使用植物基因组DNA试剂盒(TIANGEN,China)对枝和根提取总DNA。利用NanoDrop2000和1%琼脂凝胶电泳检测总DNA样品浓度和纯度。以提取的DNA为模板,采用引物R16mF1/R16mR1进行第1轮扩增;再以第1轮扩增产物(第一轮扩增产物用无菌水按照1∶19稀释)作为模板,采用引物R16F2/R16R2进行第2轮PCR扩增。PCR扩增程序:94 ℃ 3 min,5个循环(94 ℃ 1 min,52 ℃ 1 min,72 ℃ 2 min),25个循环(94 ℃ 30 s,52 ℃ 1 min,72 ℃ 2 min),最后72 ℃延伸10 min。PCR扩增产物用1.0%琼脂糖凝胶电泳检测。
1.4 DNA提取、扩增和Illumina Miseq测序
采用E.Z.N.A.® soil DNA kit(Omega Bio-tek, Norcross, GA, USA)提取泡桐内生真菌总DNA,然后使用1%的琼脂糖凝胶电泳检测DNA的提取质量,使用NanoDrop2000测定DNA浓度和纯度。经检测合格后,于-80 ℃条件下低温保存。
采用ITS1F/ITS2R对白花泡桐内生真菌的ITS区域进行 PCR 扩增,扩增程序如下:95 ℃预变性3 min,27个循环(95 ℃变性30 s,55 ℃退火30 s, 72 ℃延伸45 s),然后72 ℃ 稳定延伸10 min,最后在4 ℃进行保存(PCR仪:ABI GeneAmp®9700型),每个样本3次重复。
将同一样本的PCR产物混合后使用2%琼脂糖凝胶回收PCR产物,利用AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)进行回收产物纯化,2%琼脂糖凝胶电泳检测,并用QuantusTMFluorometer(Promega,USA)对回收产物进行检测定量。使用NEXTflexTM Rapid DNA-Seq Kit(Bioo Scientific,USA)进行建库:(1)接头链接;(2)使用磁珠筛选去除接头自连片段;(3)利用PCR扩增进行文库模板的富集;(4)磁珠回收PCR产物得到最终的文库,利用Miseq PE300平台进行测序。
1.5 数据处理与分析
先使用fastp和FLASH软件对原始测序序列进行质控和拼接,再利用UPARSE软件按照97%的相似性对非重复序列进行OTU聚类并去除嵌合体,得到OTU的代表序列。最后对每条序列进行物种分类注释,并与Unite(Release 8.0 http://unite.ut.ee/index.php)真菌数据库对比,默认置信度阈值为0.7。为了比较白花泡桐叶、枝和根样品间的内生真菌群落多样性,采用mothur(https://www.mothur.org/wiki/Download_mothur)软件计算内生真菌α多样性指数,包括香农指数和Chao1指数,分别反映内生真菌群落的多样性和丰富度,并采用Studentt检验(Student’sttest)进行组间差异检验。基于Bray-Curtis距离矩阵,利用R语言(version 3.3.1)进行主坐标分析(PCoA),用于内生真菌β多样性分析。使用R语言中randomFo-rest包(version 4.7-1.1),建立随机森林分类模型,将内生真菌群落与丛枝病相关联,以评估不同类型样品中的真菌群落状况并对生物标志物进行预测。
2 结果与分析
2.1 泡桐丛枝病与植原体丰度的关系
通过巢氏PCR发现(图1),SB和SR样品在1 200 bp处有较亮的条带出现,而HB和HR样品无条带出现。由于植原体DNA长度约为1 200 bp[10],可见SB和SR样品中含有较多的植原体,而HB和HR样品中不含植原体(或含量极低)。这表明在泡桐枝中,丛枝病症状与植原体丰度存在密切的联系,而在泡桐根中,虽然植原体丰度较高,但并未并表现出发病情况。

A:M为2 000 bp Marker;1为ddH2O;2~7为HB;8~13为SB。B:M为2 000 bp Marker;1为ddH2O;2~7为HR;8~13为SR。A: M present 2 000 bp Marker;1 present ddH2O;2-7 present HB;8-13 present SB. B: M present 2 000 bp Marker;1 present ddH2O;2-7 present HR;8-13为SR.
2.2 泡桐丛枝病对内生真菌群落α多样性的影响
通过分析泡桐内生真菌群落α多样性发现(图2),SB样品的香农指数显著高于HB(p<0.05),SL样品香农指数较HL样品有所上升,但是未达到显著水平(p>0.05),HR和DR样品之间的香农指数无显著差异(p>0.05)(图2),表明丛枝病提高了泡桐枝中的内生真菌群落多样性,但未改变叶和根中内生真菌群落的多样性。发病样品(SB、SL和SR)的Chao1指数较相应的健康样品(HB、HL和HR)有所提高,但均未达到显著水平(p>0.05)(图2),表明丛枝病未改变枝、叶和根中内生真菌群落丰富度。

A和D:叶样品;B和E:枝样品;C和F:根样品。A and D: Leaf samples; B and E: Branch samples; C and F: Root samples.
2.3 泡桐丛枝病对内生真菌群落β多样性的影响
根据不同样品的真菌物种组成数据(OTUs)计算布雷柯蒂斯(Bray-Curtis)距离,并基于Bray-Curtis 距离矩阵进行了主坐标分析(PCoA)(图3)。对于枝样品,PCoA1解释了总方差的46.94%,PCoA2解释了17.55%,HB和SB在PCoA1上出现了明显的分异(r=0.772 2,p=0.003 000)。对于叶样品,PCoA1解释了总方差的37.52%,PCoA2解释了23.70%,SL与HL在PCoA1出现了明显的分异(r=0.537 0,p=0.009 000)。对于根样品,PCoA1解释了总方差的60.81%,PCoA2解释了24.22%,HR和DR分异较小(r=-0.033 3,p=0.704 000)。这些结果表明,丛枝病显著改变了枝和叶中真菌群落结构,但未显著改变根中真菌群落结构。
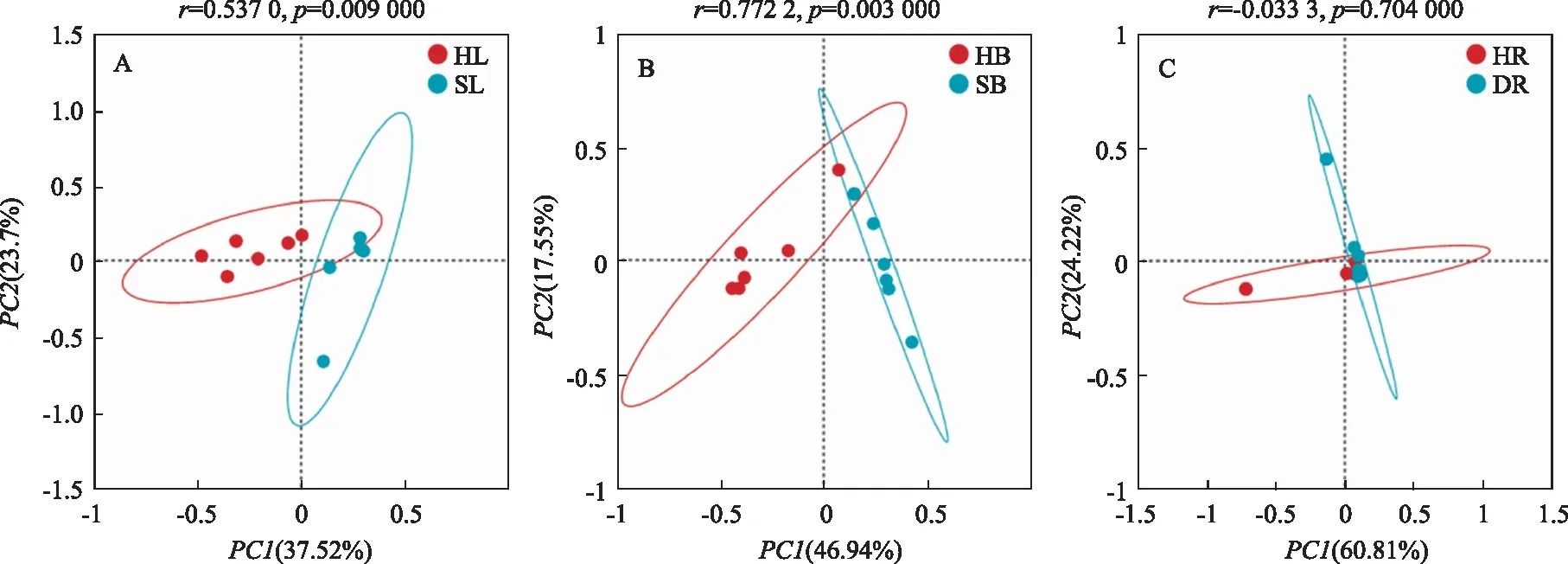
A:叶样品;B:枝样品;C:根样品。A: Leaf samples; B: Branch samples; C: Root samples.
2.4 丛枝病对内生真菌群落结构的影响
通过分析门水平上内生真菌群落组成发现(图4),在泡桐的枝、叶和根中,子囊菌门(Ascomycota)和担子菌门(Basidiomycota)是丰度最大的两个门,丰度之和高达97.22%~99.80%。子囊菌门是丰度最高的门,丰度达到82.21%~98.07%,其次为担子菌门,丰度为1.72%~15.01%。丛枝病提高了枝和叶中担子菌门的丰度,而降低了子囊菌门的丰度;在根中,丛枝病降低了担子菌门的丰度,而提高了子囊菌门的丰度,此外丛枝病还降低了unclassified_k__Fungi的丰度。这些结果表明,丛枝病对泡桐门水平上的内生真菌群落组成有一定的影响。

图4 丛枝病对泡桐内生真菌群落门水平组成的影响Fig.4 Effects of witches’ broom on fungal endophytes community composition in the phylum level in Paulownia
2.5 丛枝病对关键内生真菌物种的影响
为了研究影响泡桐健康状况对关键真菌物种丰度(即生物标志物)的影响,本研究使用随机森林机器学习法对数据进行了分析(图5)。结果表明在属和种水平,内生真菌对植物健康状况具有最高的预测准确率(67.57%)(图5A)。随后使用5次重复10次交叉验证,评估了随机森林模型随物种数量变化对泡桐健康状况预测的准确率变化。结果表明,当属的数量增加到10时,模型具有最优的预测准确率(65%)(图5B)。10个属被鉴定为关键真菌物种分别是枝孢属(Cladosporium)、Uncla-ssified_o__Pleosporales、离蠕孢属(Bipolaris)、柱隔孢属(Ramularia)、棒孢属(Corynespora)、Unclassified_c__Sordariomycetes、汉纳酵母属(Hannaella)、Nigrospora、盾壳霉属(Coniothyrium)、Titaea(图5C)。

A:不同分类等级的内生真菌对泡桐健康状况预测的准确性;B:在随机森林模型中属水平内生真菌数量变化对模型预测准确性的影响;C:对随机森林模型预测准确性影响最大的十个内生真菌生物标志物。A: The accuracy of endophytic fungi of different taxonomic grades in predicting the health status of Paulownia; B: The effect of genus level endophytic fungus numbers changes on the prediction accuracy of random forest model; C:Ten endophytic fungal biomarkers that had the greatest influence on the prediction accuracy of random forest model.
进一步分析发现5个关键真菌物种在SL和HL中存在显著差异(图6),分别为Unclassified_o__Pleosporales、Coniothyrium、Hannaella、Cladosporium、Corynespora,其在SL样品中的丰度分别为12.70%、8.63%、5.84%、5.26%和0.13%,分别高于在HL样品中的丰度(0.16%、0.05%、0.01%、0.81%和0.00%)(p<0.05)。4种真菌在HB和SB样品存在显著差异,其中Corynespora、Cladosporium和Nigrospora在SB中的丰度分别为10.33%、8.14%和1.12%,均显著大于在HB样品中的丰度(0.52%、0.79%和0.08%)(p<0.05),而Ramularia在SB样品中的丰度(0.07%)小于HB样品(3.51%)。在SR和HR样品中,所有真菌丰度均无显著差异(p>0.05)。


A:叶样品;B:枝样品;C:根样品。A: Leaf samples; B: Branch samples; C: Root samples.
3 结论与讨论
泡桐丛枝病主要表现在地上部(枝和叶),关于根部的发病状况未见报道[11]。本研究结果表明,在丛枝病的枝中含有植原体,而在健康枝中未检测到植原体,表明植原体是导致丛枝病的主要原因。但在发病树的根中尽管也检测到了植原体,但是根部并不表现出发病症状,表明丛枝病不会导致地下部明显的病变[11]。
植物发生病害时可导致植物内生微生物群落结构的变化[12-13],而植物内生微生物群落也会因生境的不同而异[14]。本研究发现,生境和健康状况均是影响内生真菌群落结构的重要影响因素。丛枝病仅提高了枝中真菌群落的香农指数,但未改变叶和根中真菌群落的香农指数;此外,丛枝病未显著改变枝、叶和根中真菌群落的Chao1指数。总体来说,丛枝病对泡桐真菌α多样性影响有限。在枝和叶样品中,丛枝病显著改变了真菌群落β多样性,而未显著影响根样品中真菌群落β多样性。综合以上结果,丛枝病对地上部真菌群落结构影响较大,而对根部真菌群落结构影响不大,这可能是泡桐地上部表现出丛枝病而根部未表现出发病症状的重要原因之一。
随机森林机器学习法分析结果表明,泡桐丛枝病发病过程中存在10个关键的真菌物种。在患病枝和健康枝中有5种关键真菌物种(Unclassified_o__Pleosporales、Coniothyrium、Hannaella、Cladosporium和Corynespora)丰度存在显著差异,且在发病样品中的丰度均显著高于健康样品。在患病叶和健康叶有4种关键真菌物种存在显著差异,其中Corynespora、Cladosporium、Nigrospora的丰度在患病叶中的丰度显著高于健康叶,而Ramularia在患病叶中的丰度显著低于健康叶。所有关键真菌物种丰度在患病和健康泡桐的根中无显著差异。也就是说丛枝病提高了多数关键真菌物种在地上部的丰度,在这些真菌中,某些已经证明具有致病能力。例如,棒孢属中的多主棒孢 (Corynesporacassiicola)是一种重要的植物病原真菌,寄主范围广泛,能够侵染530余种植物[15]。棒孢属的另一种真菌Corynesporacassiicola可引起猕猴桃的叶斑病[16]。枝孢菌广泛分布于空气、土壤、食品、水体中,可作为病原菌侵染多种作物,葡萄的枝孢果腐病病原菌就是由枝孢菌中的枝状枝孢(Cladosporiumcladosporioides)和柠檬形枝孢(Cladosporiumlimoniforme)引起的[17]。Nigrospora属中的Nigrosporasphaerica可引起芒果枝枯病和叶斑病[18],Nigrosporaosmanthi可以引起桂花叶枯病[19]。这些结果表明,泡桐爆发丛枝病后,枝和叶中某些致病真菌也随之大量增殖,进而加剧了丛枝病对泡桐的危害程度。这种现象在其他林木中也有发现,例如桃树爆发流胶病时也有致病真菌增加的现象[12]。这些结果有助于加深对泡桐丛枝病爆发机制的认识,并为丛枝病的防治奠定理论基础。
