香菇蛋白酶解肽的活性炭脱色工艺优化
2023-10-28张玉陈祥坤王君虹李雪孙素玲王伟
张玉, 陈祥坤, 王君虹, 李雪, 孙素玲, 王伟,4*
(1.浙江省农业科学院 农产品质量安全与营养研究所, 浙江 杭州 310021; 2.农业农村部农产品信息溯源重点实验室,浙江 杭州 310021; 3.浙江省食品安全重点实验室, 浙江 杭州 310021; 4.浙江科技学院, 浙江 杭州 310023)
中国是食用菌生产大国, 中国食用菌协会发布《2018 年度全国食用菌统计调查结果分析》 表明,2018 年全国食用菌总产量达3 842.04 万t, 其中香菇是食用菌中的第一大品种, 产量达1 043.12 万t。香菇中富含多糖、蛋白质、膳食纤维、矿物质及维生素等多种人体所需的营养素[1-3], 具有抗肿瘤、抗病毒、抗菌、降血压等多种生理活性[4-8]。香菇中多糖含量最高, 其次是蛋白质, 不同香菇蛋白质含量以干物质计为18.0%~30.8%[9], 香菇蛋白富含有18 种氨基酸, 包括8 种人体必需氨基酸[10-11]。如何进一步高值化利用香菇蛋白质对于促进香菇产业链进一步延伸具有重要意义。
生物活性肽是对生命机体具有一定生理功能的肽类化合物, 相比蛋白具有易吸收、安全性好等优点, 因此, 深受研究者关注, 目前已从多种动植物蛋白中制备出具有抗氧化、降血糖、降血压等活性的多肽[12-17], 有研究利用不同蛋白酶对香菇蛋白进行酶解产生了多种具有不同活性的多肽, 如抗氧化肽、醒酒肽等[18-19]。笔者前期研究也发现, 香菇蛋白经中性蛋白酶酶解后, 具有较好的α-葡萄糖苷酶抑制活性。但香菇酶解肽的制备过程中, 酶解液中的色素不断增加, 最终酶解液呈棕色, 这对其进一步在食品工业中的应用造成了不利影响。目前常用的食品脱色纯化方法有活性炭吸附法、树脂层析法、超临界萃取法等[20-22], 其中活性炭吸附法相比其他方法简单易行, 且成本低, 适合工业化生产。本文采用活性炭吸附法对香菇酶解液进行脱色, 对脱色过程中的活性炭用量、脱色温度和脱色时间进行了优化, 建立了香菇酶解肽的最佳活性炭脱色工艺, 可为香菇酶解肽的进一步纯化及应用提供一定的技术支撑。
1 材料与方法
1.1 材料与试剂
干香菇, 农贸市场; 中性蛋白酶, 齐一生物科技 (上海) 有限公司; α-葡萄糖苷酶, 美国sigma公司。
1.2 仪器与设备
分析天平, 北京赛多利斯仪器有限公司;AMR-100 型全自动酶标分析仪, 杭州奥盛仪器有限公司; HZQ-B 恒温培养摇床, 苏州威尔实验用品有限公司; H-1650 型高速离心机, 长沙湘仪离心机有限公司; 冷冻干燥仪, FD-A10N-50 上海皓庄仪器有限公司; 超声波清洗机, 杭州宝珀超声波科技有限公司。
1.3 香菇肽的制备
香菇蛋白提取: 采用碱溶酸沉法提取香菇蛋白, 称取一定量香菇干粉, 按质量比1 ∶20 加蒸馏水溶解, 50 ℃超声提取60 min, 4 000 r·min-1离心15 min, 弃去沉淀, 上清液以1 mol·L-1HCl 溶液调pH 值至3.5, 离心, 去除上清液, 沉淀真空冷冻干燥, 得香菇蛋白。
香菇酶解肽制备: 称取5.0 g 的香菇蛋白于150 mL 锥形瓶中, 加入100 mL 蒸馏水搅拌混匀,调pH 值至7, 按酶底比3 000 U·g-1加入中性蛋白酶混合均匀, 放入摇床中以150 r·min-1的转速酶解4 h, 酶解结束后, 沸水浴5 min 使酶失活,冷却至室温, 4 000 r·min-1离心20 min, 取上清液进一步实验。
1.4 活性炭脱色的单因素实验
取50 mL 香菇酶解肽, 加入一定量的活性炭,调节温度, 振荡脱色一定时间后, 过滤, 取上清液测定脱色率及α-葡萄糖苷酶抑制活性保持率。
以活性炭用量10 g·L-1, 脱色温度40 ℃, 脱色时间30 min 作为基本固定因素, 改变其中1 个因素, 进行单因素实验, 比较不同脱色条件对香菇酶解肽脱色率和α-葡萄糖苷酶抑制活性保持率的影响。各因素梯度设计为: 活性炭用量2.5、5、10、15、20 g·L-1, 脱 色 时 间10、20、30、40、50 min, 脱色温度30、40、50、60、70 ℃。
1.5 活性炭脱色的正交实验
基于单因素实验结果选取3 个适宜水平进行正交实验, 以香菇酶解肽溶液的脱色率及α-葡萄糖苷酶抑制活性保持率的综合评分为指标, 确定香菇酶解肽活性炭脱色的最佳条件。实验因子水平如表1。
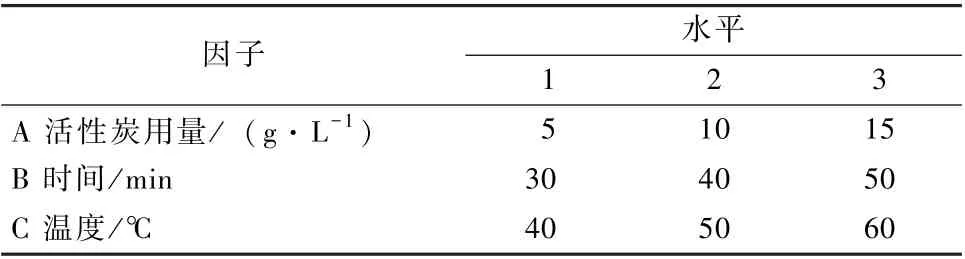
表1 正交实验因素与水平
1.6 脱色率的测定
采用分光光度法检测香菇酶解肽的脱色率。以水为参比溶液, 测定香菇酶解肽在420 nm 波长处的吸光值, 脱色率计算公式如下。
式中:Y表示脱色率,%;a表示脱色前的吸光度;b表示脱色后的吸光度。
1.7 α-葡萄糖苷酶抑制活性保持率的测定
参照张玉等[23]的方法进行。将100 μL 5 mg·mL-1α-葡萄糖苷酶溶液与50 μL 样品溶液加入酶标板中, 混合均匀, 在25 ℃下孵育10 min 后, 加入50 μL PNPG (5 mmol·L-1) 溶 液, 混 合 物 在-37 ℃下反应30 min, 加入50 μL 碳酸钠 (0.67 mol·L-1) 溶液终止反应。采用AMR-100 自动酶标记分析仪在405 nm 波长下测定吸光度值。计算α-葡萄糖苷酶抑制活性, α-葡萄糖苷酶抑制活性为对照组吸光值与样品组吸光值之差除以对照组吸光值再乘以100。α-葡萄糖苷酶抑制活性保持率为脱色后α-葡萄糖苷酶抑制活性占脱色前α-葡萄糖苷酶抑制活性的百分比。
1.8 综合评价
综合考虑脱色率和α-葡萄糖苷酶抑制活性保持率两项指标, 采用加权评分法, 脱色率和α-葡萄糖苷酶抑制活性保持率分别除以同列最大值再乘以100, 所得数值进一步进行加权求和, 得到综合评分, 综合评分为0.5 乘以脱色率加上0.5 乘以α-葡萄糖苷酶抑制活性保持率。
1.9 挥发性成分分析
取酶解液5 mL 于顶空瓶中, 加1.5 g 氯化钠后密封。用固相微萃取 (SPME) 萃取头50 ℃萃取30 min, 气相色谱250 ℃解吸5 min, 不分流进样。色谱 柱: HP-5 MS Ultra (0.25 mm×60 mm,0.25 μm); 程序升温条件: 初始温度为50 ℃, 保持5 min, 以5 ℃·min-1的速率升至150 ℃, 保持5 min, 然 后 以6 ℃·min-1升 至250 ℃, 保 持6 min。载气为氦气, 流速为1 mL·min-1, EI 源,温度为250 ℃, 扫描范围为35~650 amu。
2 结果与分析
2.1 不同活性炭用量对香菇酶解肽脱色效果的影响
如图1 所示, 当活性炭用量在2.5~10 g·L-1,随着活性炭用量的增加, 脱色率呈快速上升趋势,10 g·L-1的脱色率显著高于2.5 和5 g·L-1(P<0.05)。当活性炭用量高于10 g·L-1之后, 脱色率随着活性炭用量的增加, 变化较缓, 可能是由于活性炭含量达10 g·L-1时, 其对色素的吸附量已趋于平衡。α-葡萄糖苷酶抑制活性保持率则随着活性炭用量的增加不断降低。由于脱色率和活性保持率成反比关系, 综合考虑脱色率和活性保持率的影响, 进一步进行综合评分, 结果如图2 所示, 随着活性炭的增加, 综合评分呈先上升后保持的趋势,在活性炭用量为10 g·L-1之后, 综合评分变化平缓, 因此, 选择10 g·L-1作为最佳活性炭用量。
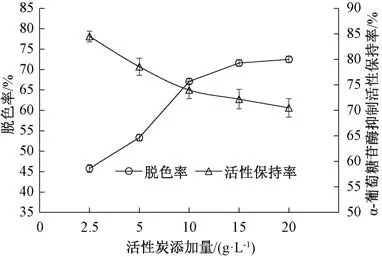
图1 活性炭用量对香菇酶解肽脱色率与α-葡萄糖苷酶抑制活性保持率的影响

图2 活性炭用量对香菇酶解肽脱色效果综合评分的影响
2.2 不同脱色时间对香菇酶解肽脱色效果的影响
如图3 所示, 随着脱色时间的增加, 脱色率总体呈先上升后下降趋势, 脱色时间40 min 时脱色率达最大, 而后下降, 可能是随着时间延长, 部分吸附的色素又重新溶解, 导致脱色率降低。α-葡萄糖苷酶抑制活性保持率在30 min 内呈下降趋势,而后略有上升, 差异不显著 (P<0.05)。进一步对脱色率和活α-葡萄糖苷酶抑制活性保持率进行综合评分, 结果显示, 随着脱色时间的增加, 综合评分呈先上升后下降的趋势, 当脱色时间为40 min时, 样品综合评分最高 (图4)。因此, 选择40 min 作为最佳的脱色时间。
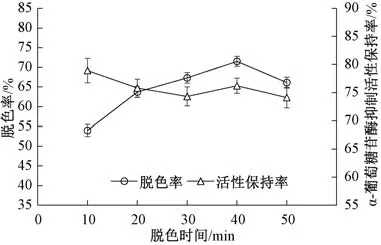
图3 脱色时间对香菇酶解肽脱色率与α-葡萄糖苷酶抑制活性保持率的影响

图4 脱色时间对香菇酶解肽脱色效果综合评分的影响
2.3 不同脱色温度对香菇酶解肽脱色效果的影响
如图5 所示, 随着脱色温度的增加, 脱色率呈先上升后下降的趋势, 于50 ℃时脱色率达最大,而后随着脱色温度增加呈下降趋势, 这可能是随着温度升高, 分子运动加快, 增加了色素与活性炭的接触, 因此, 脱色率上升, 当温度过高后, 色素分子结构被破坏, 色素的解吸速度加快, 导致脱色率有所下降。α-葡萄糖苷酶抑制活性保持率在50 ℃内随着温度升高呈下降趋势, 而后略有上升, 差异不显著 (P<0.05)。进一步对脱色率和α-葡萄糖苷酶抑制活性保持率进行综合评分, 结果显示, 随着脱色温度的增加, 综合评分呈先上升后下降的趋势, 当脱色温度为50 ℃时, 样品综合评分最高(图6)。因此, 选择50 ℃作为最佳的脱色温度。
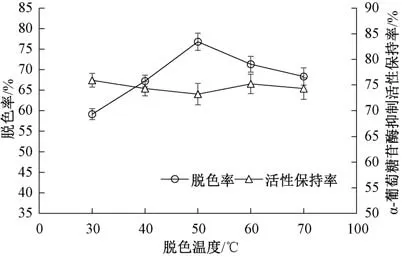
图5 脱色温度对香菇酶解肽脱色率与α-葡萄糖苷酶抑制活性保持率的影响

图6 脱色温度对香菇酶解肽脱色效果综合评分的影响
2.4 正交实验结果与分析
根据单因素实验, 采用L9(3)4正交实验设计, 对香菇酶解肽活性炭脱色条件进行优化, 具体实验设计及实验结果见表2, 进一步对正交实验进行了极差分析, 相关结果见表3。脱色率的极差R结果显示A>C>B, 即影响香菇酶解肽脱色率的因素依次是活性炭用量 (A)、温度 (C) 和时间(B), 最优组合为A3B2C2, 即活性炭用量15 g·L-1、吸附时间40 min、吸附温度50 ℃。α-葡萄糖苷酶抑制活性保持率的极差R结果显示A>C>B,即影响香菇酶解肽α-葡萄糖苷酶抑制活性保持率的因素依次是活性炭用量 (A)、温度 (C) 和时间 (B), 最优组合为A1B2C1, 即活性炭用量5 g·L-1、吸附时间40 min、吸附温度40 ℃。综合评分极差R结果显示A>B>C, 即影响香菇酶解肽脱色综合评分的因素依次是活性炭用量 (A)、时间(B) 和温度 (C), 最优组合为A3B2C2, 即活性炭用量15 g·L-1、吸附时间40 min、吸附温度50 ℃。综合评分与脱色率最优条件相一致, 因此, 选择综合评分最佳条件作为优化后的脱色条件。
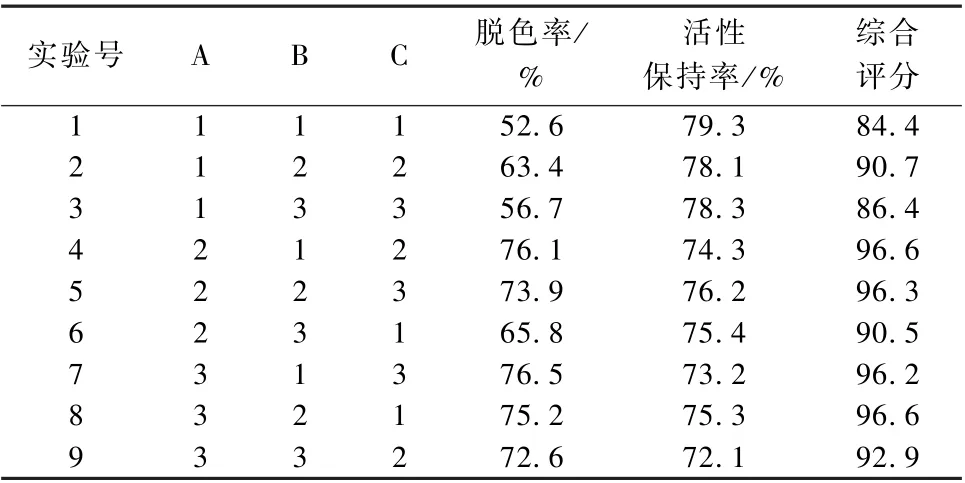
表2 正交实验结果

表3 正交实验结果统计分析
2.5 最优工艺验证
使用优化后的条件即活性炭用量15 g·L-1、吸附时间 40 min、吸附温度 50 ℃, 进行脱色处理, 并测定脱色率和α-葡萄糖苷酶抑制活性保持率, 结果显示, 香菇酶解肽脱色率和α-葡萄糖苷酶抑制活性保持率分别为 (80.5±1.9)%和 (74.1±2.3)%。
由于活性炭同时具有清除气味的作用, 因此,进一步对脱色后酶解肽的挥发性成分进行分析, 香菇酶解肽的主要挥发成分可分为醇类化合物、酯类化合物、酮类化合物、含硫化合物、烷类化合物、酸类化合物、吡嗪类化合物, 其中含硫化合物含量最高, 占挥发成分总量的55.0%, 其次为醇类化合物占挥发成分总量的28.1%。脱色后香菇酶解液中挥发成分总含量显著降低, 总清除率为90.8%, 其中含硫化合物的清除率为87.1%, 醇类化合物的清除率为94.7%, 酮类化合物的清除率为88.7%, 烷类化合物的清除率为97.6%, 吡嗪类化合物的清除率为99.2% (图7)。
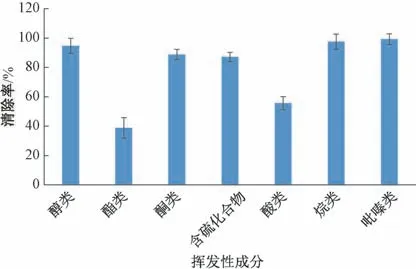
图7 脱色后香菇酶解肽的挥发性成分清除率
3 讨论与结论
活性肽具有价格低廉, 操作工艺简单, 安全无毒, 且易于去除的特点, 广泛地用于食品工业的色素去除工艺, 尤其是蛋白、多糖、皂苷等成分的提取纯化过程[21-22,24], 但对于不同产品的色素, 活性炭吸附的最佳条件不同, 本实验研究了活性炭对香菇酶解肽脱色效果的影响, 通过单因素实验结合正交实验对活性炭用量、脱色时间和脱色温度进行了优化, 得到了香菇酶解肽的活性炭脱色最佳条件,即活性炭用量15 g·L-1、脱色时间40 min、脱色温度50 ℃。在该条件下获得的酶解肽脱色率为80.5%, α-葡萄糖苷酶抑制活性保持率为74.1%。
活性炭不仅对色素具有良好的吸附效果, 对挥发成分也具有优良的吸附效果[25-26], 香菇酶解肽含有大量含硫化合物等挥发成分, 影响了香菇酶解肽的风味, 通过此条件脱色所得的酶解肽的挥发成分总清除率可达90.8%。所得的香菇酶解肽产品呈淡黄色, 无刺激性气味, 可用于食品或保健食品的生产, 该研究可为香菇蛋白的进一步开发利用提供技术支撑。
