特应性皮炎患儿血清维生素D 水平和补充维生素D 疗效的系统评价
2023-10-27王佳宁闫小宁李文彬
陈 曦 王佳宁 孙 丹 闫小宁 李文彬
1.陕西中医药大学第一临床医学院,陕西咸阳 712046;2.陕西省中医医院皮肤科,陕西西安 710003
特应性皮炎(atopic dermatitis,AD)是一种常见的慢性和复发性炎症性皮肤疾病,多以瘙痒、湿疹及皮肤干燥为主要特征[1]。AD 最常出现在儿童时期,全世界儿童AD 的累积发病率为10%~20%[2],近几十年来患病率仍在逐渐增加。常规治疗方法可能难以控制AD 的发病进展,免疫抑制剂可能的不良反应限制了其在青少年中的应用[3]。研究表明,AD 的发展机制与皮肤屏障功能障碍和免疫反应失调有关,维生素D可以增强表皮屏障[4-5]。部分研究认为,25 羟维生素D[25-hydroxyvitamin D,25(OH)D]的缺乏可能是AD 病理生理学中需要考虑的因素,但在临床试验和观察性研究中得到的结果是有争议的[6]。本研究通过对纳入文献的系统分析,以此确定AD 患儿的血清25(OH)D水平,并通过对维生素D 干预治疗的文献进行系统分析以评价维生素D 治疗AD 的有效性,以期为临床提供循证医学证据。
1 资料与方法
1.1 检索策略
检索PubMed、EMbase、中国知网、万方学术期刊数据库、维普中文期刊数据库自2010 年1 月至2022年11 月发表的文献。检索相关中文关键词:维生素D、VD、儿童特应性皮炎、特应性皮炎患儿;英文关键词:Vitamin D、Vit D、children/child with Atopic Dermatitis、AD。
1.2 纳入及排除标准
1.2.1 纳入标准 ①纳入文献为随机对照试验(randomized controlled trial,RCT)、病例对照研究,无论采用盲法、隐藏分组与否;②纳入患者为儿童(年龄<18岁);③RCT 研究采用特异性皮炎评分(scoring of atopic dermatitis,SCORAD)或湿疹面积及严重程度指数(eczema area and severity index,EASI)对AD 的严重程度进行评估,不限是否随访;④病例对照中研究25(OH)D 水平;⑤纳入AD 患儿符合Hanifin-Rajka 标准、Williams 特应性皮炎诊断标准其中之一[7]。
1.2.2 排除标准 文献类型为系统评价、综述、前后对照试验、个案报道等。
1.3 统计学方法
使用Cochrane 协作组提供的RevMan 5.3 软件对数据进行分析。计量资料单位统一选用加权均数差(weighted mean difference,WMD),单位不统一时使用标准化均数差(standardized mean difference,SMD),使用95%CI 表示。异质性检验采用χ2检验,P>0.05,I2≤50%时,可认为多个研究具有同质性,采用固定效应模型,反之使用随机效应模型。
1.4 文献筛选、资料提取
由3 名研究者独立筛选文献、提取资料后进行交叉核对,如遇分歧,则讨论解决或交由第三方进行判定。资料提取包括:①纳入研究的基本信息,第一作者、标题、发表年份及发表期刊等;②患者的基本情况、例数等;③干预措施,包括使用的药物、疗程等;④结局指标的判定标准及测量的数据。
2 结果
2.1 检索结果
按检索策略最终纳入20 篇文献,其中5 篇[8-12]RCT 及15 篇[13-27]病例对照研究文献,见图1。纳入研究的基本特征见表1~2。

表1 纳入RCTs 研究基本特征
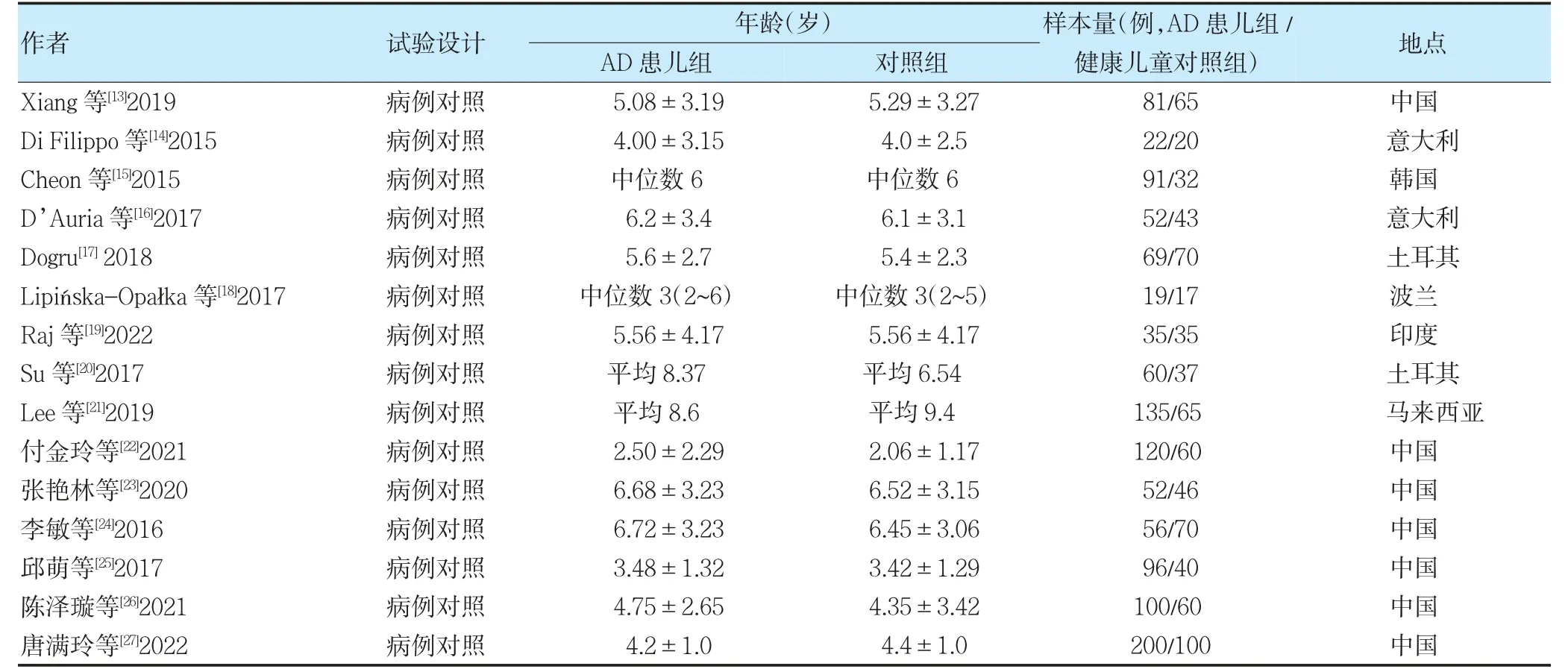
表2 纳入病例对照研究的基本特征

图1 文献筛选流程及结果
2.2 RCT 文献偏倚风险
①盲法使用:3 篇[8-10]使用双盲;②随机序列的产生:3 篇[8-10]对具体随机序列产生方法进行了描述,余2 篇[11-12]仅提到“随机”;③分配隐藏:3 篇[8-10]使用分配隐藏,1 篇[8]使用信封隐藏,2 篇[9-10]使用瓶子分配隐藏;④对结果分析者使用的盲法:3 篇[8-10]提及使用对分析者的盲法;⑤结局数据不完整产生的偏倚:无。⑥选择性发表:均未提及。见图2。

图2 文献偏倚风险图
2.3 meta 分析结果
2.3.1 RCT 研究中EASI 2 项研究[8,10]共191 例患儿报道了EASI,各研究具有同质性(P=0.51,I2=0%),采用固定效应模型。结果显示,试验组EASI 高于对照组[WMD=-3.79,95%CI(-6.38,-1.20),P=0.004]。见图3。
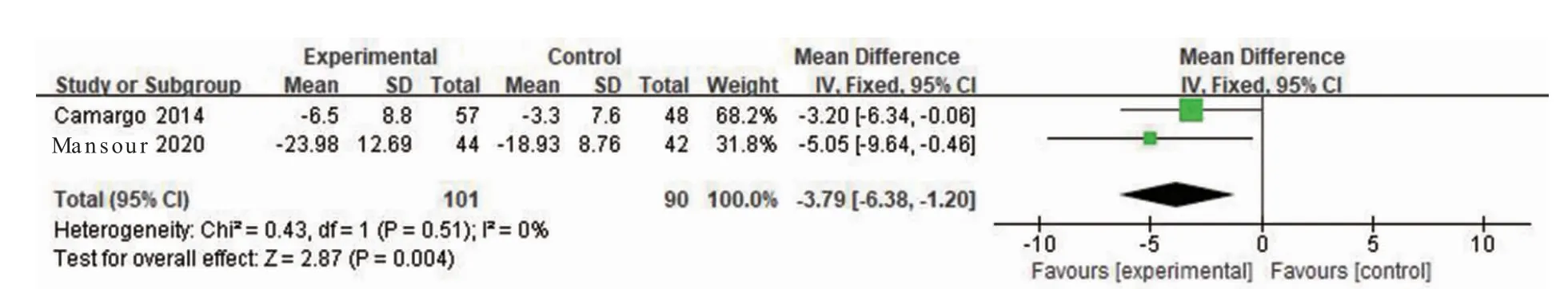
图3 维生素D 治疗AD 的EASI 森林图
2.3.2 RCT 研究 中SCORAD 3 项研究[9,11-12]共110 例患儿报道了SCORAD,各研究具有同质性(P=0.58,I2=0%),故采用固定效应模型。结果显示,试验组SCORAD 评分高于对照组 [WMD=-6.06,95%CI(-10.12,-2.00),P=0.003]。见图4。

图4 维生素D 治疗AD 的SCORAD 指数森林图
2.3.3 病例对照研究中血清25(OH)D 水平 纳入15 项研究[13-27]共1 948 例患儿,通过比较两组血清25(OH)D 水平,各研究间具有异质性(P<0.000 01,I2=93%),采用随机效应模型,其中血清25(OH)D 单位不同,进行亚组分析。结果显示,AD 患儿组血清25(OH)D 水平低于对照组[SMD=-0.80,95%CI(-1.18,-0.41),P<0.000 1]。见图5。
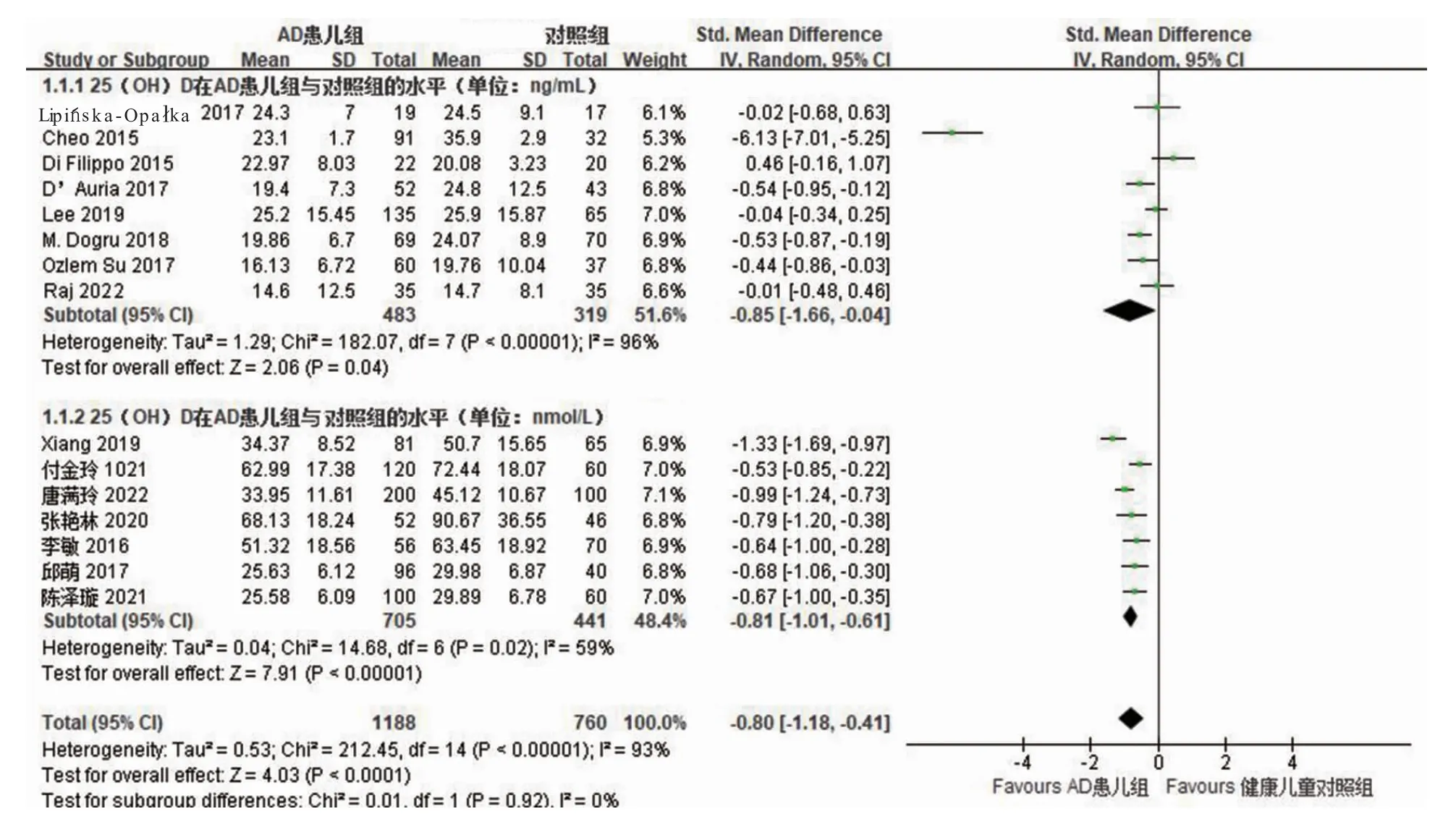
图5 血清25(OH)D 水平的森林图
3 讨论
皮肤在宿主防御微生物入侵和过敏原渗透方面起着重要作用。AD 患儿皮肤树突状细胞(dendritic cells,DCs)的异常可能是导致AD 发病的原因,同时造成过敏原高反应性和对感染的易感性增加[24]。近年来研究表明,维生素D 的缺乏与AD 的发病率和严重程度有关。维生素D 是一种主要在皮肤中合成的脂溶性维生素,它参与了先天和适应性免疫系统的重要调节机制[28]。维生素D 对免疫细胞有广泛的影响,包括单核细胞、淋巴细胞和DCs,他们都表达维生素D受体。驻扎在皮肤的DCs,如朗格汉斯细胞和真皮DCs,有助于识别和捕获过敏原和外来抗原,并激活先天和适应性免疫,最终导致IgE 介导的过敏反应[22]。同时,维生素D 已被证明在维持表皮的渗透性屏障方面具有有益作用,其可能通过增强渗透性屏障的完整性和抗菌肽的表达,以及抑制炎症反应,在AD 的发病机制中发挥关键作用[15]。补充维生素D 可以促进免疫力和表皮屏障完整性的改变,有可能改善AD 的临床表现,所以补充维生素D 作为一种辅助治疗手段是有用的[14]。
本研究的局限性:①纳入RCT 过少;②纳入RCT观察指标较少;③纳入研究的治疗周期未统一,可能对结果存在影响;④由于各地区阳光照射不同或季节未限定,不同地区、季节的维生素D 基线水平差异很大,结果可能会有异质性。
综上所述,AD 患儿有很高的维生素D 缺乏的风险,补充维生素D 可改善AD 患儿临床症状,但该结论仍需更多双盲、多中心、大样本、远期随访的高质量RCT 来验证。
