Rufibacter hautae NBS58-1胞外多糖的抗氧化活性及其在草莓保鲜中的应用
2023-10-24李春雨屈建航
李春雨,屈建航,周 佳,赵 帅,罗 宇
河南工业大学 生物工程学院,河南 郑州 450001
微生物胞外多糖(exopolysaccharides,EPS)是微生物在生长代谢过程中产生的对其本身有保护作用的生物高聚物,具有获取成本较低、制备方法简便、天然、无毒、可生物降解等优点。近年来,大量研究表明微生物EPS具有乳化、絮凝、抗氧化、抗肿瘤、免疫调节、抗炎和降血糖等多种活性[1],在医药、食品、化工等领域具有较高的经济价值和广阔的应用前景。
微生物EPS具有较好的抗氧化能力,能减轻自由基等对机体造成的氧化损伤。臧文晶等[2]发现肠膜明串珠菌LeuconostocmesenteroidesHDE1的胞外多糖具有较高的抗氧化活性并与质量浓度呈正相关。乔少婷等[3]报道嗜热链球菌StreptococcusthermophilusMGB80-7胞外多糖质量浓度为0~1 mg/mL时,EPS对超氧阴离子的清除能力优于阳性对照(Vc)。刘哲[4]发现两种微藻胞外多糖分别与壳聚糖复配后用于圣女果保鲜,比单一使用壳聚糖分别增加了4、6 d的货架期。Yuan等[5]在研究中发现强雄腐霉胞外多糖PEPS-2具有较好的体外抗氧化能力,可显著提高草莓采后的生理品质,有效延缓草莓腐烂、延长货架期。
抗氧化剂能有效防止或延缓氧化,但人工合成抗氧化剂往往毒副作用较大、应用范围窄,因此寻找新型抗氧化剂成为当前的研究趋势。微生物胞外多糖有望成为天然抗氧化剂开发的重要对象,在食品、医药等行业备受国内外研究者的关注。作者对红杆菌RufibacterhautaeNBS58-1的胞外多糖进行提取纯化,分析其单糖组成和分子量,并对抗氧化活性及应用进行探究,为微生物胞外多糖的菌物资源开发及其相关应用奠定理论基础。
1 材料与方法
1.1 材料
菌株:RufibacterhautaeNBS58-1,为河南工业大学环境微生物技术团队自太湖淤泥中分离筛选和鉴定[6]。
R2A培养基[6]:葡萄糖0.5 g/L、酵母浸粉0.5 g/L、酸水解酪蛋白0.5 g/L、胰蛋白胨0.5 g/L、可溶性淀粉0.5 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠0.3 g/L,pH 7.0。固体培养基加入琼脂粉15 g/L,115 ℃灭菌30 min。
产糖培养基[7]:经优化后的产糖培养基成分为蔗糖14.13 g/L、酵母浸粉1 g/L、可溶性淀粉0.5 g/L、K2HPO4·3H2O 0.3 g/L、MgSO4·7H2O 0.05 g/L、丙酮酸钠0.3 g/L、pH 7.5,115 ℃灭菌30 min。
草莓:从当地水果超市购买大小、形状和成熟度相似且无视觉缺陷的新鲜草莓。
1.2 试剂与仪器
蔗糖、酵母浸粉、可溶性淀粉、丙酮酸钠、无水乙醇、琼脂粉、正丁醇、三氯化铁:分析纯,天津市科密欧化学试剂有限公司;抗坏血酸:分析纯,北京奥博星生物技术有限公司;三氟乙酸、磷酸、DPPH、ABTS、铁氰化钾:生工生物工程(上海)有限公司;硫代巴比妥酸、1,10-菲罗啉:北京索莱宝科技有限公司;氯仿:郑州轩之成化工科技有限公司。
TGL-16G高速离心机:上海安亭科学仪器厂;旋转蒸发仪:郑州长城科贸有限公司;UV-2450紫外可见分光光度计、LC-20AD高效液相色谱仪、LC20AT高效液相色谱泵、RID-20示差折光检测器:日本Shimadzu(岛津)公司;酶标仪:美国Bio Tek公司;WYT手持式折射仪:成都豪创光电仪器有限公司;Sepharose CL-6B 柱:上海联硕生物科技有限公司。
1.3 试验方法
1.3.1 菌株培养
将-80 ℃存放的菌种于R2A固体培养基上进行活化。挑取NBS58-1新鲜菌落,接种至R2A液体培养基中培养(28 ℃,150 r/min)58 h作为种子液,将种子液以5%(V/V)的接种量接至产糖培养基中培养(23 ℃,150 r/min)2 d进行发酵产糖。
1.3.2 胞外多糖的提取纯化
胞外多糖的提取纯化方法参照Wang等[8]的方法并稍加修改。发酵液10 000 r/min离心10 min,取上清液通过旋转蒸发仪(55 ℃,0.1 MPa)浓缩至原体积的1/5。加入Sevag试剂(V(氯仿)∶V(正丁醇)=4∶1)对浓缩液除蛋白,之后加入4倍体积无水乙醇,沉淀冷冻干燥得到粗多糖。蒸馏水溶解粗多糖,在蒸馏水中透析2 d,透析后的溶液使用0.22 μm滤膜过滤,经Sepharose CL-6B 柱(2.5 cm×60 cm)纯化,收集馏分再次醇沉,冻干得到该菌的胞外多糖,命名为EPS-1。
1.3.3 胞外多糖单糖组成测定
以甘露糖、核糖、鼠李糖等制作混合标准对照溶液,衍生后经检测绘制标准曲线。用三氟乙酸(2 mol/L)将样品酸解(120 ℃,4 h),所得酸解产物经NaOH、PMP-甲醇衍生后,利用高效液相色谱测定并结合标准品出峰时间得到EPS-1单糖组成。
1.3.4 胞外多糖分子量测定
采用水相凝胶渗透色谱(Gel permeation chromatography,GPC)测定纯化后EPS-1的分子量,流动相为0.1 mol/L NaNO3和0.05% NaN3,流速为0.6 mL/min,进样量为20 μL。
1.3.5 胞外多糖体外抗氧化活性检测
(1)参照Hu等[9]使用的方法测定EPS-1对羟基自由基的清除率,羟基自由基清除率=(D0-D1+D2)/D0×100%,其中,D1为加入EPS-1反应的吸光度,D0为用蒸馏水替代EPS-1的反应结果,D2为用蒸馏水替代H2O2的结果。同时,以抗坏血酸(Vc)作为阳性对照。
(2)参照Wang等[10]使用的方法测定EPS-1对ABTS自由基的清除率,ABTS清除率=(D0-D1+D2)/D0×100%。
(3)参照Tang等[11]使用的方法测定EPS-1对DPPH自由基的清除率,DPPH清除率=(D0-D1+D2)/D0×100%。
(4)参照Chen等[12]的方法测定EPS-1的总还原力。
1.3.6 胞外多糖在草莓保鲜中的应用
使用75%乙醇先对草莓表面进行喷雾消毒处理,自然风干后将所有草莓分为两组:A组在8% EPS-1溶液中浸泡5 min,风干,然后室温放置7 d;B组作为对照组,将草莓浸泡在超纯水中,并与A组以相同的方式操作。
(1)采用Martínez等[13]使用的方法检测草莓果实的质量损失率。每24 h测定1次草莓的质量,计算草莓质量损失率。质量损失率=(m1-m2)/m1×100%,其中,m1为样品初始质量,g;m2为储存后样品质量,g。
(2)采用手持式折射仪WYT测定草莓中可溶性固形物含量(SSC)并以百分比表示。
(3)参照Jiang等[14]使用的方法测定草莓中MDA(丙二醛)含量。将1 g草莓样品和5 mL预冷的5%三氯乙酸放置冰上研磨,研磨液于4 ℃离心15 min(10 000 r/min)。将2 mL上清液与2 mL 0.67%的硫代巴比妥酸混合,100 ℃水浴20 min后迅速冰浴5 min,4 ℃离心15 min(10 000 r/min)后分别测定上清液在450、532、600 nm处的吸光度。MDA含量=6.45×(D(532)-D(600))-0.56×D(450)。
(4)采用袁志香[15]使用的方法绘制抗坏血酸标准曲线并测定草莓中抗坏血酸含量。同1.3.6中(3)的方法研磨草莓并离心后,向上清液中加入5% 三氯乙酸、无水乙醇、0.4%磷酸、0.5% 1,10-菲罗啉和0.03%三氯化铁溶液各1 mL,混合均匀后在30 ℃反应1 h并记录在510 nm处的吸光度,对照标准曲线计算VC含量。
1.4 数据处理
所有试验设置3个平行,结果以“平均值±标准差”表示。使用Excel 2019分析数据、SPSS 26分析差异显著性、Origin 2021b制图。
2 结果与分析
2.1 单糖组成与分子量分析
如图1所示,该多糖由葡萄糖、甘露糖、核糖、半乳糖、阿拉伯糖、木糖、半乳糖醛酸、鼠李糖、岩藻糖和葡萄糖醛酸组成,摩尔比为80.33∶11∶2.84∶2.74∶1.79∶0.61∶0.26∶0.17∶0.15∶0.1。GPC检测结果显示EPS-1分子量为4 652。
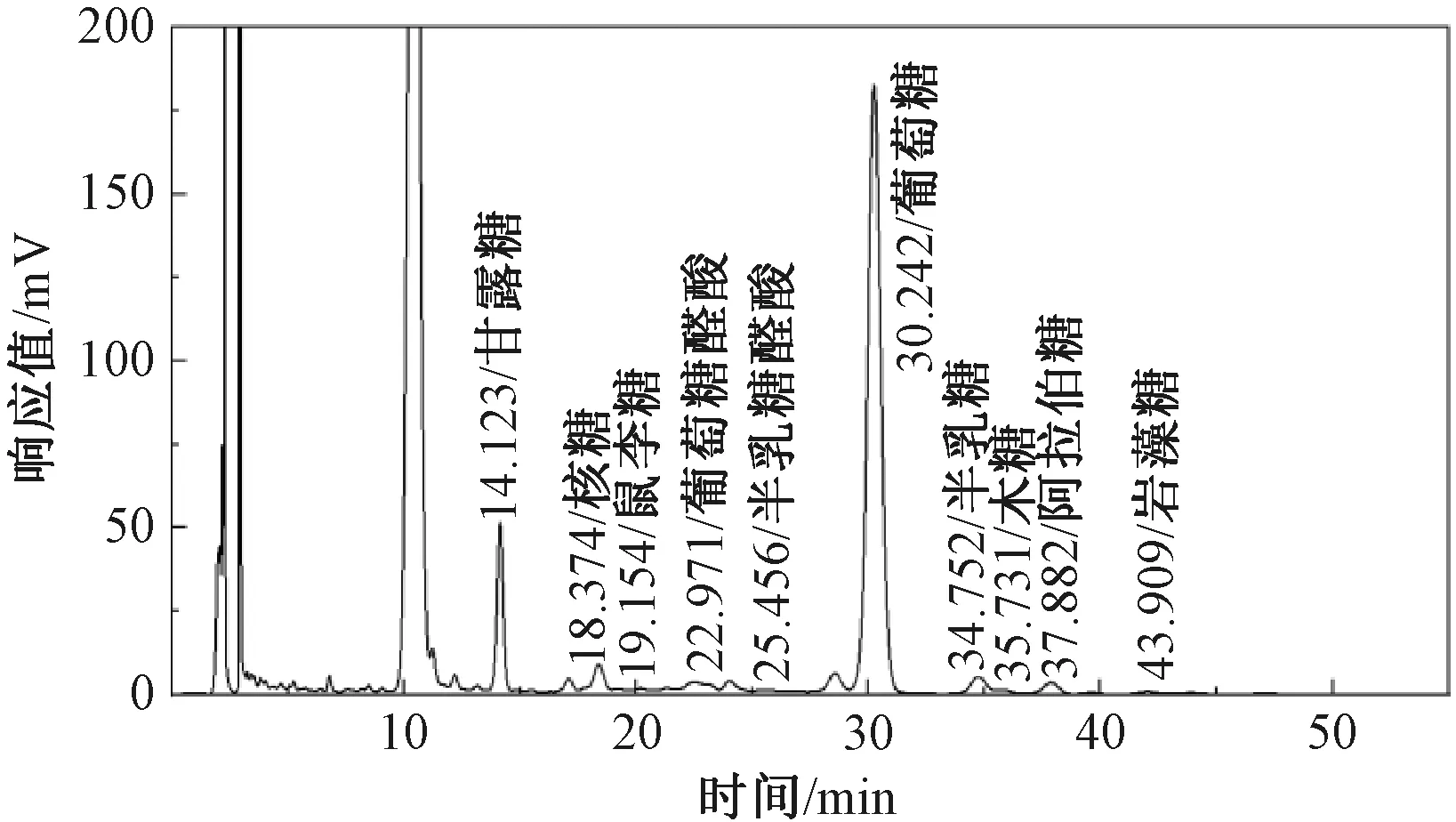
图1 胞外多糖EPS-1高效液相色谱图Fig.1 HPLC spectrum of exopolysaccharide EPS-1
2.2 胞外多糖抗氧化活性分析
EPS-1对ABTS自由基的清除能力如图2(a)所示,在0~5 mg/mL范围内,其清除率随着质量浓度的增加显著增大,但在同一质量浓度下,EPS-1的清除率均显著低于阳性对照Vc。EPS-1质量浓度为5 mg/mL时对ABTS自由基的清除率达到(81.48±2.09)%,与发酵乳杆菌CECT 5716 EPS(8 mg/mL)的清除率(35.37±1.24)%相比,具有一定优势[16]。
DPPH是一种很稳定的自由基,EPS可提供电子或氢将DPPH自由基还原为非自由基形式(DPPH-H),从而发挥抗氧化作用[17]。如图2(b)所示,EPS-1、Vc对DPPH自由基的清除能力均与质量浓度呈正相关,在质量浓度为5 mg/mL时,清除率分别为(41.47±0.37)%、100%,说明此浓度范围内EPS-1对DPPH的清除能力有限,在实际应用中可考虑增加其使用浓度以提高清除率。
羟基自由基很容易穿过细胞膜,形成断裂的DNA链,并具有引发癌症、突变和细胞毒性的能力,是生物系统中最活跃的自由基[18]。如图2(c)所示,EPS-1与Vc均表现出羟基自由基清除活性,且呈剂量依赖。EPS-1质量浓度为5 mg/mL时对羟基自由基的清除率达到(91.59±0.73)%,此时的清除率仍显著低于Vc,但高于丁涛等[19]报道的乳酸芽孢杆菌胞外多糖的清除率,表明EPS-1在羟自由基清除方面具有一定的优势。
总还原力是评价样品抗氧化活性的重要指标,具有还原力的物质可以提供氢原子来阻断过氧化物的形成,进而破坏自由基反应链,展现抗氧化能力[2]。如图2(d)所示,在0~5 mg/mL范围内,EPS-1的总还原力随着质量浓度的增大而增大,5 mg/mL时的D(700)为0.29,表明EPS-1具有一定的还原能力。
方伟等[16]报道的发酵乳杆菌(Lactobacillusfermentium)CECT 5716的EPS在质量浓度为8 mg/mL时,对DPPH和ABTS自由基的清除率分别为(84.17±1.30)%和(35.37±1.24)%。王琪[20]从罗汉果内生菌筛选出产胞外多糖菌株,命名为Bacillussp.LHG-3,所产EPS-A(10 mg/mL)和EPS-B(10 mg/mL)对羟基自由基的清除率分别为(70.12±1.12)%和(68.51±0.58)%,对DPPH自由基的清除率分别为(60.57±0.43)%和(65.72±0.24)%,对ABTS自由基的清除率分别为(78.67±0.16)%和(80.51±0.15)%。邝嘉华等[21]研究解淀粉芽孢杆菌DMBA-K4所产EPS的抗氧化活性,当EPS质量浓度为5 mg/mL时,对DPPH自由基清除率高达78.60%,对羟基自由基清除率为75.47%,表明该EPS具有较强的抗氧化活性。本研究中RufibacterhautaeNBS58-1的胞外多糖EPS-1在质量浓度为5 mg/mL时对ABTS、DPPH和羟基自由基的清除率分别为(81.48±2.09)%、(41.47±0.37)%和(91.59±0.73)%。相比较之下,R.hautaeNBS58-1 EPS-1能更有效清除羟基、ABTS和DPPH自由基。
2.3 草莓质量损失率分析
草莓的质量损失率是反映草莓储藏过程中呼吸速率和水分蒸发的重要参数。如图3所示,EPS组和对照组草莓果实质量损失率随着储藏时间的增加均不断增大,同一时期,二者质量损失率差异均不显著,但EPS组的质量损失率均小于对照组。存放7 d时,对照组的质量损失率为(59.41±3.02)%,而EPS处理组的质量损失率为(55.58±0.89)%,说明经EPS-1处理后能在一定程度上减少草莓水分的蒸发,降低草莓的质量损失率。
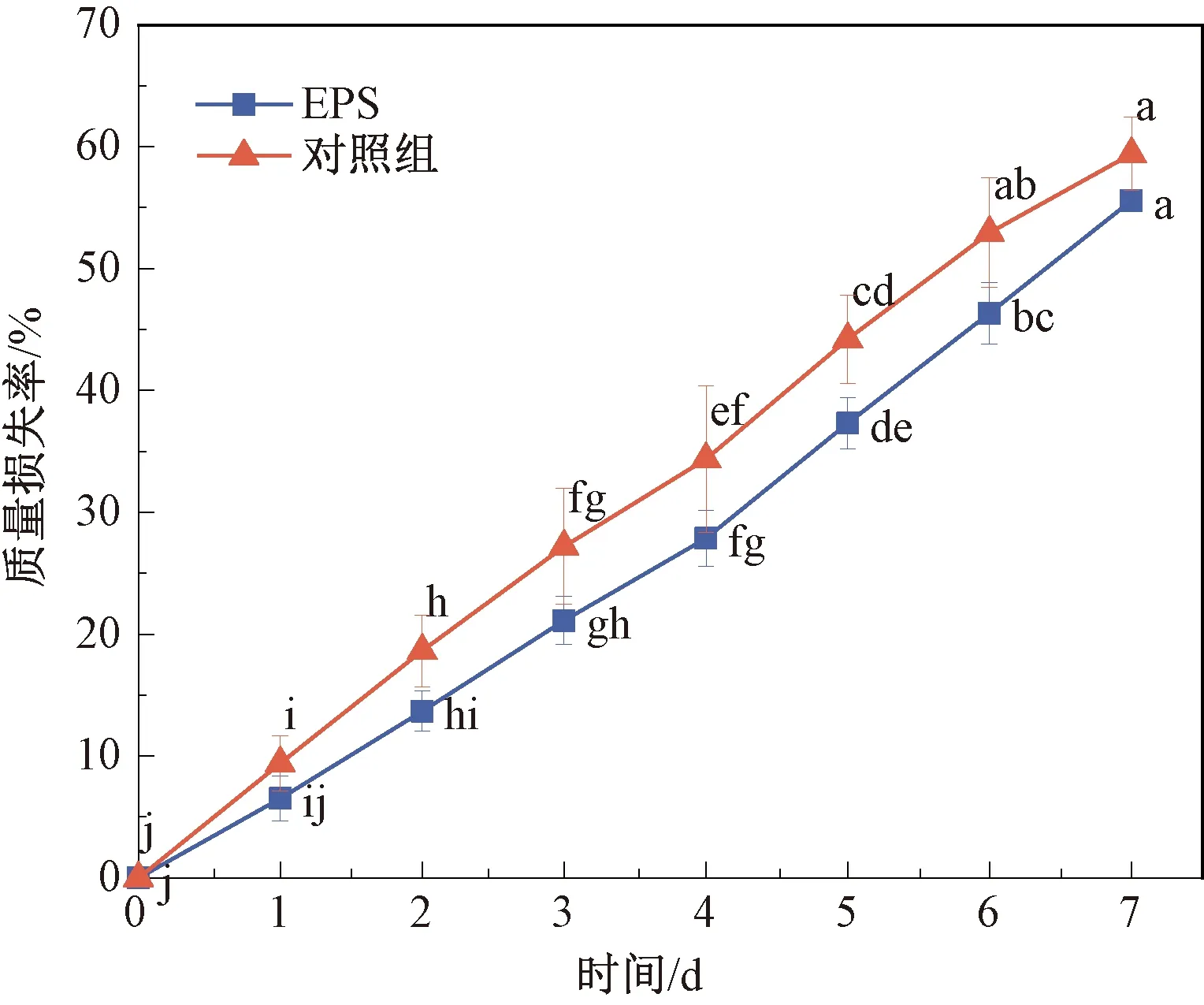
图3 草莓果实质量损失率Fig.3 Mass loss rate of strawberry fruit
2.4 SSC含量分析
水果中的可溶性固形物主要是糖和有机酸,测定SSC含量可以反映果实中营养物质的保留情况[22]。可溶性固形物含量低意味着果实甜度会随之降低[23]。两组草莓果实中SSC含量变化如图4所示,0~7 d,二者SSC含量均呈现出先增大后减小的趋势,可能是因为草莓原始代谢过程中碳水化合物转化为糖和其他可溶性化合物,从而使SSC含量增加;之后呼吸过程中又快速消耗SSC,导致其含量下降[14]。在第2天时,EPS组和对照组草莓中SSC含量达到最大且两组间差异不显著,分别为(9.17±0.12)%和(8.93±0.15)%,第2天后,SSC含量开始下降。储藏7 d,EPS组SSC含量为(7.03±0.12)%,显著高于对照组SSC含量(6.27±0.21)%。表明EPS-1的使用减少草莓呼吸过程中对SSC的消耗,更有利于保持可溶性固形物含量、维持草莓的品质和风味,从而提高草莓的储藏保鲜效果。
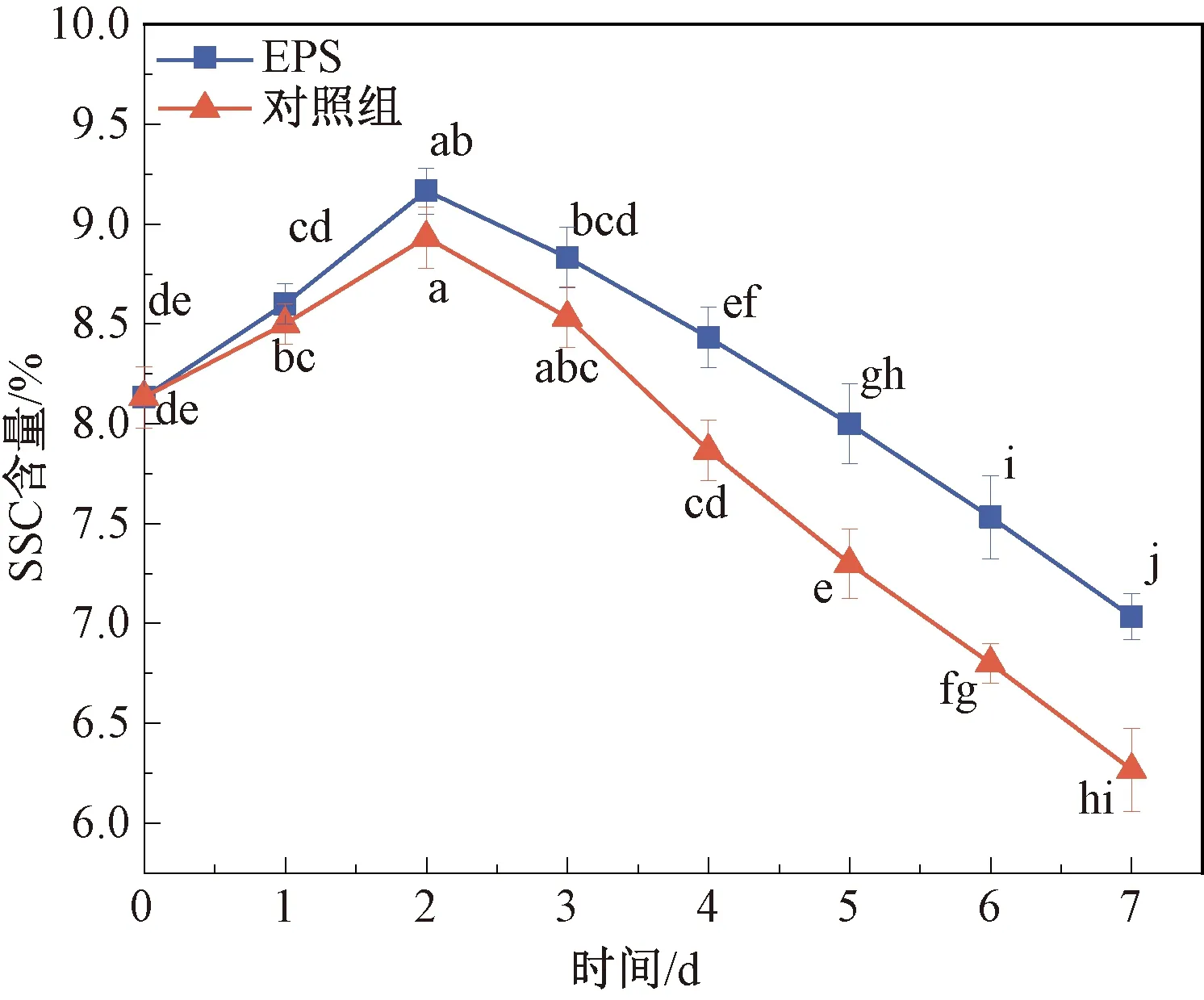
图4 草莓果实中SSC含量变化Fig.4 Change of SSC content in strawberry fruit
2.5 MDA含量分析
MDA是膜脂过氧化最重要的产物之一,它的产生会加剧膜的损伤,测定MDA的含量可了解草莓膜脂过氧化的程度[24]。如图5所示,随着储藏时间的增加,MDA的含量也随之增加,2~7 d,对照组MDA含量均显著高于EPS组,在第7天时,EPS组和对照组的MDA含量分别达到4.07 μmol/L和4.39 μmol/L。可能是EPS-1涂层限制水果组织中的氧气供应,从而减少脂质过氧化,还可作为抗氧化剂,减少草莓组织中的氧化应激[25]。结果表明,EPS-1可有效降低MDA含量,减缓草莓氧化损伤程度。
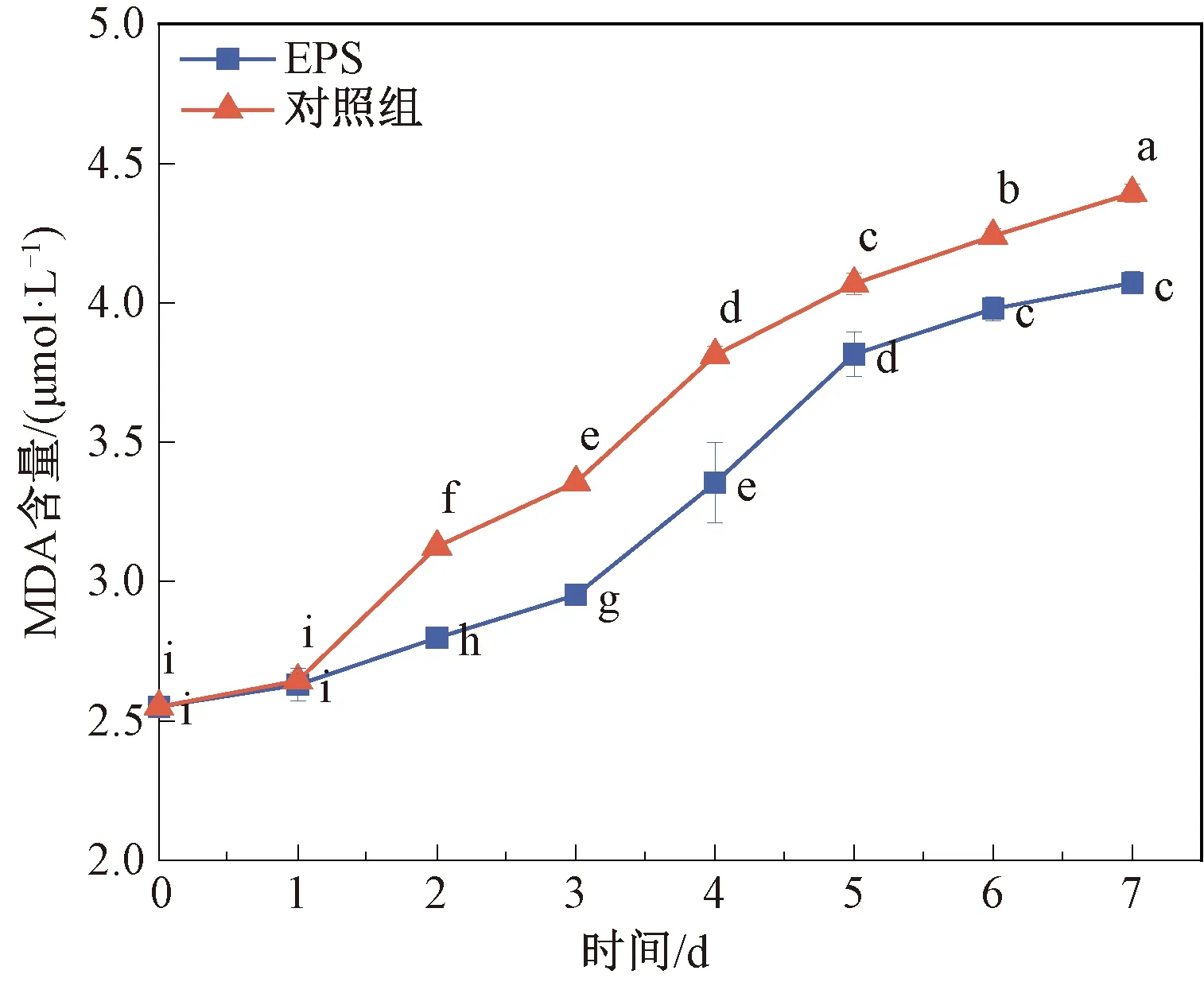
图5 草莓果实中MDA含量变化Fig.5 Change of MDA content in strawberry fruit
2.6 Vc含量分析
抗坏血酸标准曲线回归方程:Y=0.021 3X+0.116(R2=0.997 2)。抗坏血酸在水果体内主要起清除自由基和延缓细胞衰老的作用[26],如图6所示,不同处理后草莓果实中Vc含量先升后降,EPS组在第2天时Vc含量达到最大,为(35.6±0.43) μg/g,对照组在第1天时Vc含量达到最大,为(33.56±0.58) μg/g。第6天后,两组草莓中的Vc含量开始显著下降,在第7天时,EPS组Vc含量下降到(23.63±0.67) μg/g,但仍显著高于对照组(P<0.05),表明EPS-1可以减缓Vc氧化的速率,延长草莓果实的存放时间。
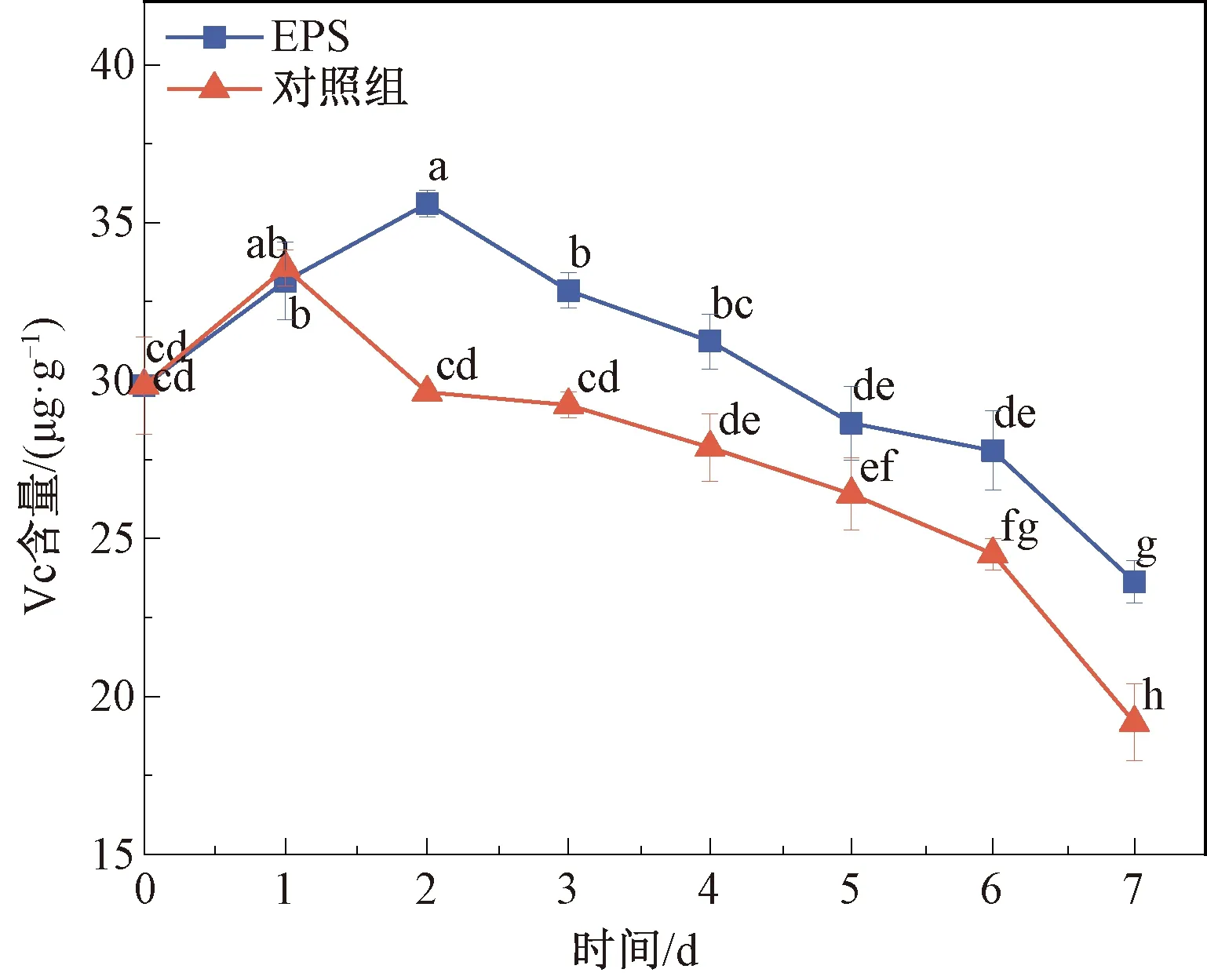
图6 草莓果实中Vc含量变化Fig.6 Variation of Vc content in strawberry fruit
3 结论
本研究从RufibacterhautaeNBS58-1发酵液中分离纯化得到胞外多糖EPS-1,为一种主要含葡萄糖和甘露糖的小分子量杂多糖,能有效清除羟基、ABTS和DPPH自由基,其中对羟基自由基清除效果最好,并具有良好的还原能力。草莓经EPS-1涂膜后,能显著降低果实的MDA含量,延缓可溶性固形物的降解和Vc的氧化,有利于提升采摘后草莓的质量,延长草莓货架期。EPS-1展现出较好的抗氧化活性,后续需进一步对EPS-1的结构进行深度的解析,并探究抗氧化活性与结构的构效关系,以进一步明确其应用潜力。
