基于荧光共振能量转移的荧光适配体传感器检测食品中Cd2+
2023-10-24梁瑞瑞金华丽索志光
梁瑞瑞,白 天,金华丽*,索志光*
1.河南工业大学 粮油食品学院,河南 郑州 450001
2.河南省食品和盐业检验技术研究院,河南 郑州 450008
镉作为毒性最强的重金属之一,通常经过工业排放、冶金、采矿等自然或人为活动排放到环境中,并以化合物的形式如硝酸镉、氯化镉和硫酸镉等存在,水体和土壤是主要污染物[1-2]。因其生物富集性和不可降解性,常在植物和动物如大米、虾、贝类中积累[3-5]。研究表明,镉离子(Cd2+)的生物半衰期较长,可影响人体10~30 a[6]。长期暴露于含镉环境中会导致骨质软化、肾衰竭、肝病、神经系统缺陷等多种疾病[7-8]。国际癌症研究机构(IARC)在1993年已将镉列为第I类人类致癌物[9]。为保证食品安全,我国规定大米和糙米中镉含量不能超过0.2 mg/kg,饮用水中最大允许量为0.005 mg/L[10]。因此,需要开发特异性好、灵敏度高的方法对Cd2+进行检测。
传统的重金属检测方法主要包括原子吸收光谱(AAS)[11]、电感耦合等离子体质谱(ICP-MS)[12]、电感耦合等离子体原子发射光谱(ICP-AES)[13]和高效液相色谱[14]。上述方法虽然具有良好的准确度,但往往需要昂贵的仪器和专业的操作人员,并且无法满足现场和快速检测的要求。因此,建立一种简单、快速、经济、通用的检测方法具有重要意义。适配体(Aptamer,Apt)是通过指数富集的配体系统进化(SELEX)技术体外筛选出的单链核苷酸序列(DNA或RNA),具备易于合成修饰、靶分子广、稳定性好、成本低等优点,因其能与各种靶标分子高亲和力和特异性结合,而被用作捕获探针[15]。适配体可以与荧光基团、金纳米颗粒、电化学纳米复合材料等结合,兼容多种信号模式,如荧光、比色、电化学等,进而发展成多种检测技术实现对各类靶标的检测。Liu等[16]基于金纳米颗粒(AuNPs)和壳聚糖修饰的玻碳电极以及Cd2+-适配体构建了一种简便的电化学检测方法,Cd2+的存在引发Apt构象变化并形成Cd2+-Apt复合物,可吸附更多电化学信号指示剂[Ru(NH3)6]3+,使峰值电流增加,对Cd2+的检测限低至0.049 95 pmol/L,然而试验较为耗时,长达12 h。Tao等[17]制备了AuNPs修饰的二硫化钼纳米复合材料作为酶模拟物,并将其与互补链连接构成信号探针。Cd2+与互补链竞争性地与Apt结合,最后通过TMB的显色反应实现对目标物的检测,操作简单且结果肉眼可见,但是检出限为6.23 nmol/L,灵敏度较低。Pan等[18]巧妙设计了一种无标记荧光生物传感器,Cd2+诱导Apt形成发夹结构,暴露出引发剂序列,从而引发双重链置换扩增反应,可生成大量的G-四链体序列,使染料NMM的荧光强度增强,可在2 h内实现5 pmol/L Cd2+的痕量检测。
以上几种方法相比,荧光生物传感器在具备高灵敏度和稳定性的基础上,还具有易于设计、操作简单、耗时短和成本低的优点。常见的荧光分析技术基于荧光共振能量转移效应(fluorescence resonance energy transfer,FRET)。其中,荧光供体的发射光谱与受体的吸收光谱有部分重叠,且两个基团之间距离为1~10 nm,是此效应发生的关键条件[19]。Liu等[20]制备出猝灭效果较好的金纳米花材料,并利用其与荧光基团FAM之间的FRET作用实现了对0.285 nmol/L Pb2+的检测。基于FRET的荧光传感技术因其灵敏度高、响应速度快、经济等优点已成为现场和实时环境监测和食品安全检测的强大工具。作者利用羧基荧光素(FAM)和黑洞猝灭剂(BHQ1)作为荧光能量供体和荧光能量受体,基于荧光共振能量转移构建了一种步骤简单、响应快速、灵敏度高、稳定性好的适配体传感器。当Cd2+、Apt和cDNA三者同时存在时,Cd2+竞争性地与Apt结合形成Cd2+-Apt复合物,阻止FRET的发生,传感器的荧光信号显著增强。基于以上策略所设计的荧光适配体传感器可用于多种食物样品中Cd2+的检测。
1 材料与方法
1.1 材料
Cd2+的核酸适配体(Apt-FAM):5’-GGA CTG TTG TGG TAT TAT TTT TGG TTG TG-FAM-3’,源自之前筛选出的最优适配体Cd-4[21]。互补链1(cDNA1-BHQ1)(5’-BHQ1-CAC TAC CTA AAA TAT TAC CTC A-3’)、互补链2(cDNA2-BHQ1)(5’-BHQ1-CAC AAC CTA AAA TAT TAC CAC A-3’)、互补链3(cDNA3-BHQ1)(5’-BHQ1-CAC AAC CAA AAA TAA TAC CAC A-3’):均由上海生工生物工程有限公司合成。自来水:校区实验室;绿茶饮料、麦片:郑州永辉超市。大米粉(编号CFAPA-QCB56A-1)和茶叶样品(编号CFAPA-QC485A):河南省产品质量监督检验研究院。
1.2 试剂与设备
20 mmol/L Tris-HCl缓冲溶液:20 mmol/L Tris-HCl、5 mmol/L MgCl2、140 mmol/L NaCl,pH 7.4;Cd(NO3)2·4H2O:上海金山亭新化工试剂厂;G9800A荧光分光光度计:安捷伦(马来西亚)。
1.3 试验方法
1.3.1 传感器的制备及检测Cd2+
将10 μL Apt-FAM(1 μmol/L)加入200 μL离心管中,随后依次加入10 μL cDNA-BHQ1(1 μmol/L)和10 μL终浓度100 nmol/L的Cd2+溶液,充分涡旋混匀并置于37 ℃振荡孵育1.5 h,使得Cd2+竞争性与Apt-FAM结合,而多余的Apt-FAM通过碱基互补配对与cDNA-BHQ1形成双链结构。向离心管中补充Tris-HCl缓冲溶液至200 μL,室温下进行荧光扫描。设置激发波长490 nm,发射波长510~600 nm,在520 nm处记录荧光强度,传感器的响应值为荧光强度差值ΔF=F-F0,其中F和F0分别为含Cd2+和无Cd2+时传感体系的荧光强度。
1.3.2 实际样品处理
自来水和绿茶饮料不进行预处理。麦片充分研磨成粉后,采用微波消解法进行预处理。准确称取0.500 0 g麦片,与8 mL硝酸和2 mL过氧化氢一同加入微波消化炉的消化罐中。设置反应温度180 ℃,压力2.8×106Pa,加热时间12 min,保温时间10 min。消化过程结束后,将含有消化溶液的消化罐置于160 ℃电加热板上加热,排酸,然后在室温下冷却,并用超纯水定容至10 mL。最后,将Cd2+标准溶液与自来水、绿茶饮料及麦片样品充分混合,使传感体系中Cd2+的终浓度均为10、100、1 000 nmol/L,然后进行加标回收试验。
1.4 数据处理与分析
使用Origin 2021处理和分析数据。
2 结果与分析
2.1 基于荧光共振能量转移的荧光适配体传感器检测食品中Cd2+的原理
图1为荧光适配体传感器检测Cd2+的设计原理。该传感策略是基于适配体与Cd2+的特异性结合,以及Apt-FAM与cDNA-BHQ1之间的荧光共振能量转移作用。首先,分别在适配体的3’端修饰FAM,其互补链的5’端标记BHQ1。当Cd2+不存在时,cDNA与Apt通过碱基互补配对形成双链DNA,此时FAM与BHQ1之间的距离小于10 nm[22],FRET效率明显提高,FAM荧光被猝灭,传感器的荧光强度显著降低(图1(a))。其次,将Cd2+、cDNA和Apt三者同时孵育,Cd2+会优先与Apt特异性结合,形成具有特殊结构的Cd2+-Apt复合物,主要是因为Cd2+与鸟嘌呤(G)和胸腺嘧啶(T)碱基上的O和N形成了配位键[23]。Cd2+诱导的特殊结构阻止了cDNA与Apt的结合,保护FAM的荧光不被猝灭,传感器的荧光信号增强(图1(b))。最后,通过FAM荧光强度的变化可以实现对Cd2+的定量分析。
2.2 荧光适配体传感器检测Cd2+的可行性分析
利用不同条件下的荧光光谱验证该传感器检测Cd2+的可行性。如图2所示,初始状态下,单独Apt-FAM在溶液中的荧光强度为513(曲线a)。继续向其中加入Cd2+标准溶液,传感体系的荧光强度基本保持不变(曲线b),表明Cd2+所诱导的Apt的构象变化并不会影响FAM的荧光强度。当仅含Apt-FAM的传感体系中加入cDNA-BHQ1后,荧光强度降低至128(曲线d),说明Apt与cDNA所形成的双链结构使FAM与BHQ1距离缩短,诱发荧光共振能量转移效应,能量供体FAM的荧光强度极大地被猝灭。而当传感体系中同时引入100 nmol/L Cd2+和cDNA-BHQ1后,荧光强度为235(曲线c),明显较强,说明Apt与Cd2+的高亲和力结合诱导荧光探针形成Apt-Cd2+复合物,导致部分cDNA-BHQ1处于游离状态,保护了FAM的荧光强度,充分表明该传感器的荧光强度变化是由Cd2+决定的。
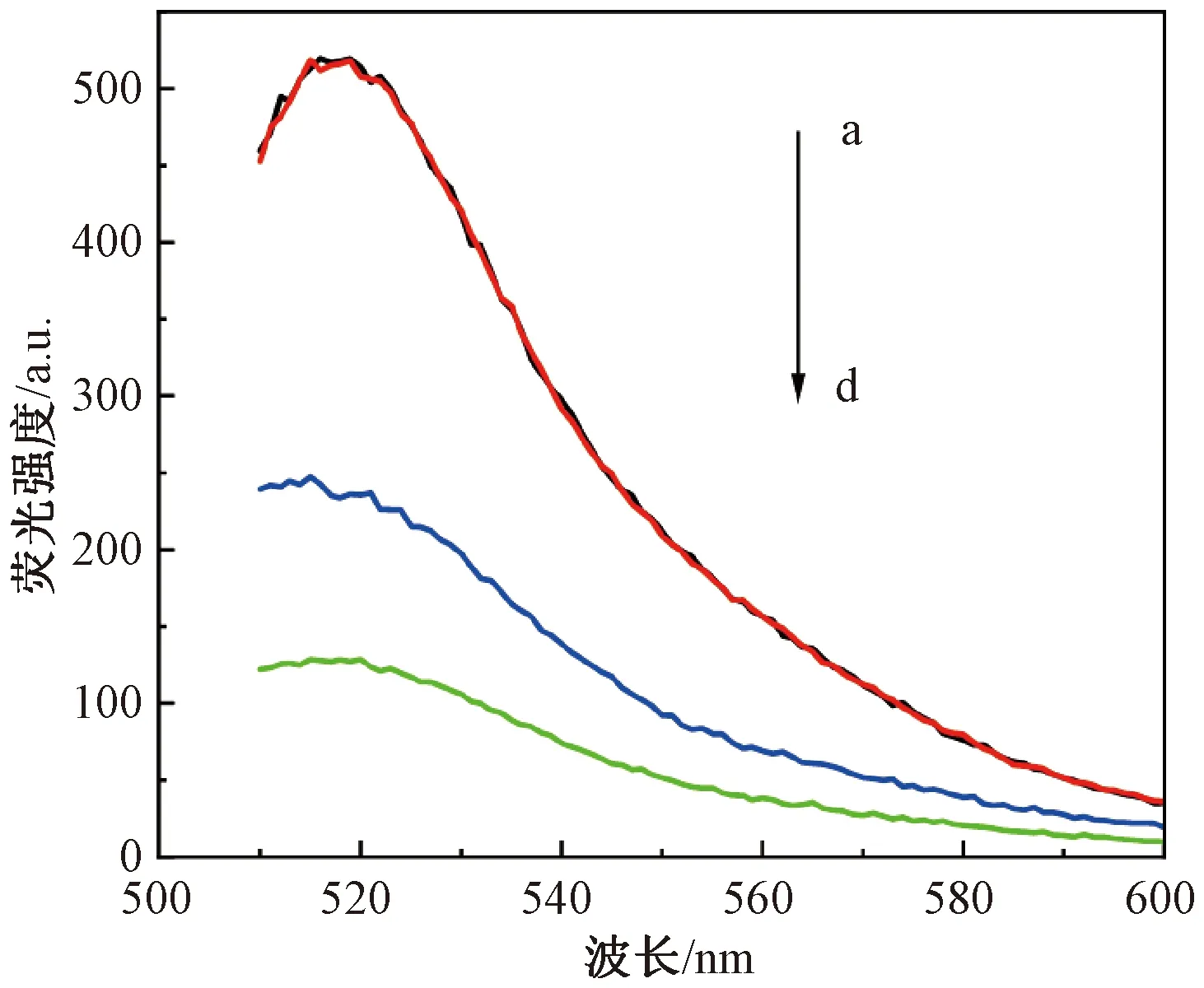
注:曲线a—d分别为Apt-FAM、Apt-FAM+100 nmol/L Cd2+、Apt-FAM+cDNA-BHQ1+100 nmol/L Cd2+、Apt-FAM+cDNA-BHQ1,a与b重合。图2 传感体系在不同条件下的荧光光谱Fig.2 Fluorescent spectra of the sensing system under different conditions
2.3 传感器的试验条件优化
为了获得最佳的Cd2+检测结果,优化了结合方式、互补链序列、cDNA与Apt的浓度比、孵育时间和温度。前期试验发现Apt、cDNA和Cd2+按照不同的方式进行孵育时得到不同的检测结果。因此,首先探讨了不同结合方式对目标物检测的影响。图3(a)显示在3种不同结合方式下,加入Cd2+前后传感器的荧光强度变化情况。由图3(b)可知,Apt、cDNA和Cd2+同时进行孵育前后,ΔF最大。然而,当Apt先与cDNA孵育,再引入靶标Cd2+后,ΔF最小,是因为形成的双链结构较为牢固,不会被Cd2+轻易破坏;当Apt先与Cd2+进行孵育,后加入cDNA,此时ΔF明显比Apt先与cDNA孵育时的ΔF要大,而且比三者同时进行孵育时的ΔF要小,主要是因为相比于cDNA,Cd2+会优先与Apt特异性结合,已知Cd-4适配体对Cd2+的解离常数为34.5 nmol/L,对Cd2+具有较高的亲和力[21]。因此,选择Apt、cDNA和Cd2+同时进行孵育的方式进行以下试验。
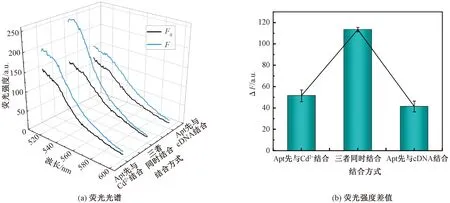
图3 结合方式的优化Fig.3 Optimization of the binding mode
其次对互补链cDNA进行优化,最大限度地提高传感器的分析性能。设计了3种不同的cDNA,其中cDNA1与Apt互补18个碱基,间隔4个A-T碱基对;cDNA2与Apt互补20个碱基,间隔2个A-T碱基对;cDNA3与Apt连续互补22个碱基。同时,在线预测了Apt和cDNA1、cDNA2、cDNA3在37 ℃形成的双链DNA的二级结构(http://www.nupack.org/)(图4)。从图5(a)可以看出,使用cDNA2制备的传感器具有较低的背景荧光信号F0,引入Cd2+后,该传感器的荧光信号也有较大的恢复。从图5(b)可以看出,使用cDNA2制备的传感器的ΔF最大。因此,选择cDNA2作为后续试验的互补链,并进一步研究了cDNA与Apt的浓度比对传感器的影响。如图5(c)所示,在保持Apt浓度不变的情况下,逐渐增加cDNA的浓度,荧光信号F0随之降低。当引入Cd2+时,荧光信号F均有所增强。从图5(d)可以看出,随着cDNA与Apt的浓度比逐渐增加,ΔF逐渐增大,当浓度比为1∶1时,ΔF达到最大值,之后,过量的cDNA使ΔF有所降低,传感器性能下降,主要因为均相体系中游离cDNA上的BHQ1会影响FAM的荧光强度。因此,选择cDNA和Apt的浓度比为1∶1进行以下试验。

图4 Apt和3种不同互补链cDNA1、cDNA2、cDNA3形成的二级结构Fig.4 Secondary structures formed by Apt and three different complementary strands,cDNA1、cDNA2、cDNA3

注:(a)和(b)分别为不同互补链条件下的荧光光谱及荧光强度差值的变化;(c)和(d)分别为不同浓度比下的荧光光谱及荧光强度差值的变化。图5 互补链和cDNA与Apt浓度比的优化Fig.5 Optimization of the complementary chain and the concentration ratio of cDNA to Apt
最后,为了节省时间和获得最佳检测结果,对孵育时间和温度进行优化。如图6(b)所示,当孵育60 min时,ΔF达到最大值,进一步增加孵育时间,ΔF没有明显增大。因此,将60 min选为最佳时间进行孵育。进一步考察了该传感器在25、37、45 ℃下对Cd2+的检测情况,从图6(d)可以看出,37 ℃时传感器的ΔF较大。当温度升至45 ℃时,响应值略有下降,这可能与高温导致复杂二级结构的解缠有关[24]。因此,选择37 ℃为最佳孵育温度。

注:(a)和(b)分别为不同孵育时间下的荧光光谱及荧光强度差值的变化;(c)和(d)分别为不同孵育温度下的荧光光谱及荧光强度差值的变化。图6 孵育时间和孵育温度的优化Fig.6 Optimization of the incubating time and incubating temperature
2.4 基于荧光共振能量转移的荧光适配体传感器检测食品中的Cd2+
在最佳条件下,研究了Cd2+浓度与FAM荧光强度之间的关系。由图7(a)可知,随着Cd2+浓度的增加,传感器的荧光信号逐渐增加。由图7(b)可知,在5~5 000 nmol/L范围内,FAM的荧光强度差值ΔF与lg(CCd2+)的线性方程为ΔF=54.6 lgC+484.4 (R2=0.992),检出限(LOD)为0.94 nmol/L,远低于世界卫生组织和美国环境保护署设定的最大限制浓度27 nmol/L和44.5 nmol/L[25-26]。将该荧光适配体传感器的检测结果与之前检测Cd2+的方法进行比较,如表1所示,与其他适配体传感器相比,该试验步骤简单、检测时间较短、检测限较低,具有灵敏、方便、快速的优点。
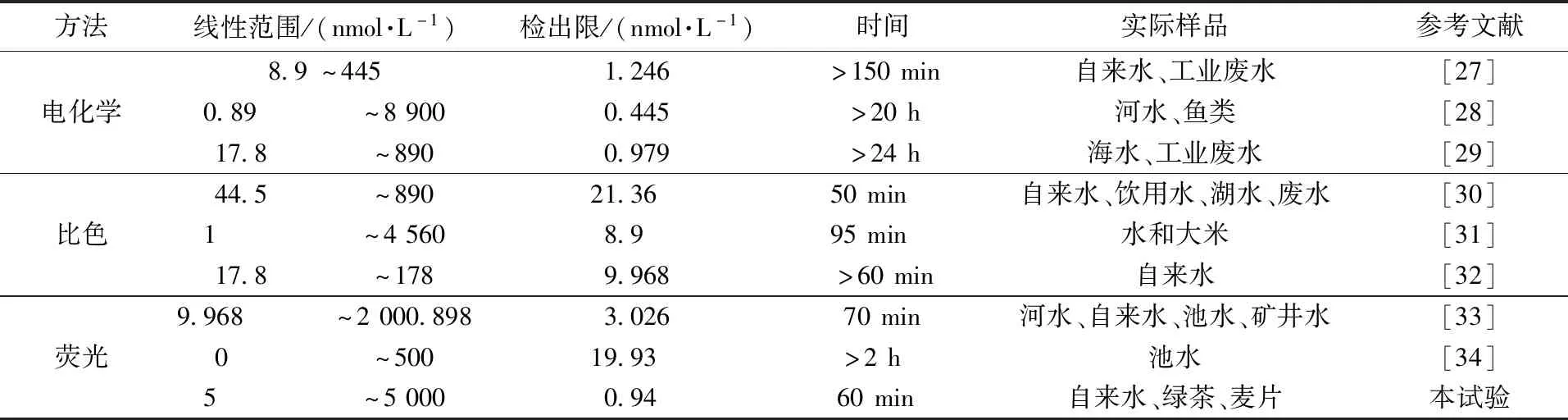
表1 传感器与其他检测Cd2+的方法比较Table 1 Comparison of the sensor with other methods for detection of Cd2+
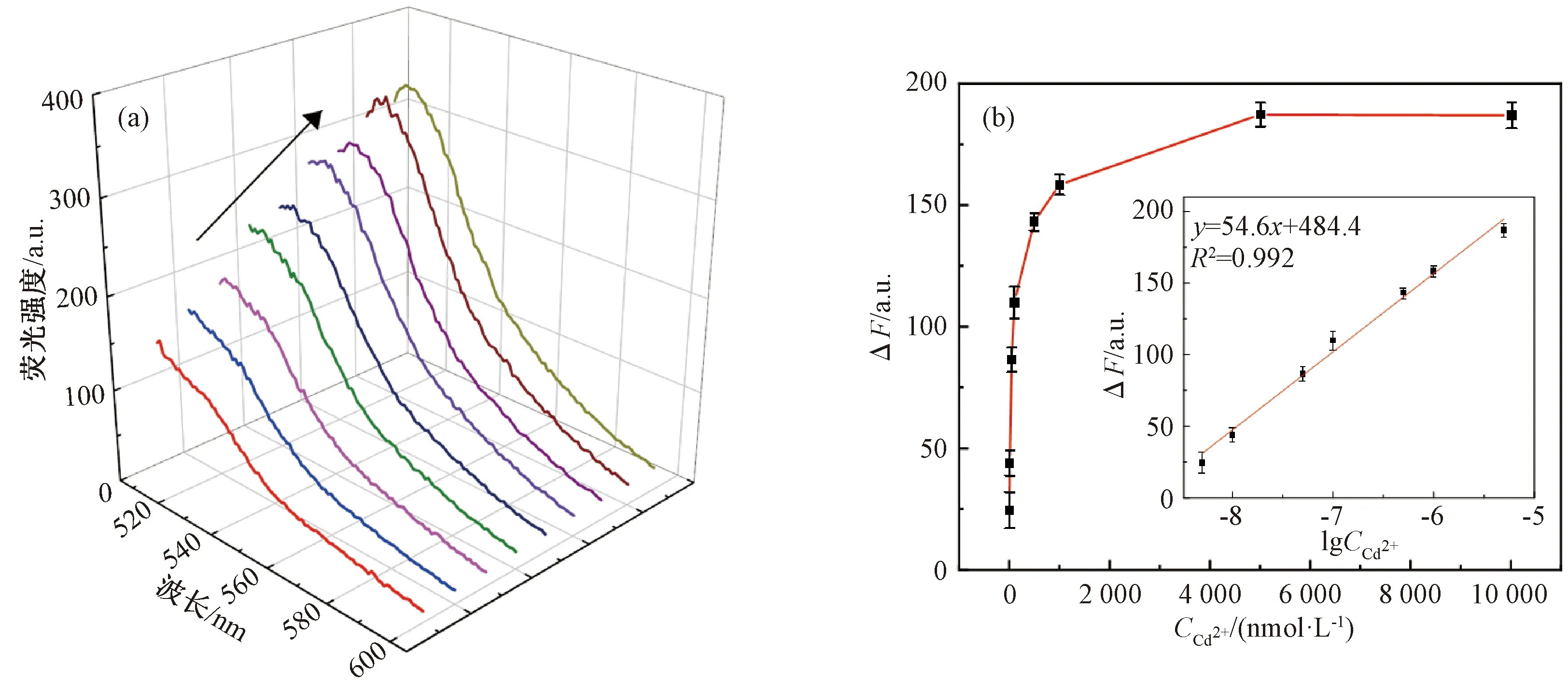
注:(a)不同Cd2+浓度(0、5、10、50、100、500、1 000、5 000、10 000 nmol/L)下传感器的荧光光谱;(b)传感器与不同浓度Cd2+(5、10、50、100、500、1 000、5 000、10 000 nmol/L)孵育后荧光强度差值的变化,插图:FAM的ΔF与lg(CCd2+)的线性曲线(Cd2+浓度5~5 000 nmol/L)。图7 Cd2+的标准曲线及对应的荧光光谱Fig.7 Standard curves and corresponding fluorescence spectra of Cd2+
2.5 传感器的特异性研究
在最佳的试验条件下,用该传感器分别测定了10倍于Cd2+浓度的不同干扰离子(Mn2+、Zn2+、Cu2+、Mg2+、K+、Ba2+、Ni2+、Co2+、Li+、Pb2+)、所有干扰离子的混合样、Cd2+以及Cd2+与所有干扰离子的混合样。由图8可知,尽管干扰离子的浓度是Cd2+浓度的10倍,传感器的响应值ΔF仍然有极显著差异(P<0.001)。单独干扰离子的存在以及各种干扰离子的同时存在均不会使传感器的响应值ΔF增大,只有当Cd2+存在于传感体系中时,FAM的荧光强度才会发生显著增强,表明该传感器对Cd2+具有良好的特异性。
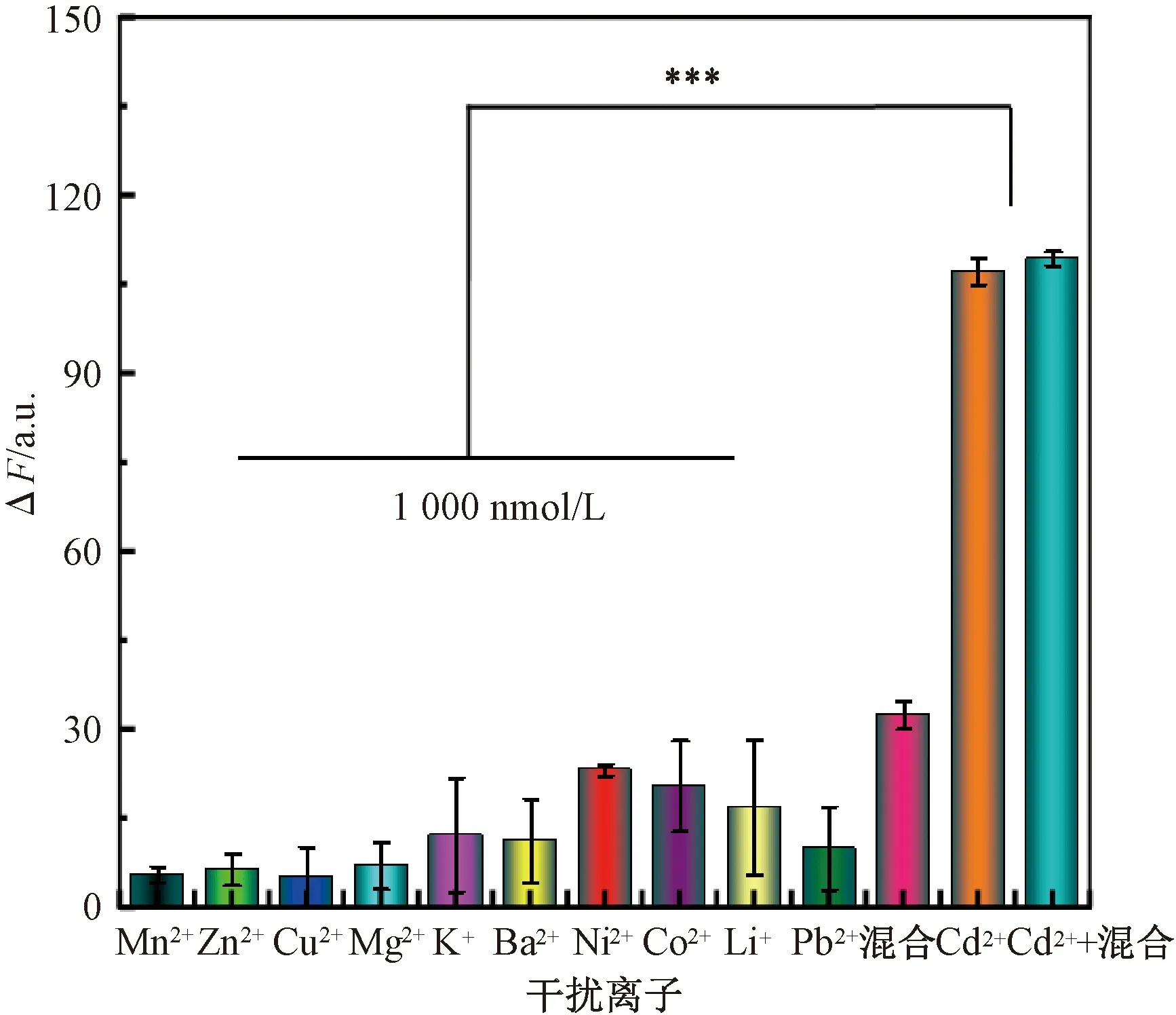
注:***表示差异极显著(P<0.001);CCd2+=100 nmol/L。图8 传感器对Cd2+的特异性Fig.8 Specificity of the sensors for Cd2+
2.6 传感器的重复性和再现性研究
在相同的试验条件下,使用同一个传感器对不同浓度的Cd2+(终浓度为10、100、1 000 nmol/L) 分别测定3次,以测试该传感器的批内差异;同时,分别使用3个相同的传感器对不同浓度的Cd2+(终浓度为10、100、1 000 nmol/L)进行检测,以测试该传感器的批间差异。结果表明检测批内和批间无显著性差异(P>0.05),说明该荧光适配体传感器具备可接受的重复性和再现性。
2.7 实际样品检测
为了评估该传感器的实用性,对自来水、绿茶饮料及麦片样品进行加标检测,结果如表2所示,Cd2+的回收率为90.3 %~110.7 %,RSD均低于10 %。另外,对质控样品大米粉和茶叶中的Cd2+进行检测,结果见表3,使用单一样本T检验法对数据进行分析,大米粉样品的t为0.676,茶叶样品的t为0.197,均小于4.303(0.95,n=3),说明检测值与认证值之间没有显著性差异。以上结果表明,该传感器在实际样品检测方面性能优异。
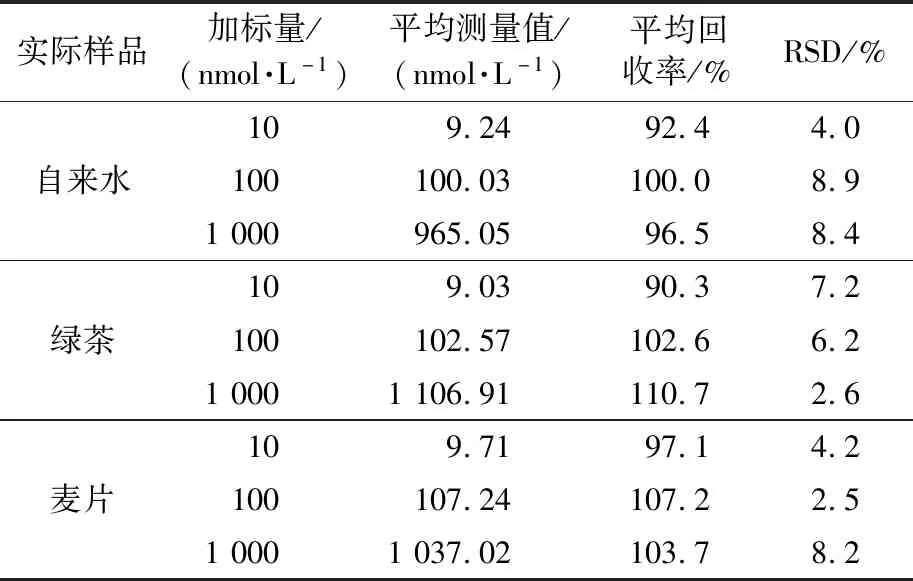
表2 实际样品的检测结果Table 2 Determination results of real samples

表3 质控样的检测结果Table 3 Determination results of quality control samples
3 结论
基于FRET制备了一种灵敏、快速、稳定的荧光适配体传感器,并成功对食品样品中的Cd2+进行了检测。将FAM与适配体结合作为能量供体和靶标捕获探针,cDNA-BHQ1作为能量受体。当探针与样品中的靶标Cd2+特异性结合时,传感体系中荧光信号增强。该传感器对5~5 000 nmol/L的Cd2+具有良好的线性响应,具有较低的检测限,LOD为0.94 nmol/L。传感器的制备过程简单,在60 min内即可完成检测,其他金属离子的存在也不会对传感器的检测工作造成干扰,在自来水、绿茶、麦片、大米粉等样品中,可以成功检测Cd2+。因此,所构建的荧光适配体传感器可用于实时、快速、现场检测食品中的镉。
