加米霉素纳米乳化制剂的制备
2023-10-24谢建瑛苗耀天亢永久赵咏中
谢建瑛,苗耀天,亢永久,赵咏中*
(1.甘肃武威国家农业科技园区管委会,甘肃武威 733000;2.武威市畜牧兽医总站,甘肃武威 733000;3.武威喜农生物科技有限责任公司,甘肃武威 733000)
纳米乳(nanoemulsion)是一种新型药物载体,是由表面活性剂、助表面活性剂、油相及水相在适当比例下形成的透明分散体系[1],乳滴粒径分布在1~100 nm之间,和纳米粒、纳米囊、脂质体等纳米剂型相比,纳米乳的整体生产工艺要求不高,利于在车间得到转化,故非常适用于对成本有较高要求的兽药制剂的生产。在包封率方面,一个稳定的水包油型纳米乳剂包封率能接近100%,显著高于纳米粒、纳米囊、纳米脂质体等,包被后的药物异味显著降低,同时,对于水溶性差的药物来讲,包被后的药物在水中溶解度显著提升,且能无限稀释而不破乳,是解决药物饮水使用问题的常用技术之一。在兽医临床方面,目前国内已经有替米考星纳米乳[2]、复合维生素纳米乳[3]、中药植物精油纳米乳等产品上市,是养殖领域应用最好的纳米制剂之一。
加米霉素(gamithromycin)是一种新型大环内酯类动物专用抗生素,由于使用后在肺部的药物浓度显著高于其他部位组织,故常用于动物呼吸系统感染类疾病的防治[4-5]。体外药敏试验证实,其抗菌作用显著优于同属大环内酯类的临床常用药替米考星[6]。由于该药水溶性较差,目前市售只有注射剂型,而注射用药不但对动物应激较大,对养殖场员工来讲还费时费力。本试验结合纳米乳化工艺,将加米霉素制备成纳米乳剂,并检测了其理化性质,为加米霉素新剂型的工业转化及临床应用提供了参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂 加米霉素(批号:202208002,按无水物计算,含量 98.9%),齐鲁晟华制药有限公司产品;吐温-80、聚氧乙烯40氢化蓖麻油(polyoxyl 40 hydrogenated castor oil,简称RH-40)、蔗糖脂肪酸酯,天津市恒星化学试剂制造公司产品;肉豆蔻酸异丙酯(isopropyl myristate,简称IPM),天津市天力化学试剂有限公司产品;油酸乙酯,江西阿尔法高科药业有限公司产品。
1.1.2 主要仪器 Nicomp388/Zeta PALS激光粒度测定仪(Zetasizer Nano ZS型),英国Malvern Instrumen公司产品;电子天平(EB-280型),日本Shimadzu公司产品;透射电镜(JME-1230型),日本JEOL公司产品;高速离心机(TGL-16B型),湖南星科科学仪器有限公司产品。
1.2 方法
1.2.1 加米霉素纳米乳组方的筛选
1.2.1.1 油相、表面活性剂、助表面活性剂及助溶剂的筛选 由于加米霉素亲水性差,为了提高其溶解度,可将加米霉素作为油相的一部分。根据不同油酯对加米霉素的溶解度数据,筛选出溶解度大和稳定性强的油脂作为油相,表面活性剂和助表面活性剂通过对所选油相的乳化性能进行验证评估后,最终确定种类和剂量。
油相从IPM、油酸乙酯、大豆油中比较选择,表面活性剂从吐温-80、RH-40和蔗糖脂肪酸酯中选择。考虑到加米霉素药物本身的性质,选用无水乙醇作为助表面活性剂,主要是由于无水乙醇属于短链醇,一方面能很好地降低界面张力,利于纳米乳的形成,另一方面其对加米霉素也具有一定增溶作用,适合加米霉素纳米乳的制备。
1.2.1.2 伪三元相图的绘制 伪三元相图可以用于确定纳米乳的形成区域和配方用量。室温下,将确定的表面活性剂和油相分别按质量百分比9∶1、8.5∶1.5、8∶2、7.5∶2.5、7∶3、6.5∶3.5、6∶4的比例混匀,然后逐滴加入纯化水,中间体系先由稀转粘稠,再由粘稠转稀,最终形成澄清透明、各相均一的纳米乳体系。记录当体系由浑浊变澄清和由澄清变浑浊时的临界点水量,计算体系中各成分的质量百分比。分别以表面活性剂(S)、油相(O)、水相(W)作为相图的3个顶点绘制伪三元相图[7],确定纳米乳的最佳组方。
1.2.1.3 加米霉素纳米乳配方的确定及制备 根据以上实验结果筛选最佳配方并制备加米霉素纳米乳。
1.2.2 加米霉素纳米乳的鉴别及结构类型的判断 采用离心法鉴别纳米乳的稳定性[8],即将制备好的加米霉素纳米乳于4 000 r/min的转速下离心30 min,观察乳液是否有分层、析出、浑浊等情况发生。同时在制备的样品中分别滴加水溶性的亚甲基蓝和油溶性的苏丹红Ⅲ,由于亚甲蓝是一种水溶性染料,若为水包油型纳米乳,则外相为水,亚甲蓝易扩散,导致整个体系呈蓝色,苏丹红Ⅲ则不扩散。苏丹红Ⅲ为脂溶性染料,若体系为油包水型,则外相为油,导致整个体系呈红色,亚甲蓝溶液则不扩散。通过扩散结果来判定纳米乳的类型。
1.2.3 加米霉素纳米乳的形态观察 将加米霉素纳米乳用蒸馏水稀释5倍后用2%的磷钨酸负染,通过透射电镜观察纳米乳的形态[9]。
1.2.4 加米霉素纳米乳的粒径分析 将加米霉素纳米乳稀释10倍后,用Zetasizer Nano ZS分析仪测定其平均粒径(Z-average)和多分散系数(PDI) 。
1.2.5 加米霉素纳米乳的稳定性考察
1.2.5.1 留样观察 将加米霉素纳米乳分别于-4℃、室温和40℃条件下观察1 d、7 d、15 d、30 d、60 d和180 d,并置于4 000 r/min的离心机中离心5 min后继续观察是否性状发生改变。
1.2.5.2 Zeta电位测定 将加米霉素纳米乳稀释8倍后,用马尔文电位分析仪检测其Zeta电位大小,以评估其稳定性。
1.2.6 动物安全性评价 随机选取体重20 g±0.5 g的昆明种小鼠50只,随机将其分为A、B、C、D、E五组,每组10只,公母各半,各组小鼠饲养于同一环境中,并由同一饲养员进行喂养。其中A、B、C组为本研究加米霉素低、中、高剂量组,将本研究制备的样品以加米霉素计分别按照3 mg/kg、6 mg/kg、12 mg/kg体重剂量肌肉注射,即A、B、C组小鼠每只分别注射0.002 mL、0.004 mL和0.008 mL(为了确保用量准确和便于操作,可将样品稀释50倍后,每只肌注0.1 mL、0.2 mL和0.4 mL),D组和E组分别为现有药物对照组和生理盐水组,D组小鼠每只按照6 mg/kg体重肌注现有市售加米霉素注射液,E组小鼠每只肌注0.4 mL无菌生理盐水。各组小鼠每日用药1次,连续注射1周。期间观察各组小鼠的临床表现及死亡情况。试验结束后将各组小鼠剖检,观察肺、肝脏、脾脏、肾脏等病变状况,并做好记录。
2 结果与分析
2.1 加米霉素纳米乳配方的筛选
2.1.1 油相的确定 常温条件下,加米霉素原料在IPM、油酸乙酯和大豆油中的溶解度分别为32.5%、21.3%和16.9%,而且溶解后不会随环境温度的变化而出现反复析出和溶解现象,表现出了很好地稳定性,考虑到药物载药量和最终制剂的使用成本,最终选择IPM作为油相。
2.1.2 表面活性剂的确定 从药物的稳定性和载药量的角度进行试验,蔗糖脂肪酸酯较其他两种表面活性剂对IPM的乳化效果更优,且制备过程中出现的“粘稠态”不明显,对搅拌速度和搅拌方式无限制,更利于生产转化,故选择蔗糖脂肪酸酯作为表面活性剂。
2.1.3 表面活性剂与助表面活性剂比例(Km)的确定 本试验分别将Km值按照7∶1、8∶1、9∶1的比例进行试验,通过伪三元相图(图1)阴影区的面积大小确定最佳比例,由图可知Km值为8∶1时,加米霉素纳米乳所形成区域面积最大,体系也最稳定。

图中阴影部分为可形成的纳米乳区域The shaded area is nanoemulsion region图1 Km值对加米霉素纳米乳形成的影响Fig.1 Effects of Km on formation of Gamithromycin nanoemulsion
2.1.4 加米霉素纳米乳配方的确定 根据以上筛选结果,确定纳米乳中各成分的百分比(质量分数)为:蔗糖脂肪酸酯32.0%,加米霉素3.0%,IPM8.0%,无水乙醇4.0%,水53.0%。
2.2 加米霉素纳米乳结构类型的鉴定
将制备的加米霉素纳米乳离心后,体系仍澄清透明,无分层、析出和浑浊现象。染色试验中亚甲基蓝的扩散速度明显快,最终将整个体系染蓝,而苏丹红Ⅲ则持续漂浮在液面,无扩散现象,证明其为水包油型(O/W)纳米乳。
2.3 加米霉素纳米乳的形态观察
透射电镜观察结果显示,加米霉素纳米乳呈规则的球形,分布均匀,无黏连(见图2)。

图2 加米霉素纳米乳透射电镜观察(×50 000)Fig.2 Transmission electron observation of Gamithromycin nanoemulsion(×50 000)
2.4 加米霉素纳米乳的粒径分析
Zetasizer Nano ZS 分析仪测定结果(图3)表明,在25℃常温环境下,加米霉素纳米乳粒径均小于100 nm,符合纳米乳特征,同时进一步测定其平均粒径为13.7 nm,多分散系数(PDI) 为0.283。
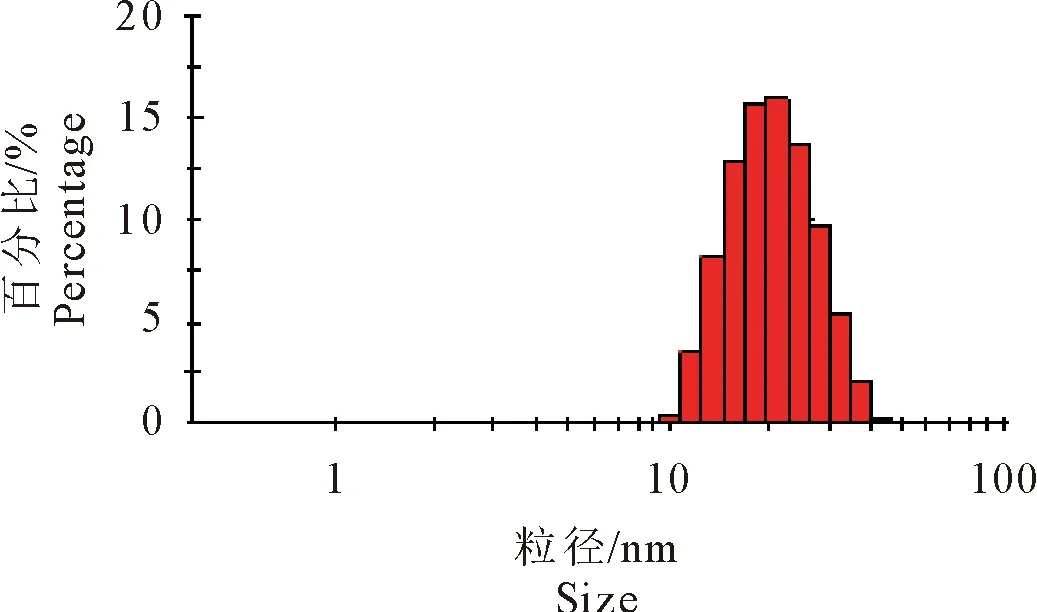
图3 加米霉素纳米乳的粒径分布Fig.3 Size distribution of Gamithromycin nanoemulsion
2.5 加米霉素纳米乳的稳定性
2.5.1 留样观察 试验证实:将加米霉素纳米乳于不同温度下连续放置180 d,期间溶液持续保持澄清透明、均一,离心后观察发现也无析出、分层及浑浊等破乳现象,证明该纳米乳稳定性良好。
2.5.2 Zeta电位考察 将加米霉素纳米乳稀释10倍后,用马尔文电位分析仪检测其Zeta电位,结果如图4,其平均电位为+3.34。在此电位下,加米霉素纳米乳具有较好的稳定性。

图4 加米霉素纳米乳的Zeta电位分布Fig.4 Zeta potential distribution of Gamithromycin nanoemulsion
2.6 安全性评价结果
试验期间的一周内,A、B、C、D、E 5组小鼠均未出现死亡,采食、饮水和活动行为表现无差异。
将各组小鼠剖检后,分别将试验组A、B、C、D和对照组E进行比较,未发现肺、肝脏、脾脏和肾脏器官各组之间有明显差异,外观正常,未有明显的可视病变,表明本研究制备的加米霉素纳米乳和现有市售产品加米霉素注射液使用都安全。A、B、C组小鼠之间各器官也未有明显病变差异,表明本研究制备的加米霉素纳米乳安全性良好。
3 讨论
加米霉素纳米乳的制备和工艺设计需重点考量载药量、稳定性和工艺转化可行性三个方面。载药量越高,临床使用时所需给药的剂量就越小,辅料的使用量也会更小,终制剂的性价比就更高。对于纳米乳制剂来讲,载药量和所选油相种类有关,在满足药物稳定的前提下,油相对药物的溶解度越高,载药量相应就越大。本研究针对加米霉素的药物特点最终选择了IPM作为油相,从而使载药量达到了3%。油相确定后,为了使制剂产品稳定性达到最佳,需依据油相性质选定与其被乳化所需的亲水亲油平衡值(HLB)相近的乳化剂,经过反复考察,吐温-80、聚氧乙烯40氢化蓖麻油(RH-40)和蔗糖脂肪酸酯符合要求。由于前两者在生产过程中,纳米乳达到中间“相转化”状态时的“黏稠态”非常明显,导致工艺转化时搅拌叶浆表面以及配液罐内壁粘附大量药物而无法搅匀。这种情况下若动力电机功率过小或叶浆面过大,该“黏稠态”会直接迫使搅拌停止,电机也容易被烧毁,故表面活性剂的选择对于工艺转化至关重要。经过多次试验评估,本研究最终选择“相转化”时“粘稠态”不明显的蔗糖脂肪酸酯作为表面活性剂,既能确保工艺在普通GMP车间就能生产转化,还能最大程度避免生产事故的发生。
近年来的试验分析还发现,加米霉素对养殖生产中常见的多杀性巴氏杆菌、链球菌、金黄色葡萄球菌、副猪嗜血杆菌、胸膜肺炎放线杆菌以及支气管败血波氏杆菌等均有很强的体外抗菌活性,证明其是一种广谱、高效、安全的抗菌药[10]。但目前由于原料药合成技术的限制,使得终端制剂售价较高,长期来看,随着合成方法多样化以及制备工艺的改进,未来终端制剂的售价必将会明显下降[11],用药成本降低后,加米霉素相关制剂的研究、应用和推广速度也会越来越快。还需要说明的是,大环内酯类药物是动物呼吸道疾病治疗的首选品类,但由于该类药物的长期使用,目前养殖临床已经发现有较高的耐药率。为了维持该类药物的敏感性,以加米霉素、泰地罗新、泰拉霉素等为代表的新一代大环内酯药物应市场而生,由于上市时间短,耐药率极低,市场潜力显著高于其他同类药物。对于加米霉素来讲,目前已经有注射液剂型在市场流通,主要用于牛呼吸道感染的预防与治疗。为了使其得到更广泛地应用,其他靶动物的相关试验正处于研究中[12-13],由于变更靶动物需要一定研发周期,尤其是药学试验、动物临床试验和药残标准建立等需要进行多次深入研究和考察,故目前市售产品临床仅可用于牛,期待不久的将来也能用于猪、羊、家禽等养殖动物领域。
通过纳米乳化技术将加米霉素改良后,首先,整个组方结构发生了改变,体系中有53%的辅料为水,和有机溶剂相比局部刺激更小,注射使用产生的应激也会更低。其次,对于本纳米乳剂,加米霉素药物是溶解在脂溶性溶剂IPM中的,若口服使用最终会通过肠淋巴管吸收,能避开肝脏的“首关效应”,有效降低了被肝脏酶解的药物量,有助于药物生物利用度的提升[14]。再次,目前加米霉素只有注射剂型上市,为了方便临床给药,未来定会有很多企业参与饮水剂型的研发,将其制备成口服溶液剂,而由于该药不溶于水的性质使得其制备成饮水剂型时会遇到技术瓶颈。本文通过技术改良将其制备成纳米乳剂后,为社会和企业的研发提供了技术参考。最后,通常纳米剂型使用后具有靶向性的特点,本研究制备的加米霉素纳米乳使用后的靶向性还未知,如果药物在肺、呼吸道等处有高于普通制剂的药物浓度,则其防控疾病的效果必然会更强。因此,下一步会将加米霉素纳米乳的药物吸收、分布以及代谢规律的研究作为重点,从而为畜禽呼吸道病的防控带来贡献。
