毛竹PheFT12a基因过表达对拟南芥开花及芽发育的影响
2023-10-23张雨佳邹龙海周敏舒郭小勤
张雨佳 刘 丽 邹龙海 周敏舒 畅 欣 郭小勤
(浙江农林大学,省部共建亚热带森林培育国家重点实验室/竹子研究院,浙江 杭州 311300)
毛竹(Phyllostachysedulis)是我国南方最重要的林业资源之一,在经济和生态环境等方面发挥着重要作用。毛竹有其独特的生物学特性,一旦开花,就会大面积死亡;且主要靠无性繁殖繁育,即笋芽发育形成笋,再长成竹,但自然界中毛竹笋芽发育率极低,仅为5%~8%[1]。
FLOWERING LOCUS T(FT)亚家族为磷脂酰乙醇胺结合蛋白(phosphatidyl ethanolamine-binding protein,PEBP)家族的3个亚家族之一,该亚家族只有1个结构域(PEBP结构域),该结构域在动植物中均很保守[2-3]。模式植物拟南芥(Arabidopsisthaliana)中只有1 个FT蛋白,可长距离运输调控开花时间,是成花素的主要成分之一[4-5]。随后在多种植物中也证实了FT 直系同源蛋白是成花素的主要成分。水稻(Oryzasativa)中的成花素Heading date 3a(Hd3a)调控开花的功能与FT 类似,在野生型水稻中过表达Hd3a引起早花表型,插入Hd3a拷贝数越多,早花表型越明显[6]。紫苏(Perilla frutescens)和木薯(Manihotesculenta)中FT基因的同系物均可促进开花[7-8]。近期研究发现,在拟南芥中过表达毛竹PhFT4基因可使植株提前开花[9]。麻竹(Dendrocalamuslatiflorus)中的成花素候选基因DlFT1在开花植株中的表达量显著上调,过表达DlFT1的水稻表现出强烈的早花表型,过表达DlFT1的麻竹可直接从愈伤组织中分化出小穗[10]。
除调控开花外,FT 蛋白在植物发育过程中还发挥着其他作用:光叶蔷薇(Rosawichuraiana)的两个FT-like基因功能发生了分化,其中RwFT1可能参与光周期调控及芽休眠,而RwFT2则参与冷响应及花发育[11]。在芥菜型油菜(Brassicajuncea)中过表达BjuFT会出现分枝模式和角果形状的变化,花出现畸形[12]。除促进开花外,水稻中Hd3a还可以在腋生分生组织中积累,促使侧芽向外长出形成分蘖[13]。在烟草(Nicotiana tabacum)中异位过表达陆地棉(Gossypiumhirsutum)GhFT1可使烟草开花提前,还可以促进烟草基部的侧芽生长,诱导莲座叶腋芽增多[14]。浙江农林大学分子育种与笋用林团队前期研究发现,毛竹中至少存在16个FT-like基因,推测某些FT基因可能参与笋芽发育[1,15],但相关生物学功能仍有待进一步研究。
鉴于此,本研究拟用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)技术分析毛竹PheFT12a基因的表达模式,通过聚乙二醇(polyethylene glycol,PEG)介导的拟南芥原生质体转化技术分析PheFT12a蛋白的亚细胞定位,通过农杆菌转化拟南芥ft突变体分析其生物学功能,旨在为深入探讨毛竹FT基因家族的生物学功能提供参考依据。
1 材料与方法
1.1 试验材料
本研究中的毛竹种子采自广西桂林,将毛竹种子剥壳,用无水乙醇浸泡3 min,连续用反渗透(reverses osmosis,RO)水充分冲洗两次后浸泡2~3 d,期间每隔24 h 换一次水。将浸泡好的种子取出,均匀地平铺在已经铺好纱布的水培育苗托盘上,罩住保鲜膜,室温静置发芽,在自然条件下培养,常规栽培管理。
拟南芥种植:取干燥处理后的拟南芥种子(Col-0基因型),无水乙醇清洗1 次,再用75%乙醇洗2~3 次,每次清洗2 min 左右,于超净工作台内,将消毒好的拟南芥种子吸出,打在灭菌滤纸上晾干。晾干后,将其均匀撒在1/2 MS 固体培养基上,封口膜密封。在4 ℃冰箱内春化处理3 d,然后将其转移至育苗室,培养一周左右,将发芽的苗移至育苗基质,常规栽培管理。
1.2 总RNA提取及cDNA合成
采集生长2 个月的毛竹实生苗各组织,迅速放入液氮中。采用Trizol(Invitrogen,美国)法提取各组织总RNA,用1.0%琼脂糖凝胶电泳检测提取的RNA 完整性,用超微量紫外分光光度计(NanoDrop One,美国)检测所提取RNA 的OD260/OD280纯度值和浓度。用DNaseⅠ(TaKaRa,大连)处理提取总RNA,去除其中残留的DNA。cDNA 合成参照PrimeScriptTMRT reagent Kit with gDNA Eraser 反转录试剂盒(TaKaRa,大连)的说明进行操作,置于-80℃保存备用。
1.3 毛竹PheFT12a基因克隆
根据PheFT12a序列,运用Primer Premier 5.0软件设计引物(表1),由杭州有康生物科技有限公司合成。以毛竹叶片cDNA 为模板行PCR 扩增。PCR 反应体系共50 μL:Green Taq Mix 25 μL,10 μmol·L-1上下游引物各2.5 μL,cDNA 5 μL,ddH2O 15 μL。PCR 反应程序:95 ℃预变性5 min;95 ℃变性30 s,65 ℃退火30 s,72 ℃延伸60 s,34个循环;72 ℃延伸10 min。将回收产物连接pMD18-T 克隆载体(TaKaRa,大连)并转化,挑取阳性克隆交送杭州有康生物科技有限公司测序。

表1 引物信息Table 1 Primer information
1.4 生物信息学分析
参考文献[4-5,16]中的FT亚家族信息,从拟南芥基因组数据库(https://www.arabidopsis.org/)和水稻基因组数据库(http://www.ricedata.cn/gene/index.htm)中下载相应序列;毛竹FT亚家族成员的鉴定及分析方法借鉴Zhao 等[1]的研究,以拟南芥和水稻中已公布的AtFT及Hd3a序列作为基准序列在毛竹基因组数据库(http://forestry.fafu.edu.cn/db/PhePacBio/blast/blast_cs.php?tdsourcetag=s_pcqq_aiomsg)中进行本地blast,Evalue 值设为1e-10,将比对结果用TBtools(v1.059)软件从毛竹基因组数据库中进行抽取,将提取序列用Pfam(PF01161)及HAMMER3.0 软件进行验证;利用GSDS 2.0 进行基因结构分析;利用Clustal W 网站(https://www.genome.jp/tools-bin/clustalw)进行多序列比对;利用MEGA X 软件中的最大似然法(maximum likelihood,ML)构建蛋白质矩阵的系统进化树,进化模型选择Jones-Taylor-Thornton(JTT)model,bootstrap 值设为1 000以检验各分支可靠性;利用Expasy的protparam在线软件(http://web.expasy.org/protparam/)计算氨基酸理化性质;通过Expasy 的ProtScale(https://web.expasy.org/protscale/)分析蛋白质的亲、疏水性;利用PRABI 的SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)进行蛋白质二级结构预测;以水稻Hd3a 蛋白结构为模板,通过Swiss-Model(http://swissmodel.expasy.org/interactive)进行三级结构预测;利用PlantCARE 在线软件对起始密码子上游2 000 bp 的序列进行启动子顺式作用元件分析;采用NCBI Conserved Domain Database(https://www.ncbi.nlm.nih.gov/cdd)软件分析蛋白保守结构域。
1.5 qRT-PCR
根据获得的PheFT12a基因cDNA序列,采用Primer Premier 5.0 设计引物(表1),由杭州有康生物科技有限公司合成。以在毛竹各组织及条件下稳定表达的PheUBQ为内参基因[10,17]。PCR反应体系共10 μL:cDNA 0.5 μL,10 μmol·L-1上下游引物各0.4 μL,TB Green®Premix Ex Taq™ II(TaKaRa,大连)5 μL,ddH2O 3.7 μL。PCR反应程序:95 ℃预变性3 min;95 ℃变性10 s,55 ℃退火30 s,39个循环;每个反应设定3次。采用2-ΔΔCt法计算毛竹PheFT12a在不同组织的相对表达量,采用IBM SPSS Statistics26.0软件进行单因素方差分析。
1.6 亚细胞定位
根据PheFT12a序列设计含有酶切位点引物(表1),以前期获得的目的基因克隆质粒为模板进行PCR 扩增,电泳、切胶回收目的条带。
通过同源重组的方法构建亚细胞定位重组载体:用BamHⅠ对植物荧光表达载体pCAMBIA1300-GFP的质粒进行单酶切,酶切体系为50 μL:10×QuickCut Green Buffer 5 μL,BamHⅠ1 μL,载体2 μg,加ddH2O至总体积为50 μL,30 ℃金属浴酶切5 min,电泳检测是否酶切完全,切胶回收。运用同源重组酶将目的基因扩增片段纯化产物与酶切后的载体连接,连接体系为:10 μL 目的基因2 μL,载体1.5 μL,5×CEⅡBuffer 2 μL,ExnaseⅡ3 μL,ddH2O 1.5 μL,37 ℃金属浴连接30 min。将连接产物转化至DH5α中,涂布于50 μg·mL-1卡那霉素的溶菌肉汤(Luria-Bertani,LB)固体培养基上培养。挑取单克隆,液体培养基培养,对单克隆进行菌液PCR检测,将含重组质粒的菌液送至杭州有康生物科技有限公司测序。将测序正确的阳性菌扩大培养,再进行无内毒素质粒大提。
选取在育苗基质中培养1~2 周大小的拟南芥,通过酶解液法提取原生质体,利用PEG 法将构建好的载体转化至原生质体。制片后用激光共聚焦显微镜(Leica,德国)观察蛋白定位。
1.7 植物表达载体构建
用XbaⅠ和KpnⅠ对表达载体pCAMBIA1301 进行双酶切,酶切体系为50 μL:XbaⅠ1 μL,KpnⅠ1 μL,10×QuickCut Green Buffer 5 μL,载体1 μg,加ddH2O至总体积为50 μL,37 ℃金属浴酶切30 min,电泳检测是否酶切完全,切胶回收。将酶切后的表达载体与目的基因片段进行重组反应,后续操作同亚细胞定位载体构建。将测序正确的阳性菌扩大培养之后进行质粒小提。
1.8 拟南芥遗传转化
选择已开花且初具果荚、茎叶健壮的拟南芥ft突变体,剪去其果荚,浇透水备用。在含利福平和卡那霉素YEP 固体培养基上接种含pCAMBIA1301-PheFT12a载体的阳性农杆菌,28 ℃培养48 h,挑取单菌落接种于YEP 液体培养基,28 ℃培养至OD600=0.8~1.0,离心收集菌体,用提前配好的转化液(50 mL:0.11 g 1/2 MS粉末+5%蔗糖+5 μL Silwet-77)悬浮农杆菌菌体。将拟南芥花序完全浸入转化液中,侵染20~30 s,侵染结束,暗培养24 h,转移至正常光照培养,重复侵染2 次,之后正常培养。待果荚成熟后收种,种子放变色硅胶,于4 ℃冰箱中保存。
2 结果与分析
2.1 PheFT12a基因克隆及生物信息学分析
以毛竹实生苗叶片cDNA 为模板,以全长引物PheFT12a-F/R(表1)进行PCR 扩增。电泳结果显示,扩增片段大小约500 bp,与预期目的片段大小一致(图1-A)。测序结果显示,扩增片段大小长为522 bp。

图1 PheFT12a基因克隆及生信分析Fig.1 Cloning and bioinformatics analysis of PheFT12a
生信分析显示,PheFT12a基因定位于scaffold 8,包含4个外显子和3个内含子,第2和第3外显子分别长62 和41 bp,具有FT基因典型的结构特征(图1-B),内含子的剪接位点为保守的GT-AG。
PheFT12a基因编码173 个氨基酸,含有PEBP 保守结构域,属于FT-Like 亚家族。与AtFT 氨基酸序列相似性为60.8%,与Hd3a 氨基酸序列相似性为59.78%,与OsFTL12 氨基酸序列相似性为94.15%。蛋白序列比对结果显示,PheFT12a的85 位为保守的酪氨酸残基Y,同时含有维持PEBP 家族功能的T66、D73、E84、P94、G102 等9 个氨基酸残基,以及形成开花复合体(florigen activation complex,FAC)所必需的氨基酸位点D62、R64、P96、T99、F103 和R132(图1-C),该结果提示PheFT12a可能参与开花调控。
蛋白序列分析结果表明,PheFT12a蛋白分子量为19.31 kD,等电点为8.88,不稳定指数为44.66,平均疏水性为-0.22,脂肪指数为74.28。
通过Expasy 在线SOPMA 程序对PheFT12a氨基酸序列进行二级结构分析,结果显示,其二级结构主要由α-螺旋、β-折叠、延伸链和无规则卷曲组成,其中无规则卷曲形式最为丰富,为53.18%,其次是延伸链和α-螺旋,分别为24.86%、16.76%(图1-D)。采用同源建模法(以水稻Hd3a 为参照)预测PheFT12a的三级结构,结果显示,PheFT12a与水稻Hd3a 的三级结构一致度为61.59%,提示PheFT12a与Hd3a 的功能可能存在一定相似性(图1-E)。
2.2 毛竹PheFT12a蛋白聚类分析
将拟南芥及水稻中的FT 亚家族与毛竹FT 亚家族构建系统进化树(氨基酸序列),结果如图2 所示,PheFT12a蛋白首先与水稻OsFTL12 聚在一类,亲缘关系最近,再与水稻的其他4条FT聚在一个小分支上,其中OsFTL10 已被证明具有促进开花的功能[18]。而与Hd3a 及RFT1 亲缘关系相对较远,表明在长期进化过程中,PheFT12a蛋白功能上与Hd3a 及RFT1 存在有一定差异,但可能依旧参与开花。
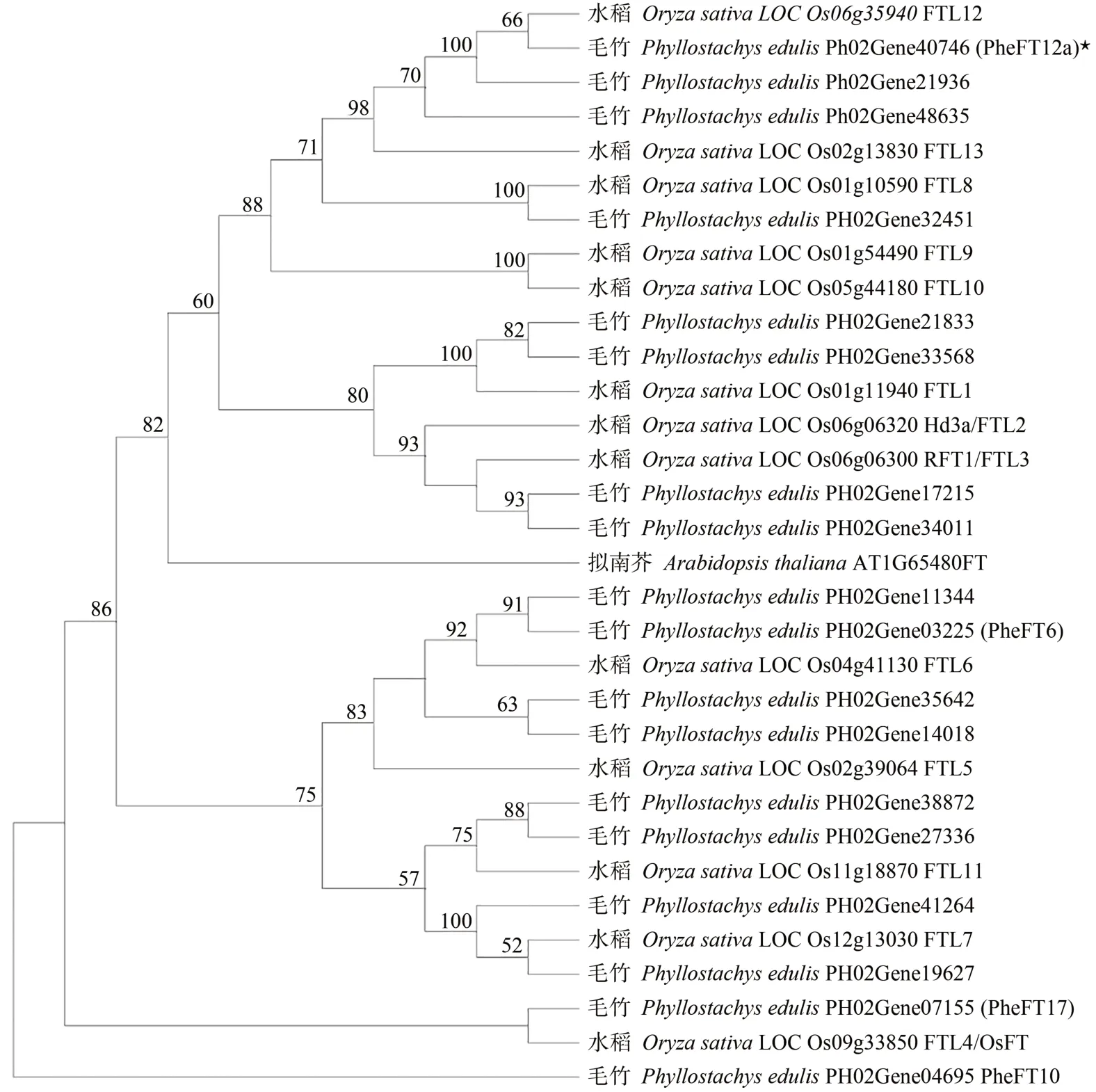
图2 基于ML法构建毛竹与拟南芥、水稻FT蛋白的系统进化树Fig.2 Phylogenetic tree of FT proteins from Arabidopsis,rice and moso bamboo on ML method
2.3 PheFT12a顺式作用元件分析
对PheFT12a起始密码子上游2 000 bp的序列进行顺式作用元件分析,结果显示,PheFT12a启动子含有响应非生物胁迫以及激素的顺式作用元件,包括ABRE(参与脱落酸响应,abscisic acid responsive elements)、P-box(参与赤霉素响应)、G-box(参与光响应)、circadian(参与昼夜节律调控)和MBS(参与干旱诱导,MYBbinding sites)等(表2)。结果表明,PheFT12a基因表达可能受外界环境如光照、干旱及激素的影响。
2.4 PheFT12a组织特异性分析
为了解PheFT12a基因在毛竹不同组织中的表达情况,对二月龄毛竹实生苗的根、茎、叶、侧芽中的基因表达量进行检测,结果显示,PheFT12a基因在叶片中表达量最高,茎次之,侧芽和根中相对较低(图3)。

图3 PheFT12a基因在不同组织中的表达量Fig.3 Expressionof the PheFT12a gene in different tissues
2.5 亚细胞定位分析
为确定PheFT12a 蛋白的亚细胞定位,构建了PheFT12a-GFP融合蛋白表达载体,通过PEG介导法转化拟南芥原生质体,在激光共聚焦显微镜下观察融合蛋白的亚细胞定位。结果如图4所示,对照GFP蛋白在细胞中均有分布,而PheFT12a-GFP 融合蛋白在细胞质和细胞核有明显的荧光信号,主要富集于细胞核。

图4 PheFT12a蛋白的亚细胞定位Fig.4 Subcellular localization of PheFT12a protein
2.6 转基因拟南芥表型观察
为了进一步研究PheFT12a的生物学功能,采用农杆菌介导法将重组载体35S∷PheFT12a转化ft突变体。对突变体回补植株进行DNA 水平及RNA 水平检测,PheFT12a基因已整合进突变体植株中(图5-A),并且在回补植株中稳定表达(图5-B)。

图5 PheFT12a回补ft突变体植株开花表型Fig.5 Flowering phenotype of ft mutant transformed with 35S∷PheFT12a
将1/2 MS培养基上生长7 d的拟南芥纯合植株移至育苗基质中,14 d后野生型拟南芥抽薹,ft突变体在47 d左右抽薹,而突变体回补植株在18~21 d抽薹。突变体回补植株的抽薹时间比野生型晚6 d左右,但显著早于ft突变体,部分回补了ft突变体的晚花表型(图5-C、D)。上述结果,表明,PheFT12a是开花促进因子,促进开花现象明显。
移植18 d 左右时,野生型和ft突变体主茎数均为1,而突变体回补植株主茎数增多,为2~3 个。统计分析显示,突变体回补植株的主茎数与野生型和突变体存在显著差异(图6-A、B)。在拟南芥生长56 d 时,野生型拟南芥的侧枝数平均为15 个,ft突变体的侧枝数约为16 个,而突变体回补植株的侧枝数显著增加,达到23~24 个(图6-C、D),说明PheFT12a会影响拟南芥侧芽发育。由此可见,PheFT12a可以影响拟南芥开花时间,还可以参与拟南芥侧芽发育。

图6 PheFT12a回补ft突变体植株主茎及侧枝表型Fig.6 Stem and lateral branch phenotype of ft mutant transformed with 35S∷PheFT12a
3 讨论
FT 蛋白最初被证实是成花素的主要成分之一,决定着植物的开花时间[4-5]。近年来,越来越多的研究表明,FT蛋白还可促进鳞茎形成[19-20]、块茎形成[21]、侧枝生长及芽的形成[22-23]以及改变植株形态[24]。
不同物种中FT亚家族成员数量差异很大,拟南芥和水稻中分别有1和13个[4,16],玉米(Zeamays)中有15个[25]。通过全基因组分析,本研究从毛竹基因组数据库(V2.0)中鉴定到18个FT成员。本研究从毛竹中获得的FT基因,与水稻中的OsFTL12相似性最高(图2),其编码的氨基酸序列含保守的PEBP结构域、维持PEBP蛋白功能的保守氨基酸及形成开花复合体的必需氨基酸(图1),推测本研究中的PheFT12a可能影响植物开花时间。
多种植物中的研究结果表明,FT-like 蛋白主要在细胞质和细胞核富集(图4)[26-27]。毛竹中FT基因家族各成员表达量均较低,转录组测序很难检测到PheFT12a的表达[1,28]。本研究通过qRT-PCR 检测到PheFT12a在叶中表达量最高,茎次之,在根和侧芽中表达量均很低。FT基因的表达易受外界环境因子的影响。菊花(Chrysanthemummorifolium)CmFT的表达具明显的昼夜节律特性[29];毛竹PheFT6和PheFT17的基因表达受昼夜节律、温度、干旱等外界环境的影响[15]。本研究中PheFT12a基因启动子上包含多个干旱、光照及激素相关的顺式作用元件,推测该基因的表达可能受上述外界环境的影响。
如前所述,FT 蛋白最初被证实是成花素,拟南芥FT被CONSTANS(CO)激活后与内质网膜蛋白FTINTERACTING Protein 1(FTIP1)相互作用,从而介导转运以诱导开花[30],反之FT 功能丧失后开花延迟[31];水稻Hd3a 蛋白从叶片运输到顶端分生组织中,先与14-3-3 蛋白相互作用,然后与FD 蛋白结合,形成FAC,继而激活下游开花基因APETALA1(AP1)表达,诱导水稻开花[6,27]。另外,水稻中的RFT1和OsFTL10都可促进开花[18,32]。在多种植物中发现,FT-like在其他发育阶段也发挥着重要作用,水稻中的成花素蛋白Hd3a 还可以提高水稻分蘖数[13]。异源过表达棉花GhFT1可以促使烟草基部侧枝增多,诱导莲座叶片腋部出现更多的腋芽[14]。小麦(Triticumaestivum)中的FT-B1可影响每穗的总小穗数[33]。杨树(Populus)的FT2基因过表达可导致开花显著提前[34],还可以调控杨树年生长周期[35]。同为禾本科的毛竹有性繁殖和无性繁殖并存,开花很不规律,开花时间很难预测。本课题组前期研究发现,在长期进化过程中,毛竹PheFT6和PheFT17的功能可能发生变异,PheFT6可能影响笋芽休眠状态解除,PheFT17基因可能参与笋芽的发育[15],但生物学功能并未证实,有关毛竹FT亚家族各成员生物学功能的研究鲜见报道。Yang等[9]研究发现毛竹PhFT4可促进拟南芥开花。与前人研究不同的是,本文中的毛竹PheFT12a基因既可以影响拟南芥开花时间,也可以影响拟南芥芽发育,暗示该基因的功能存在分化的可能性。
4 结论
本研究结果表明,PheFT12a基因编码的蛋白主要富集于细胞核;PheFT12a可以部分回补ft突变体的晚花表型,还可以促进回补植株的主茎及侧枝发育。
