辐射诱变冰糖橙早熟突变体的遗传鉴定与品种特性
2023-10-23邓钢桥邓子牛龙桂友
王 驰 黄 伟 龚 玲 何 淙 邓钢桥 邓子牛, 龙桂友, , 李 娜, ,
(1湖南农业大学园艺学院,湖南 长沙 410128;2湖南省核农学与航天育种研究所,湖南 长沙 410125;3国家柑橘改良中心长沙分中心,湖南 长沙 410128)
冰糖橙是湖南省黔阳县从普通甜橙实生变异中选出的新品种。随着人们生活水平的提高,对柑橘果实大小、口感、外观、上市时间、高糖和低酸等关注程度逐渐上升。因此,筛选不同成熟期优良冰糖橙品种或株系是改善其品种结构、提高市场竞争力的有利手段之一。辐射诱变具有突变率高、突变谱宽、后代性状稳定快、育种周期短等优点,目前已成为获得新种质资源的有效途径之一,其中60Co-γ 射线是辐射诱变中最为常用的物理辐射源[1-2]。通过辐射诱变获得早熟突变体是提高市场竞争力的有利手段之一[3],如漆巨容等[4]通过60Co-γ射线辐照诱变从江津地区的实生甜橙桐子柑中选育得到了早熟甜橙新品种渝早橙;黄柳根[5]用60Co-γ 辐射锦橙接穗,获得了早熟、无核少核的突变系。
柑橘遗传鉴定方法主要有形态学标记法、细胞学标记法、生化标记和分子标记等。其中形态学标记和分子标记技术已经被广泛应用到作物种质资源遗传多样性分析、遗传变异评价和品种鉴定等诸多领域[6]。分子标记最常用的方法为简单序列重复(simple sequence repeats,SSR)和插入缺失(insertion deletion,InDel)标记[7-8]。
柑橘的果实成熟是一个极其复杂的生理和生化过程,其中蔗糖和柠檬酸代谢以及调控成熟相关基因的时空表达都会对柑橘果实成熟产生重要的作用[9]。柑橘果实中,可溶性固形物和可滴定酸含量及固酸比的变化是果实成熟的重要评价指标[10]。续丽红等[11]发现,早熟脐橙赣南早果实成熟时较同一时期的纽荷尔脐橙可溶性固形物含量高,可滴定酸含量低,固酸比值大,早熟性状明显。柑橘果实可溶性固形物的主要构成是糖分,且以蔗糖为主,可滴定酸以柠檬酸为主,随着果实发育成熟,糖含量增加,酸含量降低[12]。有研究发现,果实中柠檬酸积累代谢相关的磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)和柠檬酸合成酶(citrate synthase,CS)的表达或酶活性与果实发育成熟期间果实中柠檬酸含量呈正相关[13-14],蔗糖磷酸合成酶(sucrose phosphatesynt,SPS)是蔗糖合成过程中的限速酶,其活性与蔗糖积累呈正相关[15-16]。此外石彩云等[17]证实了柠檬酸转运到液泡与质子泵有关。Feng 等[18]人证实了柠檬酸转运基因CsPH8的低表达是低酸柑橘品种柠檬酸含量较低的主要原因。Guo等[19]对不同品系暗柳橙和红暗柳果实的有机酸合成、积累和代谢相关基因研究,认为CsPH8基因低表达可能是红暗柳品种柠檬酸积累低的重要原因。
鉴于此,本研究比较早熟突变体与对照的物候期、春梢叶片、花、果实外观性状,果实内在品质及糖酸代谢相关酶基因表达等的差异;应用DNA 分子标记鉴定遗传变异,评价该突变体的早熟性状。旨在分析冰糖橙早熟突变体遗传上是否发生了改变,果实内在品质变化是否与果实提早着色一致并达到品种固有特性,为进一步选育和登记成早熟冰糖橙新品种提供依据。
1 材料与方法
1.1 试验材料
早熟突变体(mutant)和冰糖橙对照(wild-type)均来自湖南农业大学国家柑橘改良中心甜橙诱变育种基地。早熟突变体为冰糖橙枝条经60Co-γ射线辐射处理获得,剂量为30 Gy;2012 年春辐射诱变枝条和对照枝条均高接在6 年生枳砧太田椪柑成年树上,2015 年开始结果,一般田间肥水管理和病虫害防治。
1.2 DNA提取及分子标记
使用CTAB 法提取柑橘叶片DNA[20],SSR 分子标记引物信息参考文献[21];Indel 分子标记引物信息参考文献[22]。PCR 扩增体系为20 μL:1 μL DNA 模板、2×Rapid Taq Master Mix 10 μL、上下游引物各0.5 μL,补充ddH20 至总体积为20 μL。程序为:94 ℃预变性3 min,94 ℃变性40 s,55 ℃退火40 s,72 ℃延伸30 s,36个循环;72 ℃延伸8 min,扩增产物4 ℃条件下保存。聚丙烯酰胺凝胶电泳检测PCR 扩增产物,银染色后观察记录扩增结果。
1.3 物候期观测、叶片和花器官性状测定
参考张春苗等[23]的方法观察记载物候期,依据《柑橘种质资源描述规范和数据标准》[24]测定春梢叶片的性状和花器官的形态特征。
1.4 果实性状测定
谢花后70 d 开始每隔30 d 测量1 次,果实成熟期开始每15 d 测量1 次。电子天平称量果实单果质量;游标卡尺测量果实横经和纵经,CR-400 色差仪(柯尼卡美能达投资有限公司,武汉)测定每个果实赤道面3个方向的色差值[L*值、a*值、b*值和色差指数(color index,CI)],PAL-BX/ACID1 糖酸一体机(爱宕科学仪器有限公司,广州)测定可溶性固形物(total soluble solids,TSS)和可滴定酸(titratable acids,TA)含量,参考Lu等[25]的方法测定蔗糖和柠檬酸含量。
1.5 RNA 提取和实时荧光定量PCR(real-time quantitative PCR, qRT-PCR)分析
花后160、175、190 和205 d 采集早熟突变体和冰糖橙对照果实样品,取果肉于-80 ℃条件下保存。采用SteadyPureRNA 提取试剂盒(艾科瑞生物,长沙)提取果肉汁胞总RNA,紫外分光光度计(梅特勒托利多科技有限公司,上海)测定RNA 浓度,1%琼脂糖凝胶电泳进行RNA 质量检测,用Evo M-MLV 反转录试剂盒(艾科瑞生物,长沙)合成cDNA。qRT-PCR 使用的特异引物见表1,由北京擎科生物公司合成,使用CFX 96 荧光定量PCR 仪(Bio-Rad,美国)进行qRT-PCR 扩增,Actin作为内参基因,3次生物学重复。
1.6 数据分析
采用IBM SPSS Statistics 20 分析数据(P<0.05),GraphPad Prism 8.0.2作图。
2 结果与分析
2.1 叶片和花器官性状比较
与对照相比,早熟突变体春梢叶片长和宽显著增加,叶柄长、翼叶长和宽没有显著变化,而春梢长度显著变短(表2)。早熟突变体与冰糖橙(对照)均为完全花,由花瓣、雌蕊、雄蕊、萼片和花托组成(图1)。与对照相比,早熟突变体的花瓣长和宽显著变小,雄蕊数显著增多,雌蕊长度和雄蕊长度显著变短,花瓣数量没有显著差异(表3)。

图1 早熟突变体与对照的花形态特征Fig.1 Flower morphological characteristics of mutant and wild-type Bingtang sweet orange
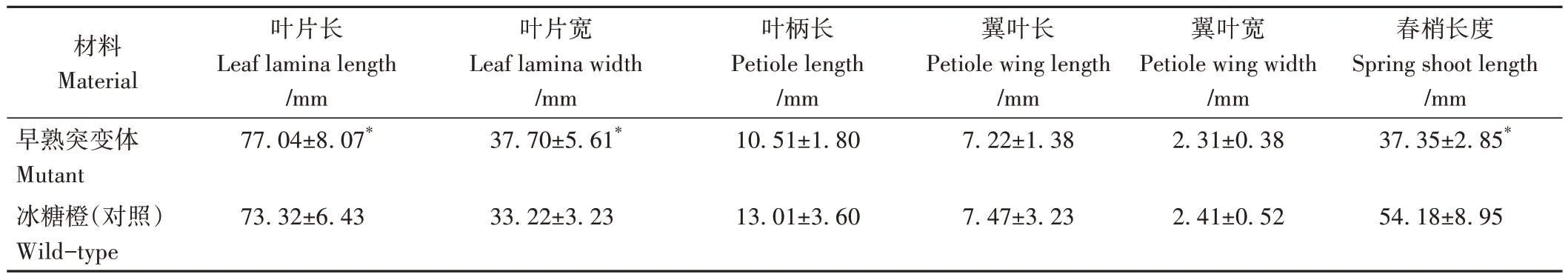
表2 早熟突变体与对照春梢长度及叶片性状比较Table 2 Comparison of spring shoot length and leaves of mutant with wild-type Bingtang sweet orange

表3 早熟突变体与对照的花器官性状比较Table 3 Comparison of flower morphology traits of mutant with wild-type Bingtang sweet orange
2.2 果实大小比较
早熟突变体果实的横径、纵径和单果重在发育与成熟各时期均大于冰糖橙对照,在花后175~205 d 时更为明显,而果实形状与对照果实没有明显不同,均呈圆球形(表4)。

表4 果实成熟过程中早熟突变体与对照的果实大小变化Table 4 Changes in fruit size of mutant and wild-type Bingtang sweet orange
2.3 果实发育过程中果皮色泽变化比较
早熟突变体果实在花后160 d 褪绿,175 d 转为黄色,190 d(11 月上旬)完全着色转为橙黄色,果肉颜色转为橙色;对照冰糖橙果实在花后175 d褪绿,190 d转为黄色,205 d(11 月下旬)完全着色转为橙黄色,果肉颜色转为橙色(图2-E)。果皮色差的明亮度(L*值)、红绿度(a*值)和黄蓝度(b*值)从花后130 d开始与对照冰糖橙均有显著性差异(图2-A~C)。尤其是代表红绿颜色转变的a*值(图2-B)和色差指数(图2-D)表明早熟突变体果实在花后175 d由负值转为正值,对照冰糖橙在花后205 d由负值转为正值。
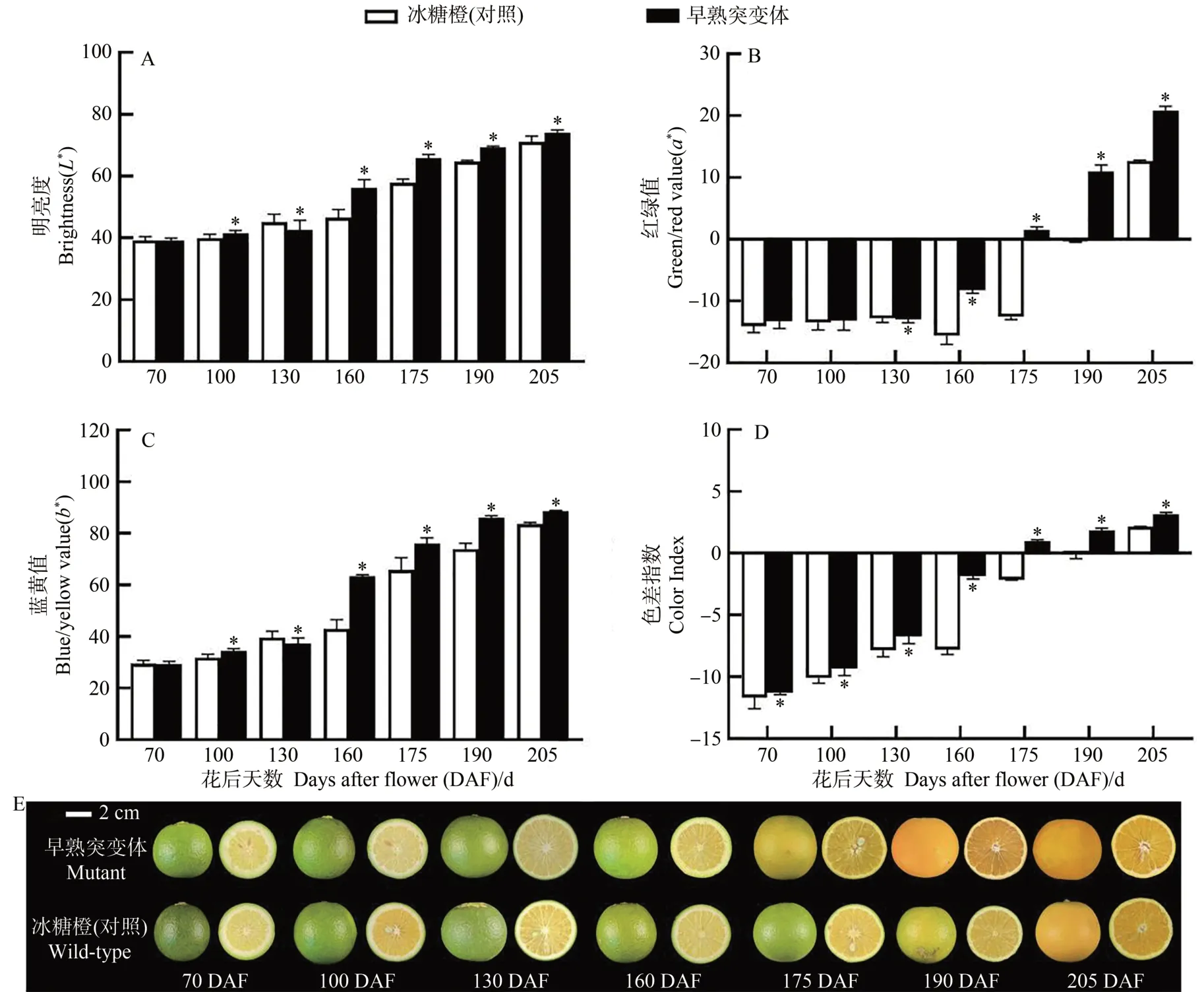
图2 早熟突变体和冰糖橙对照果实发育成熟过程中果皮果肉颜色变化Fig.2 Changes in color of pericarp and pulp during fruit ripening in mutant and wild-type Bingtang sweet orange
2.4 物候期比较
冰糖橙早熟突变体物候期表现为3 月11 日萌芽,4 月17 日初花期,4 月20 日盛花期,4 月25 日终花期,5 月6 日第一次生理落果,6 月10 日第二次生理落果,11 月6 日果实成熟,较冰糖橙(对照)分别提早4、2、2、3、4、5和15 d(表5)。
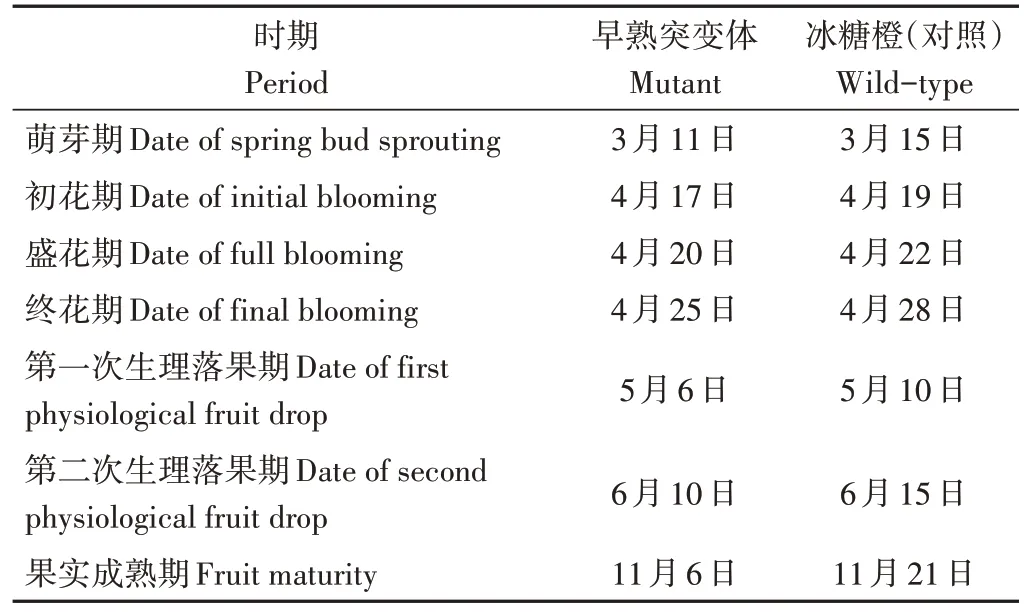
表5 早熟突变体和冰糖橙对照果实物候期比较Table 5 Phenological comparison of mutant and wild-type Bingtang sweet orange
2.5 早熟突变体遗传性鉴定
对早熟突变体和冰糖橙对照的DNA 用InDel 引物(图3-A)和SSR 引物(图3-B)分别扩增并用聚丙烯酰胺凝胶电泳检测,均扩增出差异条带。其中InDel引物1扩增的差异条带位于750~1 000 bp,InDel引物2扩增的差异条带位于200~500 bp,InDel 引物3 扩增的差异条带位于100~200 bp(图3-A)。SSR 引物P68 扩增的差异条带位于100~300 bp,SSR 引物P179 扩增的差异条带位于300~400 bp(图3-B)。
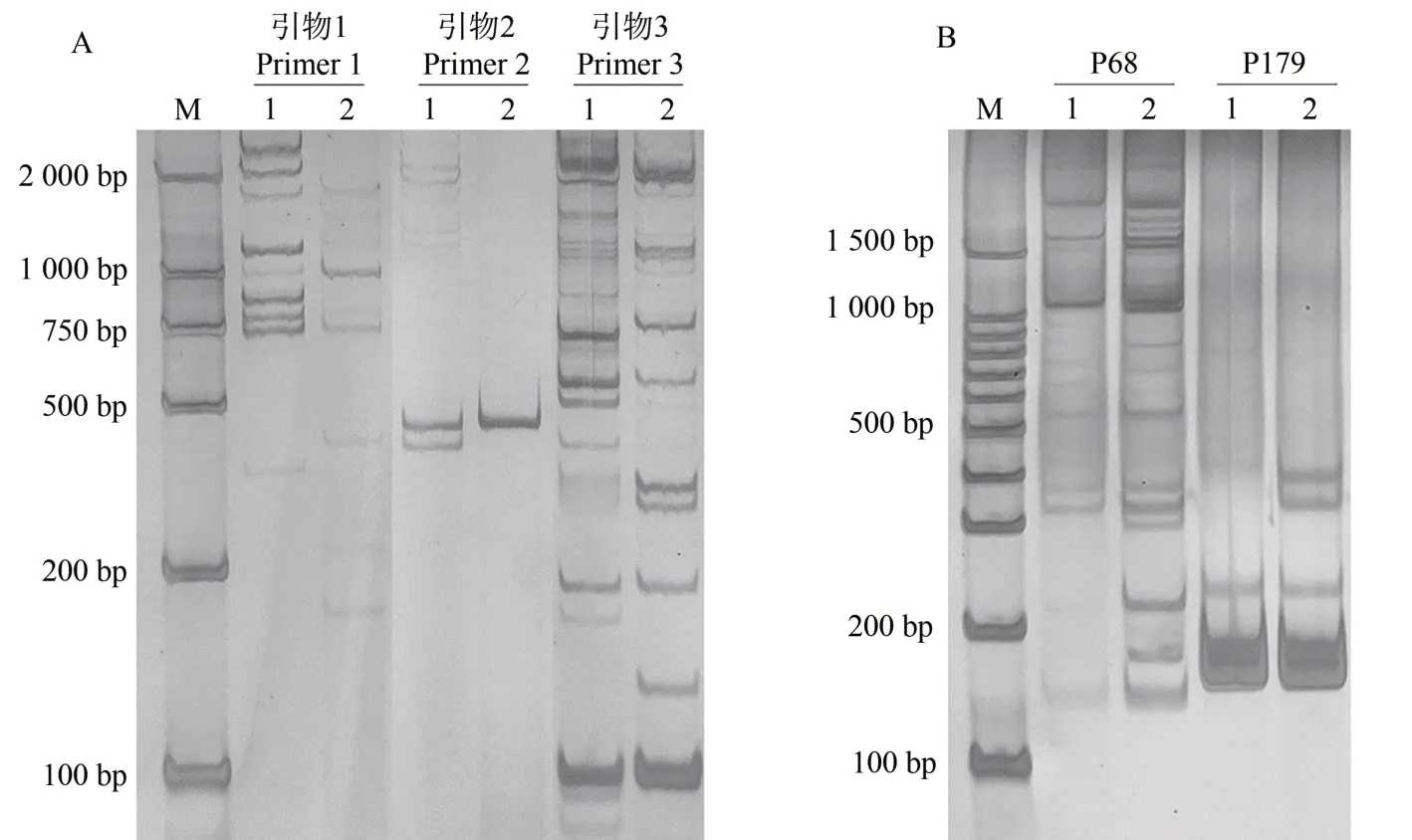
图3 SSR和InDel引物聚丙烯酰胺扩增结果Fig.3 SSR and InDel primers amplification results on polyacrylamide gel
2.6 果实发育过程中糖酸含量变化比较
随着冰糖橙(对照)果实生长发育与成熟,果实中的可溶性固形物含量呈现增加的趋势,花后205 d 成熟时增加幅度增大并达到较高含量14.50 °Brix;早熟突变体果实的可溶性固形物含量在花后160 d 时与对照果实基本一致,175 d 时显著高于对照,相差1.00 °Brix,至190 d 时更是大幅增加到对照果实成熟期的含量14.53 °Brix,较同期对照高3.30 °Brix,205 d时达到15.97 °Brix(表6)。另一方面,两者果实可滴定酸含量随着果实生长发育与成熟而逐渐降低,对照冰糖橙果实成熟时(花后205 d)含酸量0.61%,早熟突变体果实含酸量从花后160 d起均显著低于对照果实,190 d 时降至0.46%,并在190~205 d 稳定在该水平。固酸比随着果实生长发育而增大,对照冰糖橙果实固酸比从花后190 d 时的13.98 到花后205 d 成熟时快速增大到23.77,早熟突变体果实固酸比从花后175 d 的18.37 到190 d 时快速增大到31.59,到205 d 时略有增加,为35.48。
2.7 果实发育过程中蔗糖和柠檬酸代谢相关基因的表达分析
早熟突变体果实中磷酸蔗糖合酶基因CsSPS1表达水平在花后160~190 d显著高于冰糖橙对照(图4-A),另一个合酶基因CsSPS4表达水平在花后160~205 d均显著高于对照,并在190 d 时表达量最高(图4-B),早熟突变体和冰糖橙对照果实的酸性转化酶基因CsAI在花后190 d的表达趋势基本一致(图4-C),蔗糖转运基因CsSUT1表达高峰在冰糖橙对照果实中出现在花后205 d即成熟时,早熟突变体则出现在花后160 d,提前了45 d(图4-D)。
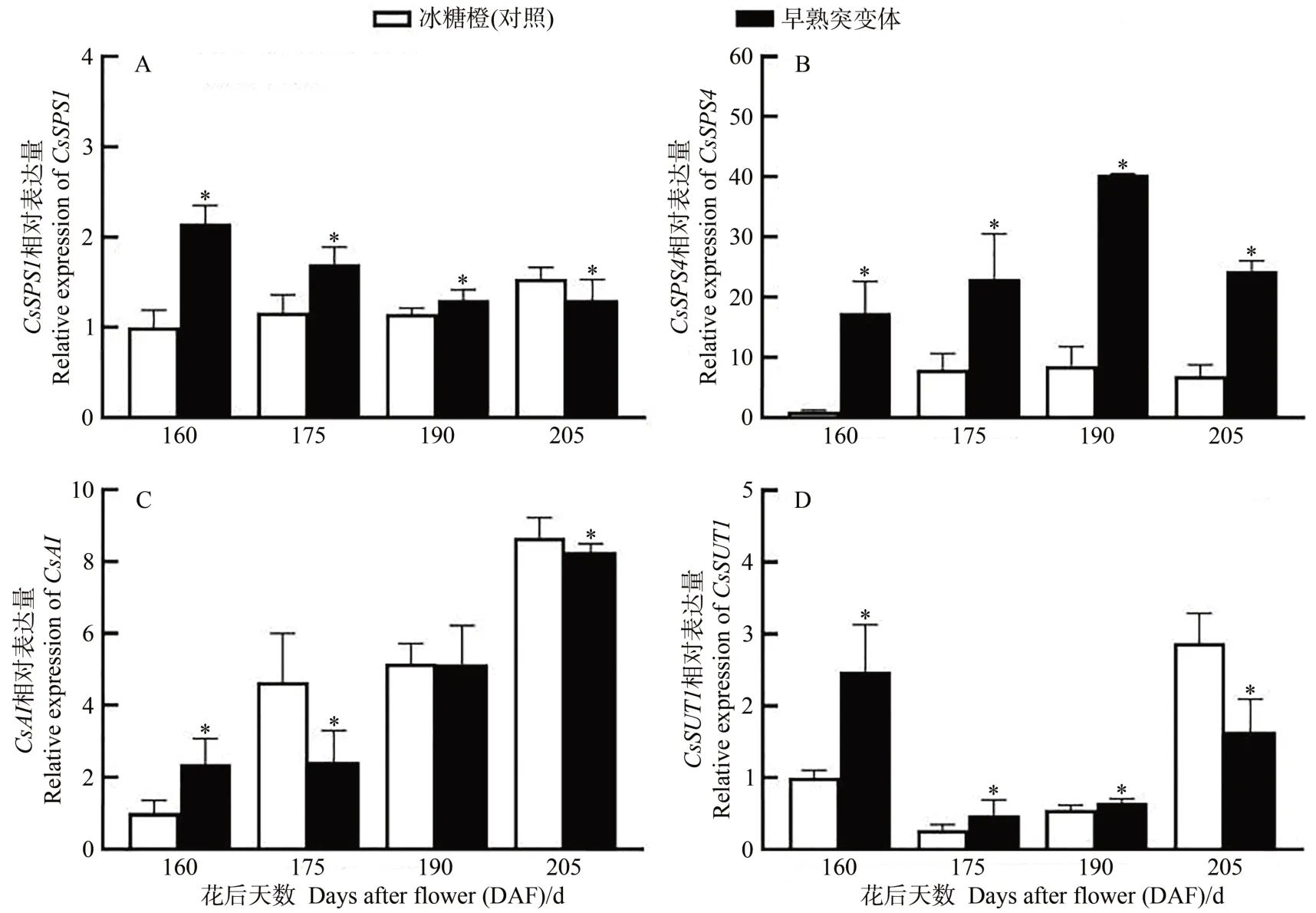
图4 早熟突变体和对照冰糖橙果实成熟过程中糖代谢相关基因的表达Fig.4 Expression of sugar metabolism related genes during fruit ripening of mutant and wild-type Bingtang sweet orange
突变体果实发育成熟过程中柠檬酸合成基因CsPEPC表达趋势和对照冰糖橙基本一致(图5-A),另一个柠檬酸合成基因CsCS1的表达水平显著低于对照,尤其是花后160 和175 d 时的表达水平只有对照的50.255%和19.24%(图5-B),而果实柠檬酸降解基因CsACO3在175 和190 d 时的表达水平显著高于对照果实(图5-C),柠檬酸液泡贮藏基因CsPH8在花后160 d时表达水平仅为对照的21.76%,在花后175 d 低于对照,在花后190 d时高于对照,而花后205 d时两者变幅不大(图5-D)。

图5 早熟突变体和对照冰糖橙果实成熟过程中柠檬酸代谢相关基因的表达Fig.5 Expression of citrate metabolism related genes during fruit ripening of mutant and wild-type Bingtang sweet orange
3 讨论
3.1 性状遗传变异分析
柑橘常用的遗传鉴定方法主要有形态学标记法和分子标记法[26],利用形态学标记鉴定物种性状遗传多样性是简单、直观和快捷的方法[27]。Fang 等[8]对柑橘中种内种间的特异性开发InDel 标记物,发现InDel 标记物对种间和种内变异和鉴定分析均有效,有望应用于柑橘的种质鉴定、系统发育分析、遗传多样性评估和标记辅助育种。胡冬梅等[28]开发了用于柑橘芽变材料区分的高效SSR 位点实现了柑橘芽变材料的高效区分。此外,前人发现InDel 和SSR 标记可以共同用于遗传多样性和系统发育研究。García-Lor 等[7]利用InDel 和SSR 标记在柑橘遗传多样性种间结构中进行比较应用。另有研究表明,利用形态学标记结合DNA 分子标记鉴定新品种或株系的遗传变异更准确。如李娜等[26]发现冰糖橙新品种橘湘珑的植物学特征和物候期与对照不同,并且SSR 标记结果显示橘湘珑与对照在DNA 遗传水平上有差异。本研究结果与前人研究相似,筛选的辐射诱变突变体物候期和植物学特征与对照不同,果实着色提早15~20 d,SSR 和InDel 分子标记结果中存在特异性差异条带,说明该突变体为在形态学特征与DNA 分子水平均发生了遗传改变的早熟突变体,对进一步选育和登记早熟冰糖橙新品种奠定了分子遗传的基础。
3.2 早熟性状与糖酸含量变化及相关基因表达的关系
柑橘果实早熟性表现为外观颜色提早转变为品种固有颜色,果实中可溶性固形物与可滴定酸含量以及固酸比同步达到品种固有品质特性[29]。如赣南早成熟时可溶性固形物、蔗糖含量及固酸比较同一时期的对照纽荷尔脐橙高,可滴定酸和柠檬酸含量则低,早熟品种糖酸含量优于晚熟品种[11]。本试验中,冰糖橙早熟突变体果实颜色比对照提前15 d 完全转变成橙黄色,同时花后190 d 时果实可溶性固形物含量、可滴定酸含量以及固酸比,为14.53 °Brix、0.46%、31.59,分别达到、低于和高于对照果实正常成熟时(花后205 d)的14.50 °Brix、0.61%、23.77,果实外观颜色与内在品质同步达到冰糖橙正常成熟度,说明突变体果实提早着色与果实糖酸内在品质变化一致,内外同步达到成熟。
蔗糖和柠檬酸是柑橘果实可溶性固形物、可滴定酸的主要组成成分,蔗糖与柠檬酸的积累和降解与合成、降解、转运相关基因的表达调控有关[30]。如Feng等[18]发现CsPH8在低酸柑橘品种红暗柳橙果实中低表达,而石彩云等[17]研究表明CsPH8的低表达是突变柑橘果实可滴定酸与柠檬酸含量显著降低的主要原因。本试验中突变体果实2 个蔗糖合成相关基因CsSPS1和CsSPS4的表达水平显著高于对照,蔗糖转运基因CsSUT1表达高峰较对照提早了45 d,可能导致果实中蔗糖合成多、转运早,与花后175~205 d 可溶性固形物含量显著高于对照的结果相吻合。这与徐文欣[31]对岩溪晚芦及其早熟芽变果实进行分析结果相似,表明早熟芽变比对照的CsSUT1和CsSPS的表达量高。花后160 和175 d 时的突变体果实柠檬酸合成基因CsCS1表达水平只有对照的50.25%和19.24%,花后175 和190 d 时柠檬酸降解基因CsACO3的表达水平显著高于对照,柠檬酸液泡贮藏基因CsPH8花后160 d时表达水平仅为对照的21.76%,突变体酸相关基因表达可能导致柠檬酸合成少、降解快、贮运少,与突变体果实含酸低、降酸早的品质变化是一致的。该研究结果为突变体的进一步选育和登记早熟冰糖橙新品种与后续早熟研究奠定了基础。
4 结论
相较对照而言,辐射诱变冰糖橙早熟突变体春梢显著变短,主要物候期提早2~5 d,成熟时果实较大,果皮和果肉提前15 d转色成橙黄色和橙色,表现为低酸、降酸早、固酸比值高,蔗糖合成多、转运早,柠檬酸合成少、降解快、贮运少;SSR与Inder标记表明DNA 发生了遗传改变。综上,辐射诱变获得的突变体为植物性状、生物特性、DNA产生遗传改变、果实降酸早、含酸低、固酸比高、11月上旬完全着色成熟的早熟冰糖橙变异。
