FOX-7合成工艺优化及中间体热分解特性
2023-10-23何文祥郭子超陈利平
何文祥,郭子超,陈利平,刘 峰
(南京理工大学 化学与化工学院,江苏 南京 210094)
引 言
1,1-二氨基-2,2-二硝基乙烯(FOX-7)是一种新型、低摩擦感度、低撞击感度的不敏感含能材料[1-2]。其爆轰特性与RDX相似,但感度低于TNT[3-4]。FOX-7的制备过程简单[5-6]。FOX-7被归类为低感烈性炸药,具有十分广阔的应用前景,成为世界各国的重点研究对象,对其合成方法的探索和改进对含能材料的发展有着重要意义[7-9]。
FOX-7的合成方法一般包括两个步骤,即杂环化合物的硝化反应和硝化中间体的水解开环反应[10],主要分为三类:(1)原料为2-甲基咪唑,与硝硫混酸混合硝化产生中间体2-(二硝基亚甲基)-4,5-咪唑烷二酮,最后通过胺化反应制取FOX-7[11]。该方法产率较低,约为13%。(2)先以盐酸乙脒和乙二酸二乙酯为原料发生缩合生成2-甲氧基-2-甲基-4 ,5-咪唑烷二酮和2-甲基-4 ,5-咪唑烷二酮,然后用甲醇重结晶得到2-(二硝基亚甲基)-4,5-咪唑烷二酮,最后胺化得到FOX-7。该方法虽提高部分产率但多了一步缩合反应,过程更加复杂。(3)以2-甲基嘧啶-4,6-二酮为原料,硝化生成2-(二硝基亚甲基)-5,5-二硝基嘧啶-4,6-二酮,再水解开环得到FOX-7[12]。比起前两种方法,该方法产率较高,操作相对简单。目前国内以2-甲基-4,6-二羟基嘧啶为原料,经硝化、水解反应得到 FOX-7的合成方法应用最为广泛,最具有工业化前景[13]。该方法具体的反应路线如图1所示[14]。
采用硝硫混酸硝化2-甲基-4,6-二羟基嘧啶(物质1)时,混酸中的硝鎓离子首先进攻嘧啶环上的5号位,硝基分两次取代,2-甲基-4,6-二羟基-5-硝基嘧啶(物质2)很容易继续被硝化生成二硝基衍生物(物质3),因此实验中很难获取物质2这种单硝化产物[15]。当5号位为偕二硝基结构时,甲基上的碳原子易受到亲电进攻,最终氢原子被硝基取代,硝化生成2-(二硝基亚甲基)-5,5-二硝基嘧啶-4,6-二酮(物质5)。物质5在水中发生开环反应,水解生成FOX-7和二硝基甲烷。
现在合成FOX-7普遍采用间歇釜式反应器,目前的技术为间歇操作,硝化反应放热剧烈,反应体系中的物质5稳定性差,易发生爆炸[16-17],硝化反应时间较长,需要3h以上,难以实现大规模工业生产,需要进一步改进与优化其合成工艺。
合成方法(3)的硝化过程中可分离的中间体为物质2和物质5。已知物质1在浓硫酸中只会硝化生成物质3,因为单硝基衍生物的硝化速率远远高于单硝基衍生物的形成速度,无法获取物质2[18]。而在硝酸水溶液中(不含硫酸)可分离获取物质2,但是并未对其热稳定性和分解反应动力学进行研究。本研究在第三种方法的基础上对FOX-7的合成工艺进行改进,即先合成稳定的中间体物质2,再将其作为原料合成FOX-7。利用DSC对中间体2、硝化最终产物混合物(含物质5)和物质5进行热稳定性分析,并利用精度较高的模型拟合法获得中间体2的热分解动力学模型和准确的动力学参数,为使用其作为FOX-7原料提供了有效的安全信息。利用反应量热仪(RC1e)研究不同工艺条件下反应体系的放热特性,在线监测硝化反应过程中放热速率的具体情况,为工艺优化提供指导依据。新工艺可以降低危险性,减少硝化时间,为后续在工业上大规模生产提供新的方法和思路。
1 实 验
1.1 原料与仪器
2-甲基-4,6-二羟基嘧啶(物质1),纯度97%,阿拉丁试剂(上海)有限公司;冰醋酸,≥99.8%,阿拉丁试剂(上海)有限公司;硫酸,纯度98%,国药集团化学试剂有限公司;发烟硝酸,纯度95%,南京化学试剂股份有限公司; 去离子水,实验室自制。
DSC-1型差示扫描量热仪,瑞士METTLER-TOLEDO公司,N2气氛(50mL/min);反应量热仪,瑞士METTLER-TOLEDO公司,配备一个0.5L的玻璃反应釜、一个温度探头、一个校准加热器和一个进料泵。温度、进料速率、反应热流和 反应的温度、进料速率、反应热流和传热数据都由RC1e在线监测;wooking K2025高效液相色谱仪,山东悟空仪器有限公司;Elemantar Vario EL cube有机元素分析仪,德国Elementar公司;Thermo Scientific Q Exactive Focus组合型四极杆Orbitrap质谱仪,美国安捷伦公司;Bruker-AVANCE III 500MHz型核磁共振谱仪(NMR),德国Bruker公司;Thermo Fisher Scientific- NICOLETIS10傅里叶变换红外光谱仪(FTIR),赛默飞世尔科技公司。
1.2 样品的制备
在剧烈的搅拌和冷却(15~20℃)下,将1当量物质1分批加入到3当量发烟硝酸(95%)和6当量冰醋酸的混合溶液中[19]。混合物在15~20℃下搅拌2~3h,冷却到5℃以下,然后用必要量的冰水稀释。将混合物静置4h,过滤掉沉淀物,用水洗涤,并在空气中干燥。最后在水中重结晶,过滤并烘干,得到无色粉末状物质2。
元素分析(C5H5N3O4,%):计算值,C 35.09,H 2.92,N 24.56;实测值。C 34.98,H 2.90,N 24.66。产物经高效液相色谱仪检测,流动相为甲醇/0.01mol乙酸铵溶液,体积比4∶6,流速为0.8mL/min,纯度大于98%。MS(ESI)(m/z) calcd for C5H5N3O4[M-H+]-:170.1104;Found:170.1179。IR(KBr),v(cm-1):2817,2696,1672,1625,1589,1446,1416,1360,1287,1273,1049,950,784,649。1H NMR(500MHz,DMSO-d6),δ:12.98,2.31。13C NMR(126MHz,DMSO-d6),δ:161.77,155.82,118.10,18.07。
在强烈搅拌下将物质1分成小份加入至过量的浓硫酸中[8],使混合物的温度不超过25℃。待固体溶解后,缓慢通入足量的发烟硝酸(95%),保持反应温度为15~20℃。保温反应3h后,冷却至10℃,收集硝化反应混合物(含物质5)。取一小部分样品进行过滤,得到物质5。
1.3 DSC测试
使用DSC在动态模式下对物质1、物质2、硝化反应混合物(含物质5)和过滤后的物质5分别进行了热稳定性测试。测试样品质量分别为1.05、0.47、0.91和2.22mg,测试物质1和物质2的样品池为耐高压不锈钢坩埚,另外两个样品均选用镀金高压坩埚;升温速率均为8K/min,温度范围分别为30~400、100~360、30~350和35~300℃。
基于DSC对物质2分别进行了动态和等温测试,样品池均选用耐高压不锈钢坩埚和镀金垫片。试样质量为(0.48±0.01)mg,动态DSC测试的温度范围为100~360℃,升温速率为2、4、6、8K/min。为了确认物质2的热分解是否存在自催化特性,基于动态DSC的测试结果,对物质2在247℃进行了等温测试,试样质量为0.54mg。
1.4 反应量热实验
使用反应量热仪(RC1e)研究FOX-7合成过程中硝化反应的热危险性,基于实验数据探究硝化反应放热规律,优化合成工艺。硝化反应的反应量热测试过程为:将1当量的物质1或2作为原料溶于过量硫酸中,混合溶液倒入玻璃反应釜,在搅拌和恒温条件下进行量热校准。使用蠕动泵以恒定流速通入硝硫混酸,保温反应2h后再次量热校准,最后降温至10℃出料。所有实验中的硫酸总质量均为物质1的12.5倍,其他具体实验条件如表1所示。
2 结果与讨论
2.1 硝化工艺过程物质的热稳定性分析
物质1、物质2、硝化反应混合物(含物质5)以及过滤后得到的物质5的动态DSC测试结果见图2。
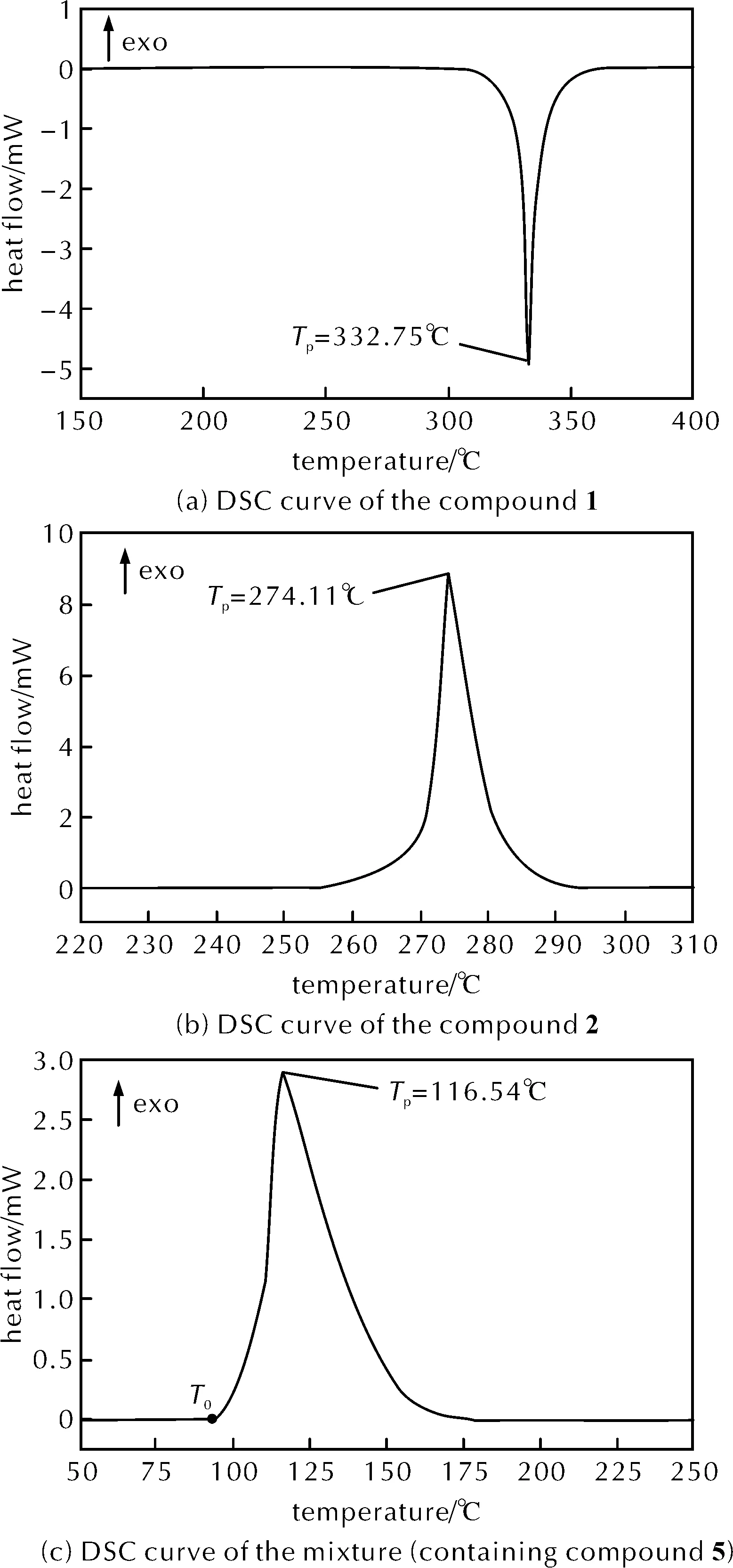
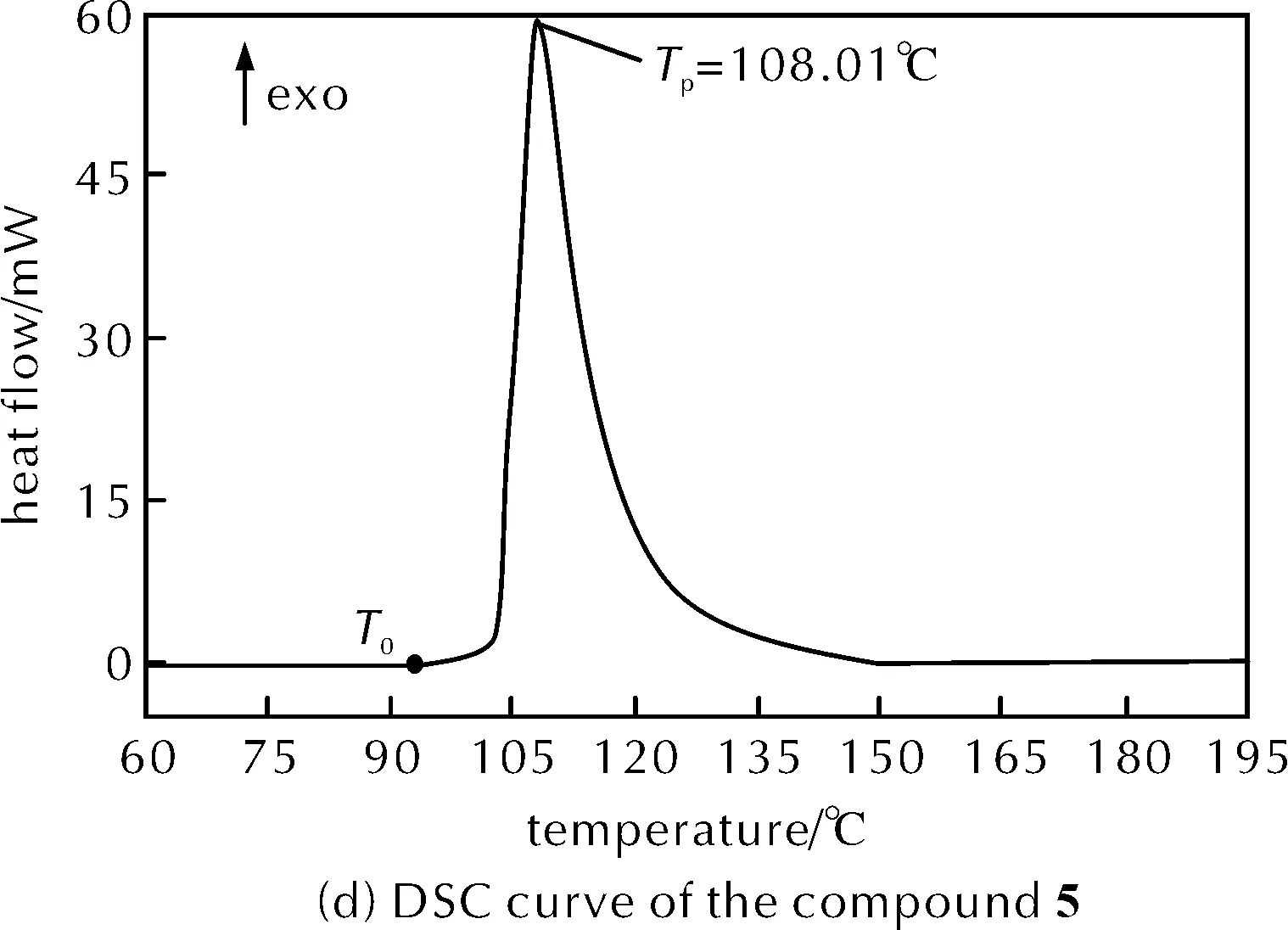
图2 升温速率8K/min下物质1、2、5和混合物的DSC曲线Fig.2 DSC curves of the compound 1, 2, 5 and mixture at the heating rate of 8K/min
从图2(a)可知,物质1的动态DSC曲线中仅有1个吸热峰位于325℃附近,无明显放热现象,热稳定性很好。由图2(b)可知物质2的动态DSC曲线仅有一个放热峰,峰温Tp为274.11℃,比放热量为1020.95J/g。
收集的硝化反应混合物包含最终硝化产物5、硫酸和少量硝酸。在30~350℃,以8K/min的升温速率对收集的混合物进行DSC动态测试,结果见图2(c)。DSC曲线偏离基线的温度(T0)为95.12℃,将热流曲线的斜率最大值处的切线与基线的交点所对应的温度定为该样品的起始分解温度(Tonset),混合物的起始分解温度(Tonset)为108.38℃,峰值温度(Tp)为116.54℃,比放热量(ΔHd)为617.71J/g。硝化产物5中含有4个硝基,为含能官能团,且DSC结果表明,混合物的热稳定性较差,因此在放热剧烈的硝化反应过程中需严格控制温度。
对经过抽滤而与酸分离的物质5进行热稳定性分析,DSC动态曲线见图2(d)。DSC曲线偏离基线的温度(T0)为94.62℃,起始分解温度(Tonset)为103.78℃,峰值温度(Tp)为108.01℃,比放热量(ΔHd)为2239.35J/g。分析可知物质5的比放热量远大于硝化反应最终料液混合物,这是由于缺少了大量作为溶剂稀释物质5的硫酸,热稳定性很差,起始分解温度也提早了。干燥状态下的物质5机械感度会变高[8],因此一定要保证物质5与足够的硫酸混合,且严格控制环境温度,不能受机械刺激。
2.2 硝化中间体物质2的热分解特性
2.2.1 动态DSC实验
在100~360℃,不同升温速率下对物质2进行DSC动态测试,研究其热分解特性,DSC动态曲线见图3,热分解特征参数见表2。
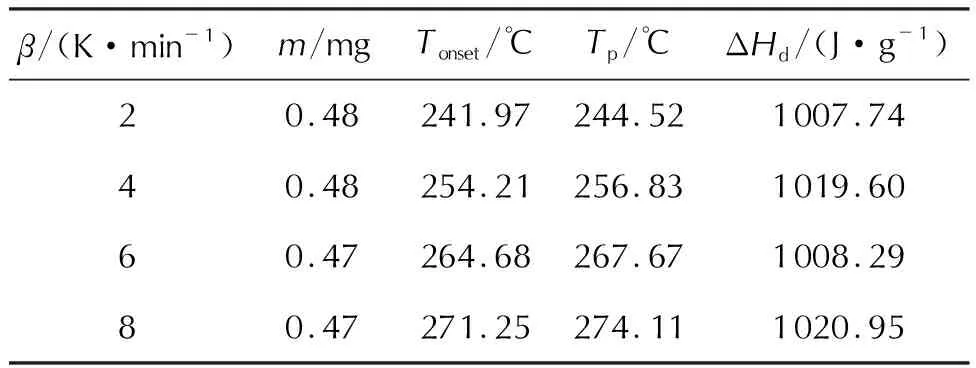
表2 物质2的热分解特性参数Table 2 Thermal decomposition parameters of compound 2
由图3可知,在不同的升温速率下,物质2的动态DSC曲线仅有一个放热峰,放热速率快,其平均比放热量为1014.15J/g。随着升温速率的增大,曲线向高温区移动,起始分解温度和峰值温度均变大。
2.2.2 等温DSC实验
为了探究物质2是否具有自催化特性,对该物质进行了等温DSC测试[20]。若等温实验的曲线中出现钟形峰,则该物质的分解具有自催化特性。物质2在247℃的等温DSC测试结果见图4。
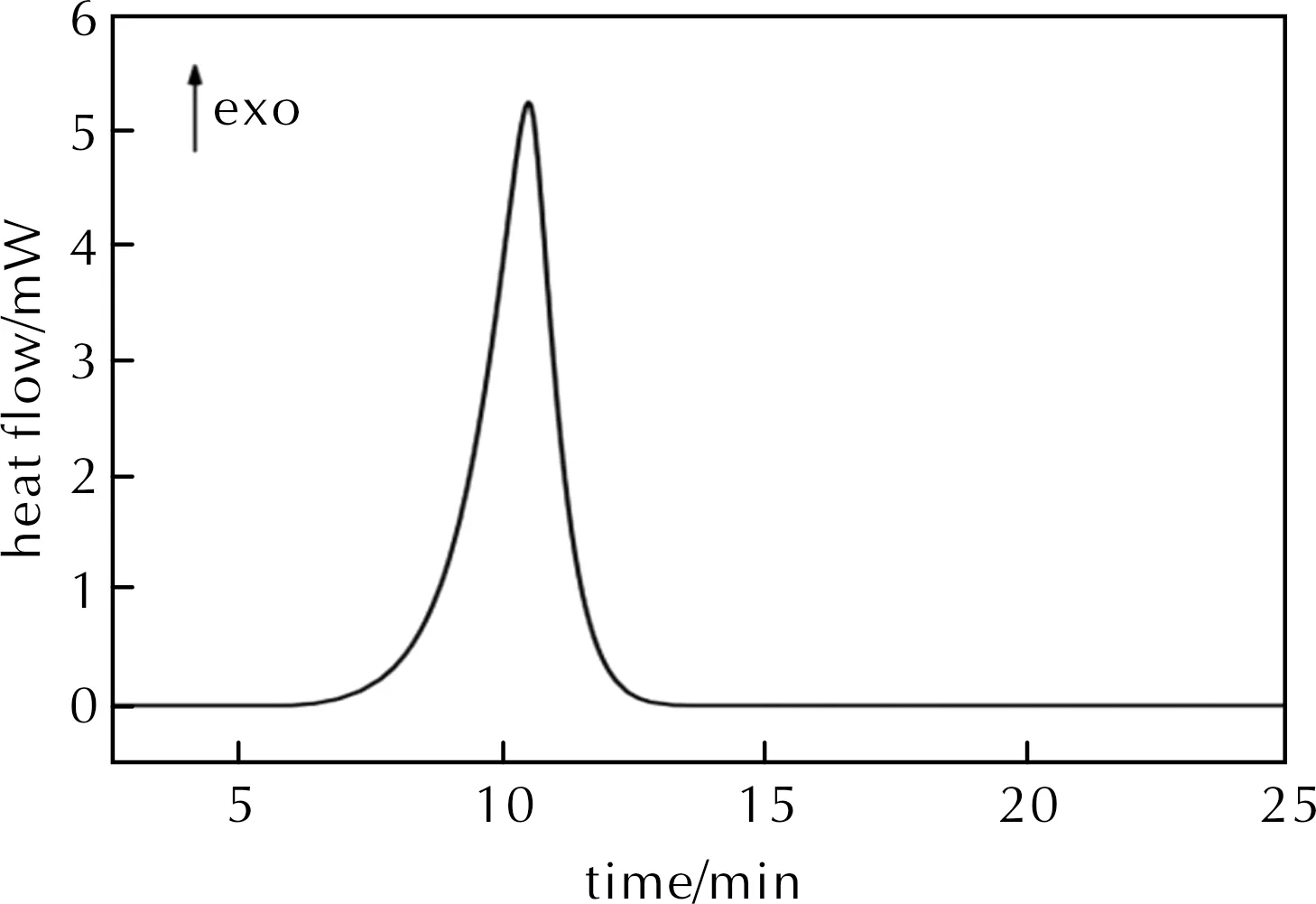
图4 物质2在247℃的等温DSC曲线Fig.4 Isothermal DSC curve of compound 2(247℃)
247℃等温实验的ΔHd为1018.65J/g,与DSC动态实验结果相近。由图4可知,该物质在247℃等温条件下,约5min后开始分解,分解放热速率先增大后减小,证实其具有自催化特性。
2.2.3 热分解动力学分析
物质2的热分解具有自催化特性,因此对该物质分解反应建立自催化反应模型。采用动力学模型拟合的方法,求解动力学参数[21]。A为物质2,B为分解产物,自催化反应中,产物B的生成对反应物A的分解有促进作用,其反应过程可表示为:
引发反应阶段:
(1)
自催化反应阶段:
(2)
式中:n11、n12、n21、n22、n23为化学计量数。
总反应速率方程为:
(3)
式中:E为活化能;R为气体常数;T为温度。
假设n11=n21=n1,n22=n2,均为反应级数。令z0为引发反应指前因子A1和自催化反应指前因子A2的比值,Ez为两者活化能的差值:
(4)
Ez=E1-E2
(5)
带入式(3)中,令E2=E,A2=A,可得:
(6)
式(6)即为广义自催化模型,被用来描述大量自催化系统[22]。
选用热分析软件TSS,根据上述反应过程建立热分解动力学模型。理论上说,采用动态或等温两种不同的量热模式进行测试并不会改变物质分解的模型,利用多种量热模式的测试数据研究物质分解动力学可以得到更准确的结果[23]。
基于此理论,选用自催化模型同时对上述等温数据和动态数据共同求算动力学,以获取正确的动力学模型并求算准确的动力学参数。通过对4个不同升温速率下的动态DSC实验和247℃等温DSC实验数据进行非线性拟合,使拟合结果达到最优,获取动力学参数。分解反应放热量(Q)和放热速率(dQ/dt)的拟合结果见图5。该物质动力学模型所对应的动力学参数见表3。
由图5可知,在动态和等温两种量热模式下,所建的自催化反应动力学模型对该物质的拟合效果较好,可以较好地描述热分解反应过程,适用性较广,可用于分析和预测多种情形下物质的分解行为。
2.2.4 预测TMRad
绝热条件下最大反应速率到达的时间,称为TMRad,是评估系统失控反应的重要参数[24]。进行工艺热风险评估时,需要知道TD24,即TMRad=24h对应的温度。
如果目标反应发生冷却系统失效,FOX-7合成中涉及的硝化体系可以近似为绝热条件。这种情况下,采用数值模拟得到的动力学模型对TMRad进行了预测,对物质2的硝化工艺优化具有一定的指导意义。预测结果见图6,TD24为137.0℃。
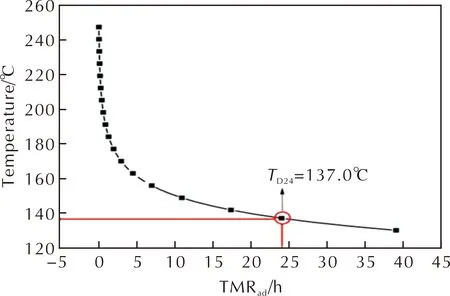
图6 物质2的TMRad预测曲线Fig.6 TMRad prediction curve for compound 2
2.3 硝化反应放热特性分析
2.3.1 以物质1为原料
以物质1为原料,硝化合成2-(二硝基亚甲基)-5,5-二硝基嘧啶-4,6-二酮(物质5),该反应过程的量热曲线如图7所示。其中,qr为热流值,M为反应釜内混合物的总质量,Tr为反应釜内温度,Tj为夹套温度。

图7 物质1硝化反应的量热曲线(20℃)Fig.7 The RC1 curves of compound 1(20℃)
由图7中的热流曲线可知实验过程中的反应情况,结合图1的硝化反应机理及高效液相色谱仪检测结果,可研究其放热规律。物质1与硫酸的混合溶液在20℃的温度下搅拌均匀,从A点至F点,使用蠕动泵以恒定流速通入硝硫混酸。
由图7可知,A点开始迅速放热,AB段热流值快速上升,原因是物质1硝化生成物质2,物质2的硝化速率远远高于单硝基衍生物(物质2)的形成速率[12],此时发生连续硝化反应生成物质3,反应速率快。BC段热流值较为平稳,略有下降,可能是物质1的浓度降低,第一步硝化反应速率下降,而物质3硝化生成物质4的硝化速率较慢,总体反应热释放速率降低。反应体系中物质3、4和5溶于水后均会发生水解反应[12],但只有物质5水解后会生成FOX-7,所以在BC段取样,溶于甲醇的水溶液中,经高效色谱仪分析,主要为3个峰,检测到少量原料物质1,无FOX-7的峰,说明反应体系中基本不存在物质1、物质4和物质5。
CD段热流值上升,是因为同时发生多步硝化反应,物质2浓度变大,物质3的形成速率变快,物质3变多,甲基上的氢原子被硝基取代生成物质4,物质4能迅速转化为物质5[14]。D处反应体系内析出固体,DE段热流值迅速上升。在CD上升段取样进行液相分析,色谱结果中峰较多,可证明此时反应体系内有多个硝化物质,每个物质水解后生成的产物也不同,且其中检测到少量的FOX-7。将D处的析出物迅速转移至水中,最后得到黄色固体,经高效液相色谱检测为FOX-7,证明CD段物质5开始累积,D处反应体系析出物为物质5,放出大量的热。EF段热流值先上升再下降,对应的过程为:一开始物质3和物质4的量多,连续硝化生成物质5的反应速率较快,当剩余的反应物浓度较低时,反应速率降低,放热量逐渐减小。F点停止加料,在20℃下进行保温反应。
以物质1为原料进行硝化反应,单位质量的反应热为145.15kJ/kg,冷却失效时合成反应的最高温度(MTSR)为118.76℃,高于硝化反应混合物(含物质5)的T0(95.12℃)和起始分解温度Tonset(108.38℃)。物质5稳定性差,反应冷却失效时,温度上升,将触发物质5的分解反应(MTSR>Tonset),放出大量的热,极易造成反应失控。所以该方法无法大规模批量合成FOX-7。在同样的搅拌和超声操作条件下,物质1溶于硫酸的时间远大于物质2溶于硫酸的时间,若以溶解性更好的物质2为原料进行硝化反应,既能减少时间成本,加快反应进程,也能避免物质1硝化生成物质2所产生的热量,降低反应危险性。
2.3.2 以物质2为原料
将物质2作为原料硝化合成物质5,不同工艺条件下反应过程的量热曲线见图8。

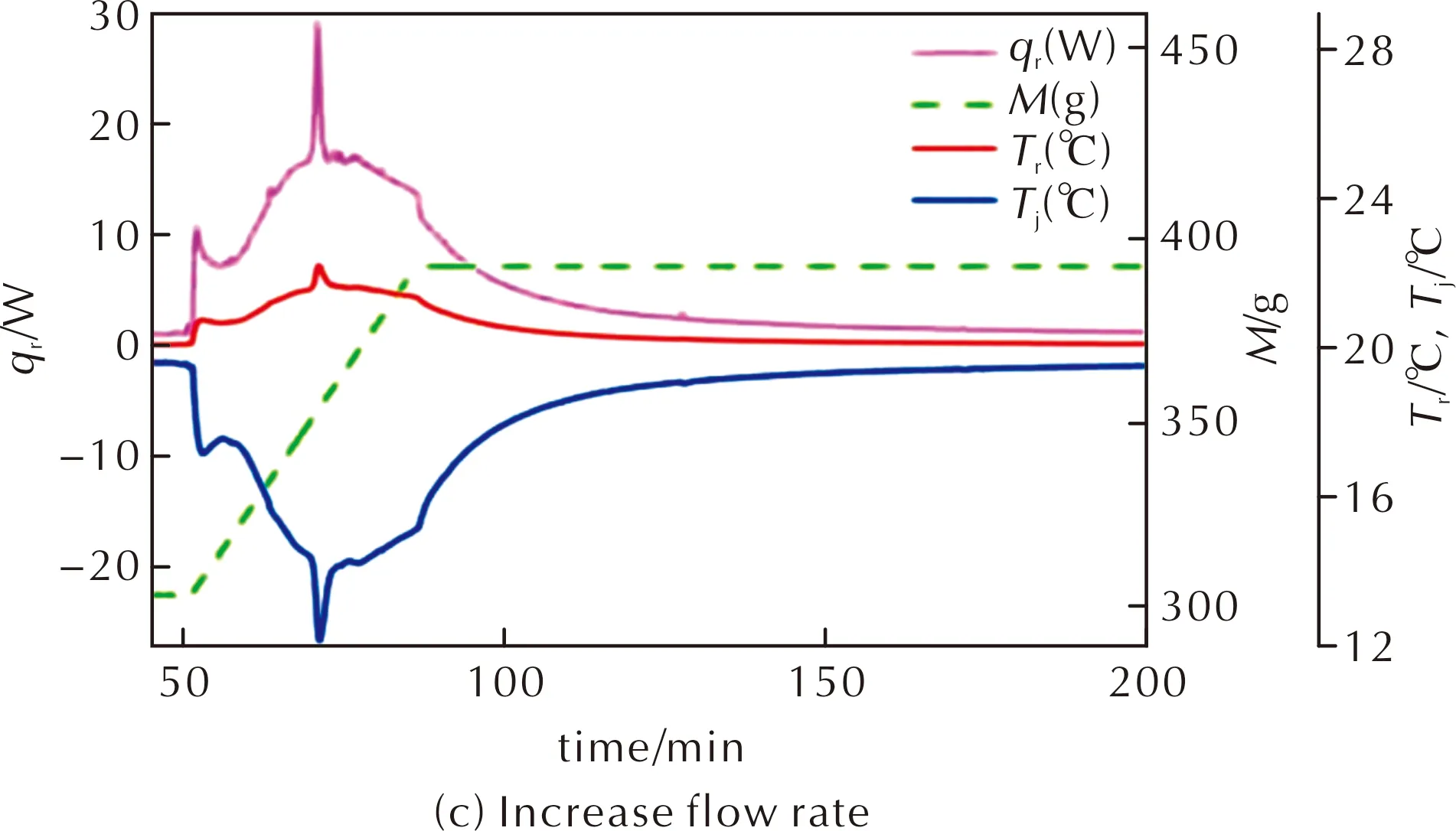
图8 物质2在不同温度和流速时硝化反应的量热曲线图Fig.8 The RC1 curves of compound 2 at different temperatures and flow rates
由图8(a)中的热流曲线可知20℃时反应体系放热情况,放热规律与图7较为相似。图7中热流曲线开始不断上升直至接近10W,然后较为平稳甚至下降,经过一段时间后由于继续硝化的原因使热流上升;而图8(a)中一开始热量上升到接近5W,平稳一段时间后才会继续上升到10W以上,两种量热曲线最终结果相似。说明在工艺1(图7)中,开始就发生了两步连续硝化,使热流一直上升,而工艺2(图8(a))中没有物质1到物质2的硝化过程,开始主要就是物质2硝化生成物质3,热流平稳,表明物质3继续硝化成物质4的速率比起前两步硝化慢一些。经过一段时间后,物质3浓度上升,生成物质4,并且物质4能快速转化为最终硝化产物5,所以后续热流曲线还会继续上升。
物质2与硫酸的混合溶液在20℃的温度下搅拌均匀,从G点至L点,使用蠕动泵以恒定流速通入硝硫混酸。GH段为加料开始段,出现放热曲线突然上升后下降属于仪器响应问题,为正常现象。G到I点,热流曲线上升速度较快,此时物质2硝化生成物质3,反应速率快。IJ段热流值一开始较为平稳,因为物质3硝化生成物质4的反应速率较慢,此时主要是物质2的硝化反应;后面迅速上升,原因是发生多步硝化反应,物质3浓度变大,甲基上的氢原子被硝基取代生成物质4,物质4能迅速转化为物质5[14]。在J处反应体系内析出固体,JK段热流值迅速上升。将J处的析出物迅速转移至水中,最后得到黄色固体,经高效液相色谱检测为FOX-7,证明IJ段物质5开始累积,J处反应体系析出物质5,放出大量的热。KL段热流值先上升再下降,对应的过程为:一开始物质3和物质4的量多,连续硝化生成物质5的反应速率较快,当剩余的反应物浓度较低时,反应速率降低,放热量逐渐减小。L点停止加料,在20℃温度下进行保温反应。
由图8(b)和(c)可知,改变温度为15℃或改变加料时间,硝化反应的量热曲线与20℃时情况相似。温度降低,反应速率更慢,停止加料后热流曲线缓慢下降,硝化所需时间更长;而加快硝硫混酸的流速,降低加料时间,热流值变大,没有改变放热规律,降低了总反应时间。
2.3.3 反应风险分析
不同工艺条件下的硝化反应量热数据见表4。
由表4数据可知,以物质2为原料进行硝化反应时,总反应热大幅下降。对以物质2为原料进行硝化反应后的最终硝化反应混合物进行热稳定性分析,偏离基线的温度(T0)为97.39℃,比放热量(ΔHd)为541.94J/g。在20℃下,绝热温升降低,MTSR下降至84.28℃,低于最终硝化反应混合物的T0。物质2的TD24为137.0℃,远高于MTSR,该方法可以有效避免物质2和热稳定性差的物质5受热分解,降低反应过程中的热危险性。降低温度至15℃,MTSR可进一步降低,但是硝化反应的时间变长,不稳定物质5的在线时间变长。运用于实际生产时,既增加了生产成本,又增加了冷却失效时的热失控风险。
由表4中的数据可知,MTSR低于硝化反应混合物(含物质5)的T0(95.12℃)和Tonset(108.38℃),冷却失效后,不会触发分解反应,热失控风险低。对工艺进行优化,设计实验减少硝化反应时间,将物质2作为原料,在20℃下加快硝硫混酸的流速,硝化合成物质5。不同工艺条件下的产率见表5。

表5 不同工艺条件下的物质2的产率Table 5 The yield of compound 2 under different process conditions
由工艺优化后的图8与表5可知硝化反应时间明显减少,最后FOX-7产率上升。通过改进工艺,安全性和产率都得到了提升,为后续实际生产的工艺提供一些指导依据。
3 结 论
(1)DSC测试结果表明,FOX-7合成过程中的硝化中间体2-(二硝基亚甲基)-5,5-二硝基嘧啶-4,6-二酮(物质5)热稳定性差,DSC曲线偏离基线的温度T0=95.12℃;单硝基中间体2-甲基-4,6-二羟基-5-硝基嘧啶(物质2)的热稳定性较好,起始分解温度均大于240℃。
(2)物质2的热分解反应具有自催化性质,运用模型拟合法,选用自催化模型同时对DSC等温和动态实验数据进行动力学计算,获取了准确的动力学参数。同时采用两种量热模式的测试数据研究物质分解动力学可以得到更准确的结果,为进一步研究该物质的热危险性提供了参考依据。
(3)结合FOX-7合成过程中的硝化反应机理,利用反应量热仪(RC1e)研究不同工艺条件下反应体系的放热特性,在线监测反应过程中放热速率的具体情况,为工艺优化提供指导依据。
(4)在第三种方法的基础上对FOX-7的合成工艺进行改进,即先合成稳定的中间体物质2,再将其作为原料合成FOX-7。硝化反应的放热量降低35%左右,绝热温升由98.7K降至65K左右,同时MTSR大幅度降低,减小了热风险失控风险。
