曲妥珠单抗联合术前新辅助化疗对乳腺癌患者肿瘤标志物、血管内皮生长因子及凋亡因子的影响
2023-10-23朱建军
吴 剑 ,朱建军,严 婷
(盐城市亭湖区人民医院肿瘤科,江苏 盐城 224002)
乳腺癌是女性最为常见的恶性肿瘤,早期乳腺癌症状多不明显,常以乳房肿块、乳房皮肤异常、乳头溢液等局部症状为主,易被忽视。当病情发展至晚期,癌细胞远处转移,将严重威胁患者的生命安全。为了有效抑制癌细胞活性,降低肿瘤病理分期,临床常采用术前新辅助化疗。有研究表明,在乳腺癌术前新辅助化疗中,联合应用免疫治疗药物曲妥珠单抗对患者病情控制效果更佳,能够为后续手术治疗提供有利基础[1-2]。作为重组人源化单克隆抗体,曲妥珠单抗只作用于机体人表皮生长因子受体-2(HER-2),对非靶向细胞的杀伤力小,不良反应少,在HER-2 过度表达的乳腺癌与胃癌中应用广泛[3]。基于此,本研究选取78 例乳腺癌患者,开展前瞻性临床研究,旨在探讨曲妥珠单抗联合术前新辅助化疗乳腺癌的效果及作用机制,现报道如下。
1 资料与方法
1.1 一般资料采用随机数字表法将2019 年1 月至2022年12 月盐城市亭湖区人民医院收治的78 例乳腺癌患者分为两组。对照组(39 例)患者TNM 分期[4]:Ⅱ期22 例,Ⅲ期17 例;年龄20~80 岁,平均(51.43±12.39)岁。观察组(39 例)患者TNM 分期:Ⅱ期24 例,Ⅲ期15 例;年龄20~79 岁,平均(51.17±12.66)岁。两组患者一般资料比较,差异无统计学意义(P>0.05),组间具有可比性。纳入标准:均符合《中国抗癌协会乳腺癌诊治指南与规范2017》[5]中的诊断标准;HER-2 表达阳性;预期生存时间>6 月;TNM 分期为Ⅱ、Ⅲ。排除标准:合并其他恶性肿瘤;合并癌细胞远端转移;有化疗史。研究经院内医学伦理委员会批准,且患者均签署知情同意书。
1.2 治疗方法对照组患者接受术前新辅助化疗,即每个治疗周期的第1 天采用多西他赛注射液(江苏恒瑞医药股份有限公司,国药准字H20163032,规格:1 mL∶20 mg)75 mg/m2静脉滴注;注射用盐酸表柔比星(浙江海正药业股份有限公司,国药准字H20183145,规格:10 mg/支) 90 mg/m2静脉滴注;注射用环磷酰胺(江苏恒瑞医药股份有限公司,国药准字H32020857,规格:0.2 g/支)500 mg/m2静脉滴注。在对照组的基础上,观察组同时使用注射用曲妥珠单抗[Genentech Inc.,注册证号SJ20181016,规格:440 mg(20 mL)/瓶]4 mg/kg 体质量静脉滴注,后续剂量调整为2 mg/kg 体质量,1 次/周。两组患者均以3 周为1 个治疗周期,均治疗6 个周期。
1.3 观察指标①临床疗效。完全缓解为治疗6 个周期后患者病灶完全消失且维持4 周以上;部分缓解为治疗6 个周期后患者目标病灶最长径总和缩小≥ 30%且维持4 周以上;疾病稳定为治疗6 个周期后患者目标病灶最长径总和缩小<30%,或增加<20%;疾病进展为患者目标病灶最长径总和增加≥ 20%或出现新病灶[5]。客观缓解率=完全缓解率+部分缓解率。②肿瘤标志物。分别于治疗前后患者空腹状态下,采集外周静脉血2 mL,以2 500 r/min 转速离心10 min,取血清,采用酶联免疫吸附法检测血清癌胚抗原、糖类抗原125、糖类抗原153 水平。③血管内皮生长因子。采血、血清制备、指标检测方法同②,对血清血管内皮生长因子A、血管内皮生长因子B、血管内皮生长因子C 水平进行检测。④凋亡因子。采血、血清制备、指标检测方法同②,对血清人诱骗受体3、环氧化酶-2 水平进行检测。
1.4 统计学方法采用SPSS 21.0 统计学软件分析数据,计数资料以[ 例(%)]表示,采用χ2检验;计量资料经S-W 检验符合正态分布,以(±s)表示,组间比较采用独立t检验,组内治疗前后比较采用配对t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较观察组患者客观缓解率高于对照组,差异有统计学意义(P<0.05),见表1。
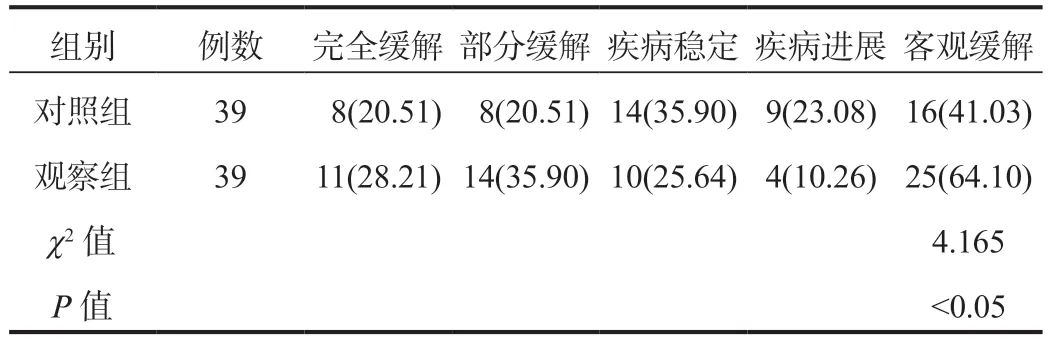
表1 两组患者临床疗效比较[ 例(%)]
2.2 两组患者肿瘤标志物比较治疗后两组患者血清癌胚抗原、糖类抗原125、糖类抗原153 水平均较治疗前降低,且观察组降低幅度更大,差异均有统计学意义(均P<0.05),见表2。
表2 两组患者肿瘤标志物比较(±s)
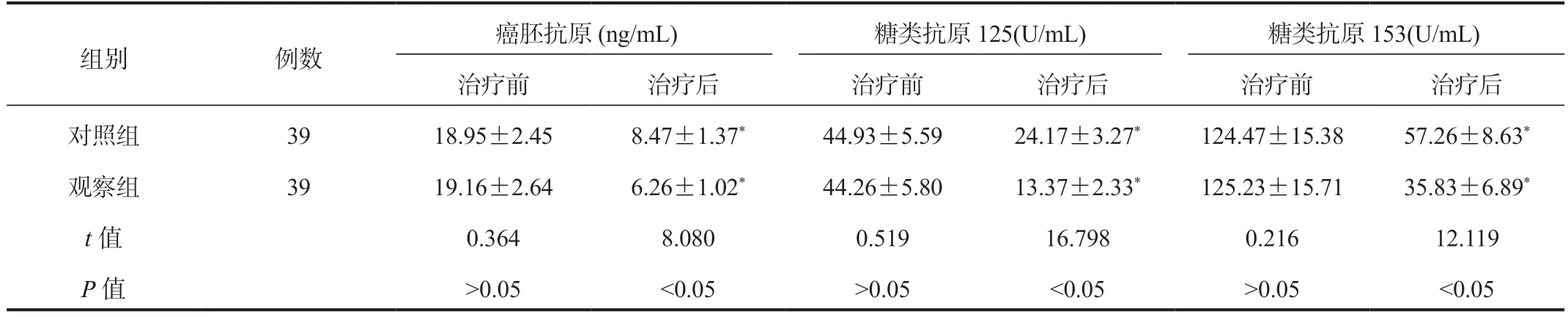
表2 两组患者肿瘤标志物比较(±s)
注:与治疗前比,*P<0.05。
组别 例数癌胚抗原(ng/mL) 糖类抗原125(U/mL) 糖类抗原153(U/mL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 39 18.95±2.45 8.47±1.37* 44.93±5.59 24.17±3.27* 124.47±15.38 57.26±8.63*观察组 39 19.16±2.64 6.26±1.02* 44.26±5.80 13.37±2.33* 125.23±15.71 35.83±6.89*t 值 0.364 8.080 0.519 16.798 0.216 12.119 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.3 两组患者血管内皮生长因子比较治疗后两组患者血清血管内皮生长因子A、血管内皮生长因子B、血管内皮生长因子C 水平均较治疗前降低,且观察组降低幅度更大,差异均有统计学意义(均P<0.05),见表3。
表3 两组患者血管内皮生长因子比较(µg/L,±s)
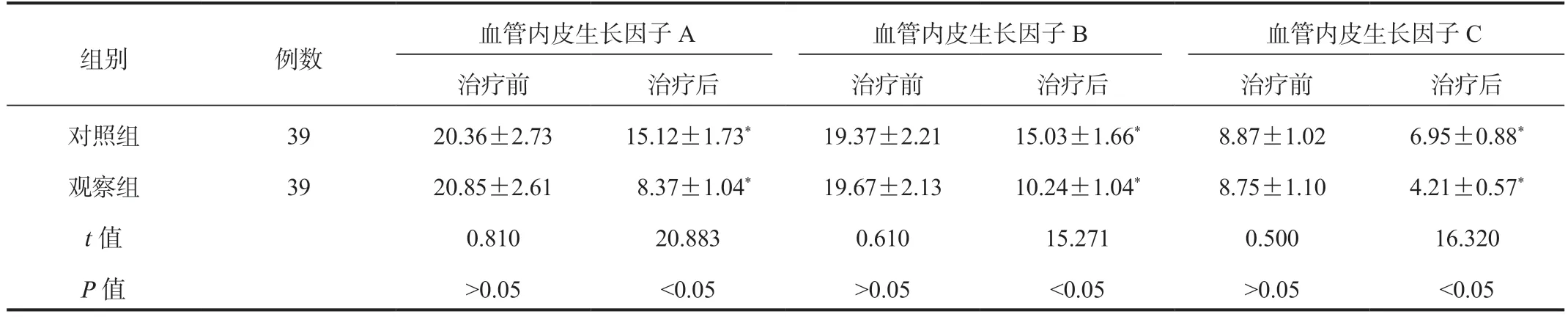
表3 两组患者血管内皮生长因子比较(µg/L,±s)
注:与治疗前比,*P<0.05。
组别 例数血管内皮生长因子A 血管内皮生长因子B 血管内皮生长因子C治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 39 20.36±2.73 15.12±1.73* 19.37±2.21 15.03±1.66* 8.87±1.02 6.95±0.88*观察组 39 20.85±2.61 8.37±1.04* 19.67±2.13 10.24±1.04* 8.75±1.10 4.21±0.57*t 值 0.810 20.883 0.610 15.271 0.500 16.320 P 值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05
2.4 两组患者诱骗受体3、环氧化酶-2 指标比较治疗后两组患者血清诱骗受体3、环氧化酶-2 水平均较治疗前降低,且观察组降低幅度更大,差异均有统计学意义(均P<0.05),见表4。
表4 两组患者诱骗受体3、环氧化酶-2 指标比较(mmol/L,±s)
注:与治疗前比,*P<0.05。
组别 例数诱骗受体3 环氧化酶-2治疗前 治疗后 治疗前 治疗后对照组 39 114.74±12.63 90.84±10.62*116.58±12.64 96.63±9.37*观察组 39 115.41±12.34 53.46±6.60* 116.26±12.38 75.27±7.42*t 值 0.237 18.669 0.113 11.161 P 值 >0.05 <0.05 >0.05 <0.05
3 讨论
目前乳腺癌已成为威胁女性健康的主要疾病,乳腺癌患者多为无意中发现的乳房肿块,通常肿块无疼痛感,由于其并未对身体造成直接不适,患者容易忽视,而耽误最佳治疗时机。乳腺癌的发病原因尚不明确,有研究表明,乳腺癌的发病与遗传有关,有部分乳腺癌患者因HER-2 的过度表达,生物学行为恶性度较高、预后较差,导致患者生存周期短,且术后标准化疗治疗效果不理想,容易出现耐药性,肿瘤转移率与复发率均较高[6]。因此,为改善乳腺癌患者预后,延长患者生命周期,探寻更为科学有效的治疗方式极为重要。
术前新辅助化疗能够使肿瘤体积缩小,有利于提高手术的完全切除率,且可以增强患者的化学治疗耐受性,提高抗肿瘤效果,改善患者预后[7]。但术前新辅助化疗治疗也存在一定的弊端,如术前经过化疗缩小病灶,会影响临床医生对患者病理分期的判断,在一定程度上影响了患者后续治疗方案的制定;同时对于部分化疗不敏感的患者,易延误最佳的治疗时机,影响预后。近年来,随着癌症靶向治疗研究的不断深入,曲妥珠单抗在乳腺癌的治疗中应用广泛,其是特异性靶向HER-2 的抗体,主要通过与HER-2受体结合,抑制细胞信号传递,使HER-2 受体表达量下降,抑制癌细胞生长[8-9]。本研究中,治疗后观察组患者客观缓解率高于对照组,表明曲妥珠单抗联合术前新辅助化疗临床效果好。曲妥珠单抗具有较高的化学敏感性与反应性,联合术前新辅助化疗具有协同作用,能够进一步提升临床治疗效果,降低疾病复发率与转移率,从而能够延长患者生命周期并改善患者预后[10-11]。
肿瘤标志物是临床对于恶性肿瘤诊断、分类及辅助判定预后效果的一系列血清检测指标,当恶性肿瘤形成和细胞异常增殖时会大量产生并释放入血,能够反映肿瘤的存在和性质。癌胚抗原是肿瘤临床诊断中的常见指标;糖类抗原125 是妇科恶性肿瘤的肿瘤标志物之一,具有较高的灵敏性;糖类抗原153 是乳腺癌的一个特异性标志物,主要由分泌性上皮细胞分泌,主要是乳腺细胞、胃肠道细胞等,乳腺癌患者的血清糖类抗原153 含量会明显升高[12]。本研究中,治疗后两组患者血清癌胚抗原、糖类抗原125、糖类抗原153 水平均较治疗前降低,且观察组低于对照组,提示曲妥珠单抗联合术前新辅助化疗可有效抑制肿瘤细胞恶性增殖。术前新辅助治疗能够抑制乳腺癌患者散播亚临床病灶,提升整体抗癌效果,有利于促进乳腺癌患者病情转归。曲妥珠单抗是一种人源化单克隆抗体,可选择性作用于HER-2 细胞外部位,阻滞癌细胞生长,且曲妥珠单抗在抑制HER-2 表达、杀灭机体肿瘤细胞的同时,对正常细胞损伤较小[13]。
肿瘤的发生、恶性增殖均与肿瘤血管生成有着紧密关联,血管内皮生长因子是机体重要的促血管生成因子,又被称为血管通透因子,可诱导血管新生,增加肿瘤血管的通透性,导致肿瘤细胞增殖、迁移。本研究中,与治疗前比,治疗后两组患者血清血管内皮生长因子A、血管内皮生长因子B、血管内皮生长因子C 水平均降低,且观察组低于对照组,提示曲妥珠单抗联合术前新辅助化疗有利于抑制肿瘤血管新生。曲妥珠单抗能够通过特异性的结合HER-2 受体,抑制、阻断血管内皮生长因子在HER-2 上附着,从而有效抑制癌细胞生长、增殖[14]。此外,乳腺组织凋亡分子的异常表达与肿瘤的进展有关,诱骗受体3是肿瘤坏死因子受体之一,能够与相关配体的竞争性结合,在恶性肿瘤细胞增殖、凋亡中发挥着重要作用;环氧化酶-2 属于前列腺素合成限速酶,多在炎症、细胞恶性增殖等病理状态下呈高表达,正常生理状态下极少表达或不表达[15]。本研究中,治疗后两组患者血清诱骗受体3、环氧化酶-2 水平均较治疗前降低,且观察组低于对照组,提示曲妥珠单抗联合术前新辅助化疗有利于肿瘤细胞的快速凋亡。曲妥珠单抗联合术前新辅助化疗通过抑制机体内细胞血管新生活性,加速肿瘤细胞凋亡,能够显著提升杀灭机体肿瘤细胞能力,且曲妥珠单抗抑制肿瘤细胞向恶性表型转导的同时还能够改善患者免疫功能,有效杀灭机体肿瘤细胞[16-17]。
综上,曲妥珠单抗联合术前新辅助化疗乳腺癌能够提高患者临床疗效,降低机体肿瘤标志物水平,抑制肿瘤细胞增殖,促进肿瘤细胞凋亡,值得临床推广应用。但是本研究也尚有不足,后续需要延长随访时间,纳入更多乳腺癌患者,并重点关注治疗期间的药物不良反应,以进一步确认联合应用曲妥珠单抗在乳腺癌患者临床治疗中的确切效果和安全性。
