基于微流控纸芯片-显色法快速测定全血中尿酸的含量
2023-10-22仵静雯郑志鸿彭佳一刘春叶
张 剑 ,仵静雯 ,郑 伟 ,郑志鸿 ,彭佳一 ,陈 琳 ,张 博,刘春叶*
(1.西安医学院 药学院,西安 710021;2.西安医学院 药物研究所,西安 710021)
微流控纸分析装置(μPADs)是近几年发展起来的一种基于纸张的微流控器件,具有成本低廉、操作简单、来源丰富、可再生、可多元检测等优点,在食品安全检测、环境监测、疾病诊断等方面得到广泛应用[1-5]。在疾病诊断方面,以微流控纸芯片为检测平台的显色法对疾病危险因子(如血糖、尿酸、半胱氨酸等)进行检测,受到广泛关注[6-10]。然而,具有高诊断潜力的血液样本在微流控纸芯片上进行显色检测时,会受到血液红细胞的干扰,限制了其对全血样本的分析及在即时检测(PoCT)中的应用。而常用的血样处理方法如高速离心、滤膜分离等[11],需要较高水平的过滤专业知识或复杂的附加设备,与μPADs便携化及PoCT 需求相悖。因此,本工作采用自行设计的微流控纸芯片,提出了一种用于快速测定微量全血样品中尿酸含量的方法。
1 试验部分
1.1 仪器与试剂
Color Qube 8570型喷蜡打印机;G311 型磁性半自动热压机;P30型智能手机;Whatman Grade 1色谱纸。
FeCl3和邻二氮菲的混合溶液:分别以水和95%(体积分数)乙醇溶液为溶剂,配制0.010 0 g·mL—1的FeCl3溶液和邻二氮菲溶液,将两种溶液按照体积比1∶2进行混合,即得。
尿酸标准品,纯度不小于99.0%;壳聚糖,脱乙酰度不小于95%;试验用水为蒸馏水;全血样品由志愿者提供。
1.2 试验方法
1.2.1 微流控纸芯片检测平台的制备
采用inkscape-0.91绘图软件,设计出微流控纸芯片的微通道网格(图1)。使用喷蜡打印机,在色谱纸上打印设计好的纸芯片文档,再将其置于热压机上,于176 ℃加热2 min,得到微流控纸芯片。其中,I区(样品预处理区)和II区(显色区)均为直径5 mm 的圆形,液体流动通道长9 mm,宽1 mm。在I区滴加3.2μL 0.10 g·mL—1乙二胺四乙酸(EDTA)溶液,干燥;再滴加4.8μL 0.015 g·mL—1壳聚糖溶液,干燥,得到微流控纸芯片检测平台。
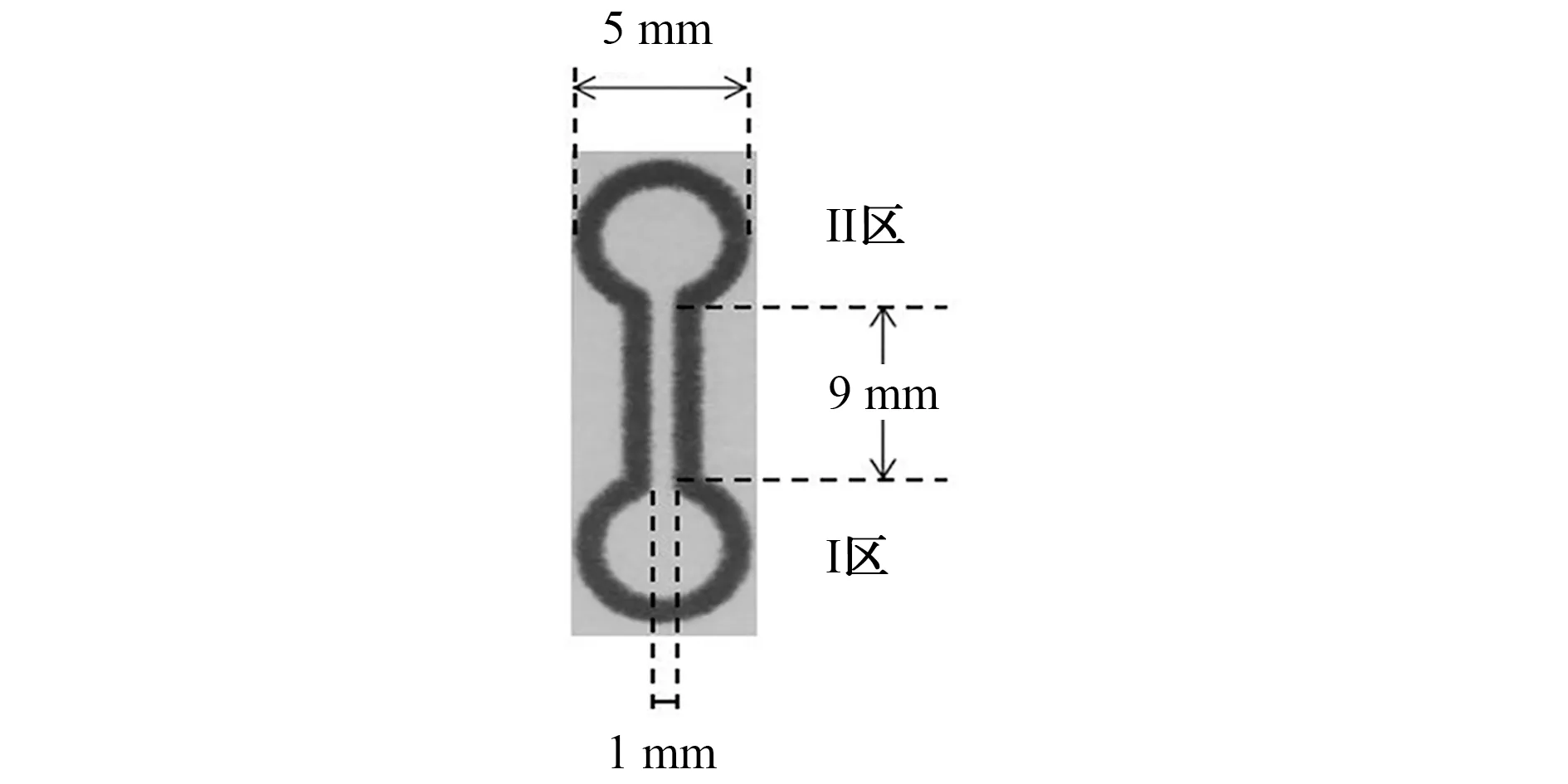
图1 微通道网格设计Fig.1 Design of the microchannel grid
1.2.2 样品测定
将13μL 全血样品与磷酸盐缓冲液(PBS,pH 7.4)的混合溶液(体积比为1∶4)滴加至I区,血浆在纸张的毛细作用下流动至II区;待血浆完全铺满II区后,在II区滴加3μL FeCl3和邻二氮菲的混合溶液,静置反应2 min后,用手机拍照,采用Photoshop CS2软件分析照片中II区的颜色强度,得到RGB值(红、绿、蓝三色叠加值),根据标准曲线计算尿酸的含量。
1.3 试验原理
根据文献[12-14]可知,壳聚糖含有活性氨基和羟基,能黏附红细胞,在EDTA 和壳聚糖的凝集作用下,可在线完成红细胞和血浆的分离;利用尿酸的还原性与FeCl3构成氧化还原体系,以邻二氮菲为显色剂对Fe2+产物进行显色,根据显色区的RGB值与尿酸含量之间的线性关系进行定量分析。
2 结果与讨论
2.1 微流控纸芯片检测平台制备条件和样品测定条件的优化
2.1.1 全血样品与PBS体积比
取3.2μL 0.02 g·mL—1EDTA 溶液和4.8μL 0.01 g·mL—1壳聚糖溶液,按1.2.1节试验方法制备微流控纸芯片检测平台。取全血样品7,5,4,3,3,2μL,分别加入7,10,12,12,15,12μL PBS;分取上述混合溶液各13μL,按照1.2.2节试验方法进行测定,考察了全血样品与PBS体积比分别为1∶1,1∶2,1∶3,1∶4,1∶5,1∶6时对分离效果的影响,结果见图2。
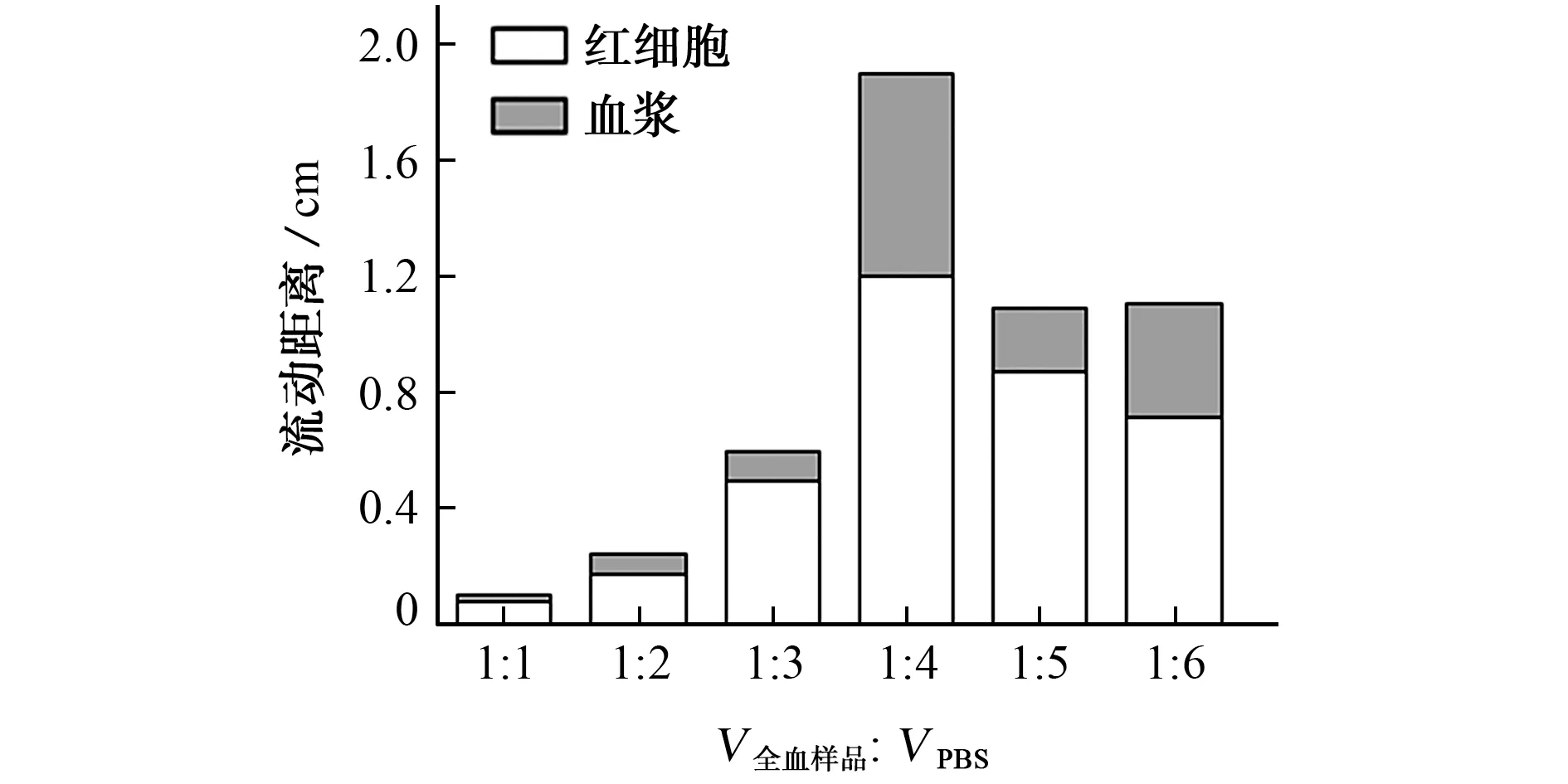
图2 全血样品与PBS体积比对分离效果的影响Fig.2 Effect of the volume ratio of whole blood sample to PBS on the separation
结果表明:当全血样品与PBS 体积比为1∶4时,血浆的流动距离最大,可流动至II区,但红细胞未被完全聚沉,部分红细胞也进入II区,可能对显色反应产生影响。因此,试验选择全血样品与PBS体积比为1∶4,并进一步对EDTA 溶液质量浓度进行优化。
2.1.2 EDTA 溶液质量浓度的选择
固定4.8μL 0.01 g·mL—1壳聚糖溶液,在3.2μL EDTA 溶液质量浓度分别为0.02,0.04,0.06,0.08,0.10,0.12 g·mL—1条件下制备不同的微流控纸芯片检测平台,考察了EDTA 溶液质量浓度对分离效果的影响,结果见图3。
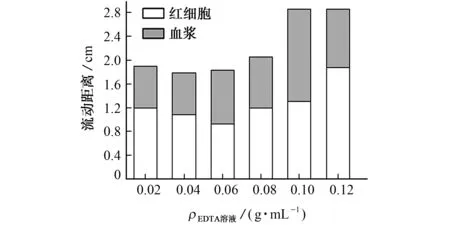
图3 EDTA 溶液质量浓度对分离效果的影响Fig.3 Effect of the mass concentration of EDTA solution on the separation
结果表明:当EDTA 溶液质量浓度为0.10 g·mL—1时,血浆流动距离最大,可铺满II区,但此时依然有部分红细胞进入II 区。因此,试验选择EDTA溶液质量浓度为0.10 g·mL—1,并进一步对壳聚糖溶液质量浓度进行优化。
2.1.3 壳聚糖溶液质量浓度的选择
固定3.2μL 0.10 g·mL—1EDTA 溶液,在4.8μL壳聚糖溶液质量浓度分别为0.010,0.015,0.020,0.025,0.030 g·mL—1条件下制备不同的微流控纸芯片检测平台,进一步考察了壳聚糖溶液质量浓度对分离效果的影响,结果见图4(插图为全血样品的实际分离照片,从左到右壳聚糖溶液质量浓度依次为0.010,0.015,0.020,0.025,0.030 g·mL—1)。
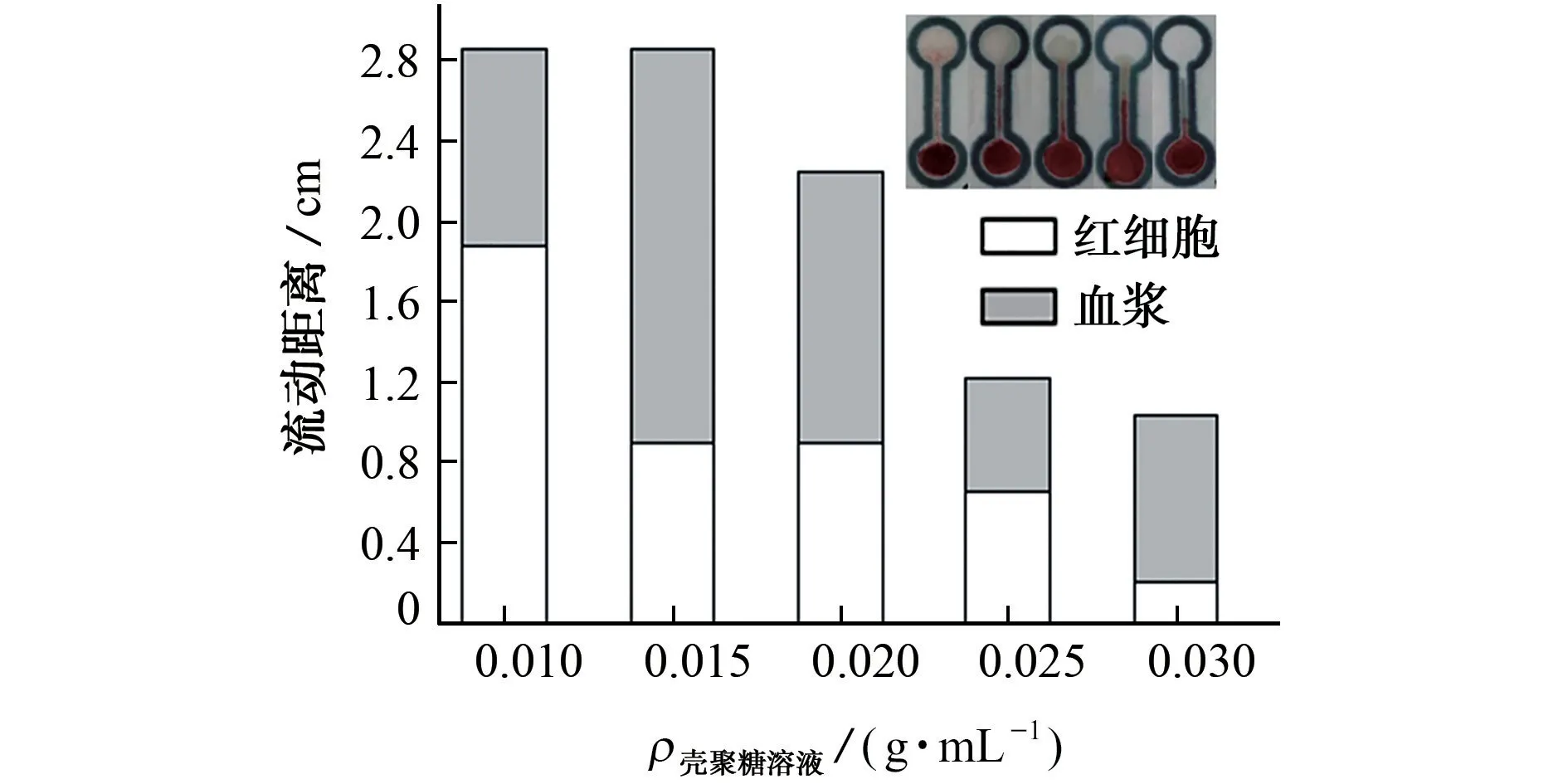
图4 壳聚糖溶液质量浓度对分离效果的影响Fig.4 Effect of the mass concentration of chirosan solution on the separation
由图4 可知:当壳聚糖溶液质量浓度为0.015 g·mL—1时,血浆流动距离最大,可铺满II区,且红细胞被完全固定在I区,分离效果较好。
综上分析,使用3.2μL 0.10 g·mL—1EDTA溶液和4.8μL 0.015 g·mL—1壳聚糖溶液所制备的微流控纸芯片检测平台对13μL 全血样品与PBS混合溶液(体积比为1∶4)的预处理效果较好。
2.2 干扰试验
试验利用尿酸的还原性与FeCl3构成氧化还原体系,以邻二氮菲为显色剂对Fe2+产物进行显色和测定,故血液中共存的还原性物质可能会对尿酸的测定结果产生干扰。将0.55 mmol·L—1尿酸标准溶液分别与相同浓度的L-半胱氨酸、谷胱甘肽、葡萄糖和维生素C等常见还原性共存物质进行混合,按照1.2.2节试验方法在微流控纸芯片检测平台上进行显色反应。结果表明:尿酸测定值的相对误差均小于1.0%,说明上述还原性共存物质均不影响尿酸含量的测定,本方法选择性较好,抗干扰能力较强。
2.3 标准曲线和检出限
在前期研究的基础上[15],用水将6.07 mmol·L—1尿酸储备溶液分别稀释成0.05,0.25,0.45,0.65,0.85 mmol·L—1标准溶液系列,按照1.2.2节试验方法在微流控纸芯片检测平台上进行显色反应。以尿酸浓度为横坐标,对应的RGB 值为纵坐标绘制标准曲线。结果表明:标准曲线的线性范围为0.05~0.85 mmol·L—1,线性回归方程为y=31.13x+116.4,相关系数为0.999 4。
以3.3s/k(其中s为空白溶液的标准偏差,k为斜率)计算检出检,结果为0.03 mmol·L—1。
2.4 方法比对与回收试验
按照试验方法对50份全血样品中尿酸含量进行测定,并与某医院检验科的测定结果(双酶检测体系,血清样品[16])进行比较。结果显示:当显著性水平α为0.05时,P值为0.29,大于临界值0.05;F值为1.14,小于临界值4.04,表明该方法所测结果与医院检测结果无显著性差异。
对其中一个样品进行加标回收试验,结果见表1。
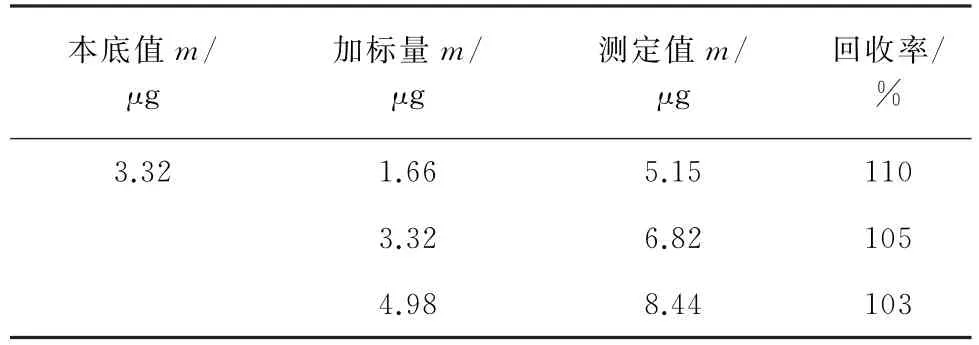
表1 回收试验结果Tab.1 Results of test for recovery
本工作基于微流控纸芯片,建立了一种能够对微量全血样品进行预处理的方法,并将其用于尿酸含量的快速测定。该方法不需要滤膜或高速离心设备,为全血样品的处理和疾病标记物的快速检测提供了方法参考,推动了以微流控纸芯片为检测平台的PoCT 研发。
