外泌体装载蛇床子素的方法探究
2023-10-22李明莉胡冬生杨秀竹王西墨鲍会静
李明莉,胡冬生,杨秀竹,王西墨,鲍会静
(天津医科大学南开医院精准医学实验室,天津 300100)
卵巢癌是妇科常见的恶性肿瘤之一,主要的治疗手段是手术联合化疗,一线化疗药物是紫杉醇联合卡铂,但目前越来越多的患者出现卡铂耐药,且化疗药物的无差别损伤,使胃肠道反应、肾脏损害、过敏反应等不良反应[1 - 2]严重影响了患者的生存质量,常常导致患者预后不良。蛇床子素是中药蛇床子的主要活性成分,现代医学研究发现其具有抗肿瘤的作用,可明显抑制卵巢癌细胞的增殖,并可通过多种途径逆转肿瘤多药耐药[3],故可作为治疗卵巢癌的药物补充。但由于其生物利用度低、溶解度低[4]等特点,限制了其临床应用。外泌体是直径100 nm左右具有脂质双分子层膜结构的细胞囊泡,参与机体生理病理过程,作为细胞间通讯参与细胞间信号转导,可在各种体液如汗液、泪液、乳汁中分离得到[5]。外泌体不仅可以增加药物的生物利用度和溶解度,也可以增加药物在肿瘤部位的浓度,还因其低免疫原性和良好的生物相容性作为药物载体备受关注[6]。因此,本研究拟探索外泌体装载蛇床子素的载药方法,为蛇床子素在卵巢癌治疗中的应用提供方法支撑。
1 材料与方法
1.1 材料
1.1.1细胞株和培养 293T细胞来自天津中西医结合急腹症研究所实验室,SKOV3细胞购自ATCC。293T细胞用含10% 胎牛血清、1%青链霉素的DMEM培养基,SKOV3细胞用含10% 胎牛血清、1%青链霉素的RPMI 1640培养基,在5% CO2、37 ℃细胞培养箱中培养,0.25%胰酶消化传代。
1.1.2主要仪器 透射电子显微镜(transmission electron microscope,TEM)(日本日立,HT7700);纳米颗粒跟踪分析仪(nanoparticle tracking analysis,NTA)(英国Malvern,Nanosight300);CO2培养箱(日本三洋电机株式会社,MCO-15AC);台式低温离心机(日本Kubota公司,K21126-F000);恒温振荡水槽(上海精宏实验设备有限公司,DKZ-2);高效液相色谱仪(美国安捷伦LC1100);高效液相色谱柱(北京迪马欧泰科技发展中心,Diamonsil 5 μm C8,150 × 4.6 mm,XDB-C8);酶标仪(上海科华生物工程股份有限公司,Khb ST-360);流式细胞仪(美国安捷伦NovoCyte D2060R)。
1.1.3主要试剂 蛇床子素(上海阿拉丁,O101699);外泌体提取试剂(美国InvitroGen,4478359);CD63分离/检测试剂(美国InvitroGen,10606D);PE-anti-CD9 antibody(美国Abcam,ab82394);DMEM培养基(美国Gibco,C11995500BT);RPMI 1640培养基(美国Gibco,C11875500BT);胎牛血清(上海Vivacell,C04001050);青霉素-链霉素双抗(北京Solarbio,P1400-100);0.25% Tripisin-EDTA(1 ×)(北京Solarbio,T1320-100);DMSO(北京Solarbio,D8371);RIPA裂解液(天津中实基因科技,ZS-PR21001S);乙腈(上海吉至生化,A27981);BCA(北京天根生化科技,PA115-01);Slide-A-LyzerTMDialysis Cassette(美国Thermo Fisher,66380);PBS缓冲液(北京Biosharp,BL302A)。
1.2 方法
1.2.1蛇床子素对SKOV3的增殖作用 培养SKOV3细胞,待其在细胞培养瓶中生长至80%~90%时进行铺板,96孔板,每孔5 000个细胞;次日取出细胞培养板,加入药物,分为PBS、DMSO、蛇床子素组(80 μmol·L-1),每组重复6孔;培养48 h后取出细胞培养板,向每孔加入10 μL CCK溶液,然后放回细胞培养箱,继续培养2 h;取出细胞培养板,用酶标仪检测在450 nm处的吸光度。
1.2.2外泌体的提取 293T细胞常规培养,待细胞密度生长至80%~90%时,换为DMEM培养3天[7],然后收集上层培养基,根据试剂盒说明书提取外泌体,即先在4 ℃下,以2 000×g转速离心去掉细胞碎片,收集上清,加入1/2体积的提取试剂,充分混匀后,4 ℃孵育过夜,再进行离心(10 000×g,4 ℃,1 h),弃去上清,用100 μL PBS重悬外泌体,用BCA测定其浓度。
1.2.3外泌体的鉴定 取30 μL外泌体溶液,用TEM观察外泌体的形态。将外泌体稀释到1 mL,用NTA测定其粒径。
1.2.4蛇床子素外泌体制备 称取10 mg蛇床子素溶解于255.8 μL DMSO溶液中配成浓度为160 mmol·L-1的储存液,取30 μL(1 172.6 μg)蛇床子素与100 μL(45.9 μg)外泌体混匀,在37 ℃的水浴锅中轻晃避光孵育2 h或4 h,孵育结束后将混悬液用注射器小心注入透析卡中,用浮漂固定,悬浮于2 L PBS溶液中,然后置于4 ℃冰箱中透析过夜,以去除游离的蛇床子素,次日取出,放入4 ℃冰箱待用。
1.2.5载药效率测定
1.2.5.1 标准品制备 将蛇床子素(160 mmol·L-1)用PBS稀释至0.004、0.008、0.016、0.031、0.063 g·L-1。
1.2.5.2 样品准备 将提取的蛇床子素外泌体(osthole-Exo)离心(7 000 r·min-1,4 ℃,5 min),收集上清,分组为2OST-Exo、2OST-Exo-RIPA、4OST-Exo、4OST-Exo-RIPA,其中带有RIPA的组处理:加入等体积的RIPA裂解液,在冰上静置30 min后离心(13 000 r·min-1,4 ℃,5 min),取上清。
1.2.5.3 色谱条件 C8色谱柱,乙腈 ∶水=70% ∶30%,30 ℃柱温,在303 nm处检测,进样量10 μL,停止时间10 min。
1.2.5.4 根据峰面积及标准曲线线性关系计算载药量,按文献计算载药效率[4]:

注:W1表示外泌体装载的药物质量,W2表示载药时加入的药物质量。
1.2.6流式细胞术测定外泌体 蛇床子素外泌体与CD63磁珠孵育过夜,再与PE-CD9抗体孵育1 h,用PBS清洗后,上流式细胞仪分析。

2 结果
2.1 蛇床子素对SKOV3细胞的增殖作用现代治疗卵巢癌的化疗药物存在较多不良反应,且多发生耐药,而中药在减毒增效方面具有显著优势[8],拟选某中药治疗卵巢癌。查阅相关文献[9],确定中药单体蛇床子素能够抑制SKOV3细胞的生长,为了验证这一结果,进行了CCK-8实验,即用80 μmol·L-1蛇床子素处理SKOV3细胞,发现蛇床子素能明显的抑制SKOV3细胞的增殖,见Fig 1。

Fig 1 Proliferation of SKOV3 cells
2.2 外泌体的鉴定如Fig 2、Tab 1所示,外泌体直径100 nm左右,呈典型的杯状,可见膜型结构。NTA结果分析显示纳米颗粒粒径主要集中在104 nm,粒径为0~200 nm的占比为81%,平均粒径(158.4±77.9) nm,有的粒径稍大,可能是颗粒之间的黏附黏连造成的。以上结果表明从293T细胞上清所提取的颗粒是外泌体。

Fig 2 Morphological observation of exosomes and size distribution analysis

Tab 1 Particle size distribution statistics of exosomes
2.3 载药效率测定
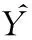
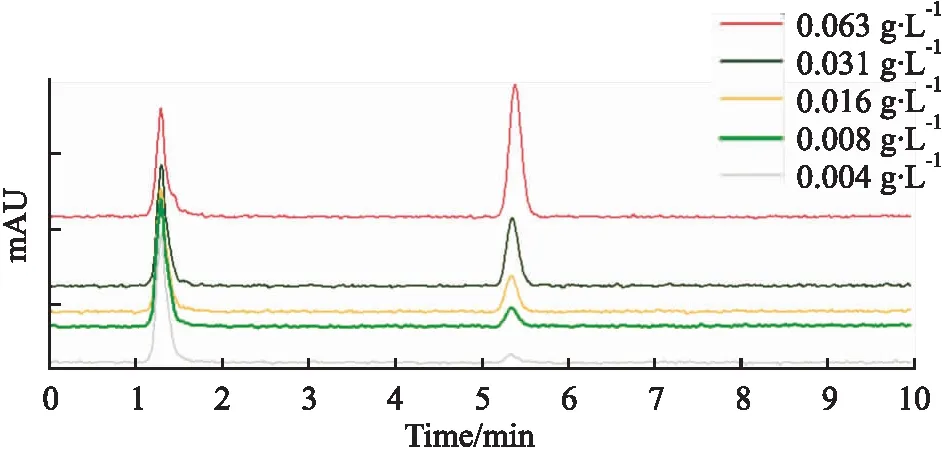
Fig 3 Chromatographic peaks of osthole at different concentrations

Tab 2 Chromatographic peak areas of osthole at different concentrations
2.3.2确定载药条件 外泌体与蛇床子素共孵育2 h或4 h,经高效液相色谱仪测得峰面积分别为68.50和16.23,计算出载药效率分别为0.76%和0.12%,2 h的载药效率明显高于4 h,故选择共孵育2 h作为载药条件,见Fig 4、Tab 3。

Tab 3 Drug loading efficiency at different times
2.3.3外泌体装载蛇床子素的途径 对蛇床子素外泌体(osthole-Exo)进行流式分析,CD9是外泌体的表面标志蛋白,osthole-Exo中CD9阳性表达,即所提取的osthole-Exo中存在外泌体,见Fig 5A。将osthole-Exo用裂解剂RIPA裂解后,进行HPLC分析,可以发现裂解后的蛇床子素量分别从8.85 μg、1.43 μg增加到21.60 μg和7.80 μg,见Fig 5B、Tab 4。
3 讨论
卵巢癌是女性常见的恶性肿瘤之一,手术联合化疗是目前的主要治疗手段,但化疗药物的不良反应使患者的生存质量降低。中药作为传统医药,有着减轻不良反应、逆转耐药等优势,蛇床子素是中药蛇床子的有效成分,现代医学研究其具有抑制卵巢癌细胞增殖的作用[10],因此蛇床子素可能成为治疗卵巢癌的新策略。但蛇床子素的口服生物利用度和溶解度低[4],限制了它的应用,外泌体装载药物能提高药物的溶解度和口服生物利用度[6],所以本研究利用外泌体运输蛇床子素,使蛇床子素能够充分发挥抑制肿瘤的作用。

Tab 4 Osthole loading mass after exosome lysis
HEK293T(293T)细胞系是HEK293的衍生细胞株,表达SV40大T抗原,能够表达高滴度的病毒基因载体,常用于逆转录病毒载体的生产[11]。研究报道,由293T产生的细胞外囊泡诱导的免疫反应和毒性,给C57BL/6小鼠静脉注射和腹腔注射细胞外囊泡3周,采集血液以评估血液学、血液化学和免疫标志物,收集组织进行尸检和组织病理学检查,没有观察到毒性的迹象,即293T来源的细胞外囊泡具有免疫惰性,不会在体内引发炎症反应[12],所以我们选择293T细胞来源的外泌体。
目前的载药方式分为分泌前载药和分泌后载药。分泌前载药主要由基因编辑和药物与产外泌体细胞共孵育后收集药物外泌体,分泌后载药应用较多是共孵育、超声和电穿孔,其他分泌后载药应用较少地是挤压、冻融循环和皂素渗透等[13]。分泌前的共孵育载药效率不易控制,且药物对细胞的影响未知,细胞的正常生理功能可能遭到破外,外泌体的正常分泌是否受到影响尚不明确。
超声的载药效率较高,可持续释放药物,但这种方法可能导致外泌体聚集,影响外泌体的免疫活性,另外还可能会破坏外泌体的质膜结构,造成药物漏出,导致载药量不理想[14]。电穿孔是利用电场的电脉冲对外泌体进行作用,在短的高压脉冲下可以导致膜击穿,会产生暂时的孔隙,药物分子会借此孔流入到外泌体中。但外泌体的浓度影响电穿孔的效率,发现外泌体浓度最低在0.25 g·L-1,最高在1 g·L-1时,电穿孔的载药效率最高,而这种方法也存在许多缺点,比如加载速率低、膜结构完整性破坏、外泌体活性受到影响等,进而限制了它的应用[15]。共孵育是最直接且简单的装载方法,通过药物与外泌体膜脂质层相互作用得以装载,效率取决于药物的疏水性[16],因其具备保持外泌体结构完整性的优点而被广泛应用。有研究用RAW264.7细胞分泌的外泌体与抗生素在37 ℃下共孵育,构建了抗生素外泌体,提供了一种有效、经济、安全的替代方案[17],所以本研究选择共孵育的方式进行载药。

Fig 4 Drug-loaded and dialysate chromatographic peaks of exosomes at 2 or 4 h (n=3)

Fig 5 Pathway of osthole loading by exosomes
外泌体的载药效率和外泌体与药物的比例有一定相关性。据报道[18],随着外泌体与药物比例的增加,载药效率会逐步升高,但升高到一定程度后,载药效率并不会继续上升反而下降。同我们的前期研究一致,20 μg阿霉素与不同质量(0、50、100、200、400、800、1 600 μg)的外泌体在37 ℃共孵育2 h,发现在400 μg时的载药效率最高。本研究缺乏蛇床子素与外泌体的比例变化对载药效率的影响,将在后续实验过程中继续探索。
外泌体与蛇床子素共孵育后,经HPLC测量发现存在蛇床子素,且经流式分析观察到外泌体标志蛋白CD9阳性表达,说明存在外泌体,即获得的样品确定是osthole-Exo。另外,经RIPA裂解后,蛇床子素的装载量有了明显增加,说明外泌体运输蛇床子素不仅通过黏附的方式,还有部分蛇床子素通过直接进入外泌体膜内的方式完成运载。
综上所述,本研究成功提取了外泌体,构建了osthole-Exo的载药体系,为蛇床子素的应用提供了研究基础。
