基于网络药理学从线粒体自噬途径探讨八味沉香散抗缺血性心脏病的作用机制
2023-10-22岳栋芳李彩霞李永芳
岳栋芳,李彩霞,官 敏,李永芳
(青海大学医学部,青海 西宁 810001)
近年来,我国心血管疾病的发病率和死亡率逐年上升[1],其中缺血性心脏病(ischemic heart disease, IHD)是导致心血管疾病患者死亡的重要原因。线粒体作为心肌能量的供应者,还参与维持细胞内环境稳态、影响心肌细胞的凋亡和坏死,在IHD的发病过程中起关键作用[2]。因此,线粒体对于维护心肌功能和存活具有重要意义,被认为是治疗IHD的潜在靶点。
八味沉香散系藏药复方,具有清心热、宁心神的功效。课题组前期研究发现八味沉香散,可缓解线粒体肿胀,减轻线粒体损伤,改善异丙肾上腺素诱导的心肌缺血模型大鼠的心舒缩功能[3],但其具体机制尚不明确。线粒体自噬是一种选择性自噬途径,可特异性消除受损及功能异常的线粒体,维持线粒体稳态[4]。考虑到八味沉香散多成分多靶点的特性以及疾病本身的复杂性,本研究采用网络药理学方法,从线粒体自噬途径探讨八味沉香散保护线粒体缓解心肌缺血的作用机制。
1 材料与方法
1.1 网络药理学研究材料与方法
1.1.1八味沉香散入血成分靶点查询 课题组前期分别应用UPLC-Q-Exactive Orbitrap MS和GC-MS技术对八味沉香散的水溶性入血组分[5]和挥发性入血组分进行了分析鉴定,得到水溶性入血组分16个,挥发性入血组分26个。在PubChem数据库检索并下载各个入血组分2D结构的*.sdf文件。依次导入SwissTargetPrediction平台,选择物种为“Homo sapiens”进行靶点预测,从结果中筛选出可能性大于0的靶点。同时在TCMSP和DrugBank数据库中进行检索补充。利用UniProt数据库将获得的靶点蛋白名称转化为标准的基因名称。结果合并去重后作为入血成分的候选靶点。
1.1.2线粒体自噬及缺血性心脏病相关靶点获取 分别以“Myocardial ischemia”、“Ischemic heart disease”、“Myocardial infarction”和“Mitochondrial Autophagy”、“Mitophagy”为关键词,在GeneCards数据库、NCBI及OMIM数据库中进行检索,分别合并去重复后得到缺血性心脏病和线粒体自噬相关靶点。将八味沉香散入血成分靶点、线粒体自噬靶点和缺血性心脏病靶点导入Venny 2.1在线平台(https://bioinfogp.cnb.csic.es/tools/venny/)获取交集靶点,绘制韦恩图,作为八味沉香散经线粒体自噬途径治疗缺血性心脏病的潜在靶点。
1.1.3“成分-疾病-靶点”网络和“蛋白质-蛋白质相互作用(PPI)”网络构建分析 将入血成分和交集靶点导入Cytoscape 3.8.2软件,构建“成分-疾病-潜在靶点”网络,进行网络分析,计算Betweenness Centralities(BC)、Closeness Centralities(CC)、Degree Centralities(DC)值,筛选出BC、CC、DC均为前10的成分作为八味沉香散经线粒体自噬途径治疗缺血性心脏病关键活性成分。将交集靶点导入STRING数据库,设置物种为“Homo sapiens”,最低相互作用评分≥0.7,隐藏游离靶点构建PPI网络,保存为*tsv文件后导入Cytoscape 3.8.2软件,利用cytoHubba插件进行网络分析,筛选出BC、CC、DC均为前10的靶点作为八味沉香散通过线粒体自噬途径治疗缺血性心脏病的核心靶点。
1.1.4GO、KEGG富集分析 将交集靶点输入到DAVID数据库,设置物种为“Homo sapiens”分别进行GO和KEGG富集分析,筛选出P<0.01的富集结果,绘制GO富集条图和KEGG富集气泡图。
1.1.5分子对接 在PubChem数据库中查询关键活性成分的3D结构并保存为*.sdf格式,然后利用Pymol软件转化为*.pdb格式。在PDB数据库中下载核心靶点的蛋白3D结构,利用Pymol软件分别对蛋白质进行去溶剂、去除小分子有机物、去除配体等前处理,保存为*.pdb格式。通过AutoDock软件分别对蛋白质、化合物进行加氢原子等处理,同时设置小分子的可旋转键,完成后将处理后的靶蛋白和化合物保存为*.pdbqt格式。根据蛋白质结构大小设置Grid Box参数。运行Vina 1.5.6进行分子对接,模拟靶标和入血分子结合模式,计算结合能,结合能小于0表明可以自由结合。最后通过Pymol软件将靶蛋白和入血成分结合的最优构象结果可视化。
1.2 细胞实验验证材料与方法
1.2.1细胞、动物与药物 H9C2心肌细胞购于武汉普诺塞生命科技有限公司(货号 CL-0089)。SD雄性大鼠(体质量200~250 g)由西安交通大学动物中心提供,本实验已通过青海大学动物伦理委员会批准。八味沉香散购于西藏神猴药业有限公司(批号20210801)。
1.2.2主要试剂与仪器 DMEM培养基,武汉普诺赛生命科技有限公司;0.25%胰蛋白酶-EDTA、双链霉素,北京索莱宝生物科技有限公司;胎牛血清,依科赛生物技术有限公司;CCK-8细胞活性试剂盒,Elabscience公司;PI3K、p-PI3K、AKT、p-AKT、p62单克隆抗体,美国CST公司(货号 4257、17366、4691、4060、23214);LC3B单克隆抗体,美国abCAM公司(货号ab192890);β-actin、HRP标记羊抗兔二抗,武汉博士德生物工程有限公司(货号BA1054、M01263);ECL发光液,默克密理博(中国)有限公司;H100移动式三气培养箱,上海力康公司;Varioskan LUX多功能酶标仪酶标仪,赛默飞世尔科技(中国)有限公司;Bio-Rad垂直电泳仪,美国伯乐公司;AI600images凝胶成像仪,美国通用电气公司。
1.2.3含药血清制备 20只雄性SD大鼠适应性喂养7 d后随机分为空白组、八味沉香散药物组(每日1.0 g·kg-1),每组10只。灌胃给药10 d(空白组给等体积生理盐水),末次给药前禁食12 h,给药30 min后异氟烷吸入麻醉,腹主动脉取血,3 500 r·min-1离心10 min,分离血清。各组血清混合均匀后用0.22 μm滤器除菌后分装,保存于-80 ℃冰箱中备用。
1.2.4细胞干预 H9C2细胞用添加10%胎牛血清、1%青、链霉素的高糖培养基置于37 ℃的恒温培养箱中进行培养。参照课题组前期造模方法[6],取对数生长期的H9C2细胞,分为空白组(完全培养基+20%空白组血清)、模型组(无糖培养基+20%空白组血清)、八味沉香散含药血清组(无糖培养基+20%八味沉香散含药血清)。添加含药血清后先置于常氧培养箱中37 ℃培养1 h,然后将模型组、含药血清组转移至三气培养箱中,设置O2浓度为2%,37 ℃培养8 h;空白组继续置于常氧培养箱中培养8 h。
1.2.5细胞活性检测 取对数生长期的H9C2细胞,胰酶消化后用培养基重悬制备单细胞悬液,调节细胞密度为1×104接种于96孔板,待细胞贴壁后,按1.2.4项下方法进行处理。培养结束后弃去培养液,加入100 μL含10%CCK8的高糖培养基。37 ℃培养1 h,设置酶标仪波长为450 nm处测定OD值。
1.2.6蛋白免疫印迹法测定蛋白表达量 按“1.2.4”项下方法干预细胞后,使用含1%蛋白酶抑制剂、磷酸酶抑制剂2、磷酸酶抑制剂3的RIPA裂解液冰上裂解30 min,离心取上清,收集细胞总蛋白样品。BCA法定量。利用SDS凝胶电泳分离样品并通过湿法转膜转移至PVDF膜上,5%的脱脂奶粉室温封闭1 h,对应一抗4 ℃孵育过夜,洗膜,室温下二抗孵育1 h,洗膜,采用化学发光法显影并拍照保存,ImageJ软件分析蛋白条带发光强度。

2 结果
2.1 八味沉香散入血成分靶点预测及疾病靶点和疾病相关靶点获取八味沉香散入血成分见Tab 1,合并去重得到八味沉香散候选靶点706个。缺血性心脏病相关靶点2 475个,线粒体自噬相关靶点1 042个(检索结果见Tab 2)。导入Venny 2.1绘制venny图(Fig 1),得到132个交集靶点作为八味沉香散经线粒体自噬途径治疗缺血性心脏病的潜在靶点。
Tab 1 Targets of serum constituents of Bawei Chenxiang powder predicted by databases

Tab 2 Search results of ischemic heart disease target, mitophagy target

Fig 1 Venn diagram summarizing common targetsof IHD, mitophagy and BWCX
2.2 “成分-疾病-潜在靶点”网络和PPI网络构建分析将42个八味沉香散入血成分和132个交集靶点导入Cytoscape 3.8.2软件,绘制“成分-疾病-潜在靶点”网络图(Fig 2),利用Network Analyzer功能进行网络分析,得到9个BC、CC、DC均位于前十的化合物,分别是槲皮素(HHW37)、山奈酚(HHW38)、柚皮素(HHW39)、4,8,13-Cyclotetradecatriene-1,3-diol, 1,5,9-(HHW26)、去氢二异丁香酚(HHW40)、秦皮乙素(HHW29)、肉豆蔻醚(HHW20)、9-Hexadecenoic acid(HHW24)、异丁香酚甲醚(HHW18)。
交集靶点的PPI网络(Fig 3)包括126个节点,2 206条边。节点越大颜色越深表示其degree值越大。利用cytoHubba插件进行网络分析,筛选出BC、DC、CC值排名均位于前十的靶点分别是TP53、AKT1、STAT3、MAPK3、EGFR、JUN、MAPK1、CASP3,这些靶点可能是八味沉香散调节线粒体自噬治疗缺血性心脏病的核心靶点。
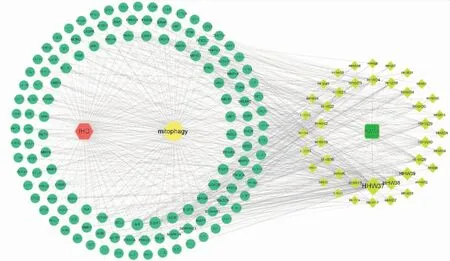
Fig 2 “Ingredients-disease-potential target” network diagram

Fig 3 PPI network diagram of potential targets
2.3 GO富集分析和KEGG富集分析利用DAVID数据库对132个交集靶点进行GO和KEGG富集分析。GO富集结果(P<0.01)显示交集靶点涉及453个生物过程主要包括RNA聚合酶II启动子转录的正调控、凋亡过程调控、蛋白磷酸化等;涉及84种分子功能,主要包括酶结合、相同蛋白结合、蛋白激酶活性等;参与构成49种细胞成分,主要包括细胞质、大分子复合物、细胞核、线粒体等。各个GO富集结果的前十条及参与靶点的个数见Fig 4。
KEGG富集结果(P<0.01)显示,交集靶点参与148条信号通路,前20条如Fig 5所示,其中HIF-1信号通路[7]、EGFR信号通路[8]、PI3K-Akt信号通路[9]、MAPK信号通路[10]、FoxO信号通路[11]都直接参与线粒体自噬的调节。选取其中参与靶点数多且可信度高的PI3K-Akt信号通路进行后续验证。
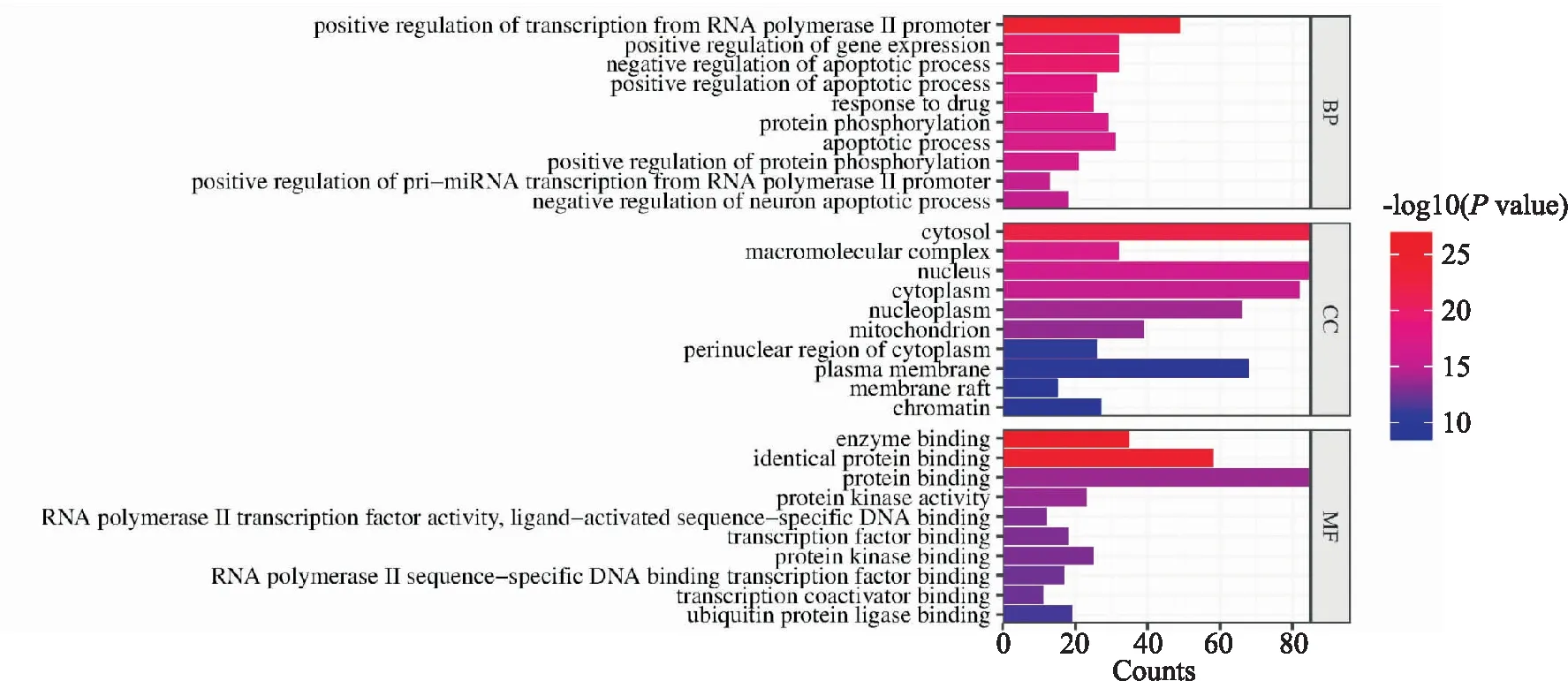
Fig 4 Results of gene function GO enrichment analysis
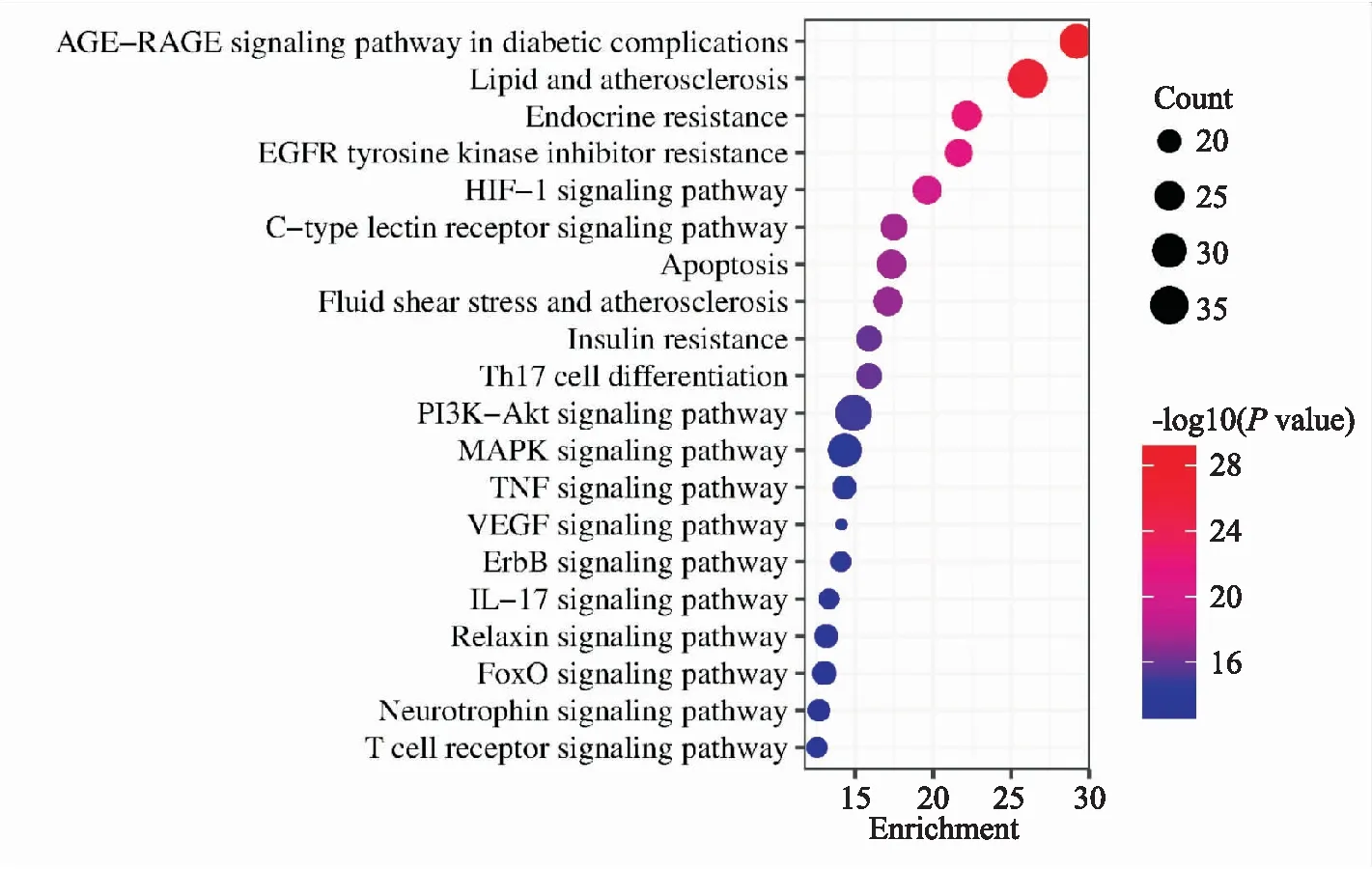
Fig 5 Results of gene KEGG pathway enrichment analysis
2.4 分子对接利用AutoDock Vina软件进行分子对接,对接结果显示核心靶点和关键活性化合物的结合能在-8.7~-4.2 kcal·mol-1之间(Fig 6),说明核心成分和关键靶点均可稳定结合。对各核心靶点与其评分较高的化合物的优势构象进行可视化(Fig 7),发现以上靶点与配体均可通过氢键作用相互结合。
2.5 八味沉香散含药血清对H9C2细胞存活率的影响CCK-8法测定各组细胞存活率,结果如Fig 8所示,与空白组相比,模型组H9C2细胞存活率明显下降(P<0.05);与模型组相比,八味沉香散含药血清药物组H9C2细胞存活率明显提高(P<0.01)。结果表明缺氧会促使H9C2细胞活力明显下降,而八味沉香散含药血清可明显提高缺氧条件下H9C2细胞的存活率。
2.6 八味沉香散含药血清对H9C2细胞中LC3、p62、Akt、p-AKT、PI3K、p-PI3K蛋白表达的影响蛋白免疫印迹法测定H9C2细胞中LC3、p62、Akt、p-AKT、PI3K、p-PI3K蛋白表达,结果如Fig 9所示,与空白组相比,模型组H9C2细胞中p-PI3K/PI3K (P<0.01)和p-AKT/AKT (P<0.05)相对蛋白表达水平明显降低,p62 (P<0.05)和LC3II/LC3I (P<0.01)相对蛋白表达水平明显升高;与模型组相比,八味沉香散含药血清组p62和LC3II/LC3I相对蛋白表达水平明显降低(P<0.01),p-PI3K/PI3K (P<0.01)和p-AKT/AKT (P<0.05)相对蛋白表达水平明显升高。提示八味沉香散通过激活PI3K/AKT信号通路抑制H9C2细胞中缺氧诱导的过度的线粒体自噬。

Fig 6 Heatmap of molecular docking of active components acting on core targets
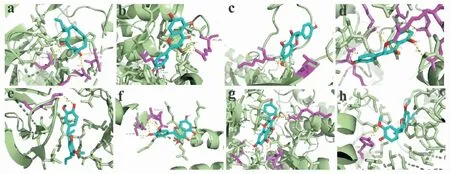
Fig 7 Molecular docking models with high scores of active components acting on core targets
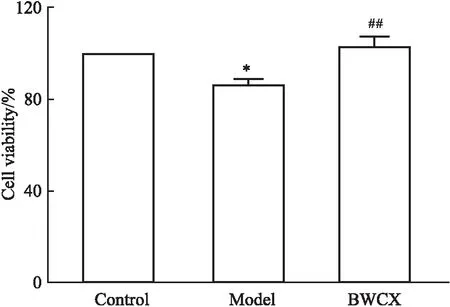
Fig 8 Comparison of H9C2 cell survival rate(n=6)
3 讨论
缺血性心脏病是由冠脉血流量和心肌能量供应不平衡导致的病理状态,线粒体功能障碍是其重要的病理生理基础。应激条件下的线粒体保护和质量控制可以维持线粒体稳态,保持能量平衡来预防线粒体功能障碍的策略已被证明可以改善缺血诱导的心功能障碍。受损或功能失调的线粒体都可以通过线粒体自噬进行降解来消除,这对于维持线粒体稳态,确保能量供应和促进细胞存活至关重要。大量研究表明,线粒体自噬对心脏功能具有“双重”影响,线粒体降解不足和增强都可能影响心肌细胞的存亡[4]。因此,开发能够有效调节线粒体自噬维持线粒体稳态的药物对缺血性心脏病的防治具有重要意义。
本研究基于网络药理学,构建并分析了八味沉香散入血成分通过线粒体自噬途径抗缺血性心脏病的“成分-疾病-潜在靶点”网络,分析得到槲皮素、山奈酚、柚皮素等可能是其主要的物质基础。亦有研究证明槲皮素[12]、山奈酚[13]、柚皮素[14]、去氢二异丁香酚[15]均可通过线粒体途径缓解心肌缺血。构建潜在靶点的“PPI”网络,筛选出八味沉香散经线粒体自噬途径抗缺血性心脏病的关键靶点8个,包括TP53、AKT1、STAT3、MAPK3、EGFR、JUN、MAPK1、CASP3。蛋白激酶B(Akt)是许多保护性信号通路的汇合点,对缺血应激具有很强的心脏保护作用[9]。信号传感器和激活因子3(STAT3)是STAT家族核转录因子的成员,通过Janus激酶(JAKs)的磷酸化被激活。参与保护呼吸链复合物I,优化线粒体呼吸并限制活性氧形成,从而阻止线粒体通透性转换孔(mPTP)开放并确保线粒体完整性[16]。丝裂原活化蛋白激酶(MAPK)1和MAPK3同属MAPK家族,是MAPK/细胞外信号调节蛋白激酶(ERK)信号级联中两个关键因子。MAPK/ERK通路是线粒体裂变的主要上游调节因子,在缺氧早期被激活,诱导早期的线粒体自噬[10]。核转录因子激活蛋白-1(JUN)是MAPK下游的信号因子,参与MAPK介导的细胞凋亡和自噬[17]。表皮生长因子受体(EGFR)可通过独立于其激酶活性的机制抑制哺乳动物雷帕霉素蛋白复合物2(mTORC2)/AKT途径的线粒体自噬[8]。天冬氨酸蛋白酶3(CASP3)主要参与线粒体介导的细胞凋亡[18]。对关键活性成分和核心靶点进行分子对接,发现关键活性成分和核心靶点均能自由结合,特别是槲皮素、柚皮素、山奈酚、去氢二异丁香酚对关键靶点有更强的结合活性,可能在其中发挥重要作用。
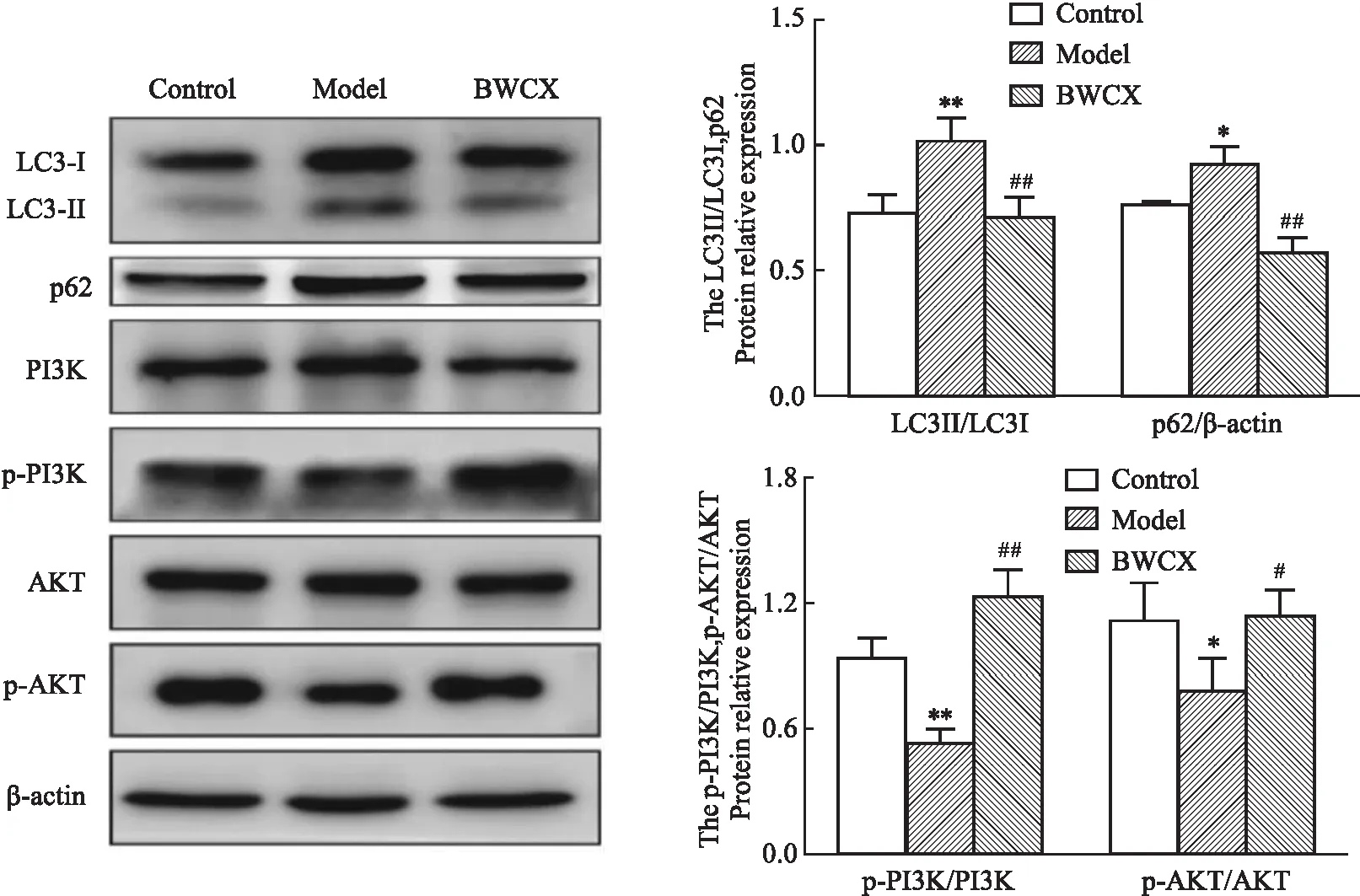
Fig 9 Effect of Bawei Chenxiang powder on protein expression of LC3, p62 and PI3K-AKT signaling pathway in H9C2 cells(n=3)
为探讨八味沉香散经线粒体自噬途径抗缺血性心脏病的具体机制,对潜在靶点进行了KEGG富集分析,结果显示八味沉香散可能通过缺氧诱导因子1(HIF-1)信号通路、EGFR信号通路、PI3K-Akt信号通路、MAPK信号通路、叉头框转录因子O(FoxO)信号通路等多种途径调控线粒体自噬来改善心肌缺血。为进一步探究预测结果的可靠性,选择对参与靶点多且可信度相对较高的PI3K-AKT信号通路进行体外实验验证。通过糖氧剥夺模拟心肌缺血来建立H9C2心肌细胞缺氧模型,八味沉香散含药血清作用于缺氧期间的H9C2细胞可明显改善缺氧期间H9C2心肌细胞的存活率。LC3是自噬的重要参与者,在自噬过程中LC3-I转化为LC3-II向囊泡膜上富集促进自噬体的形成,因此LC3-II/LC3-I的值是反映自噬水平的主要指标。p62为自噬衔蛋白,直接与LC3结合,并通过自噬选择性降解,是另外一种自噬活性标志物。因此我们采用蛋白免疫印迹法测定H9C2细胞中LC3-II/LC3-I和p62相对表达量来评估自噬水平。结果显示缺氧导致H9C2细胞中LC3-II/LC3-I和p62水平升高,添加八味沉香散含药血清后该趋势被扭转,说明八味沉香散含药血清抑制了H9C2细胞中缺氧诱导的过度自噬。同时蛋白免疫印迹的结果也显示八味沉香散含药血清改善了缺氧诱导的H9C2细胞中p-AKT/AKT和p-PI3K/PI3K比率,提示八味沉香散可能通过增强PI3K-Ak信号通路抑制过度的线粒体自噬改善‘缺血’条件下心肌细胞的存活率。
综上所述,本研究应用网络药理学系统的探讨了八味沉香散经线粒体自噬途径抗心肌缺血的潜在成分、靶点和作用机制。通过分子对接技术验证发现关键活性物质和核心靶点均有较好的结合活性,其中槲皮素、山奈酚,柚皮素,去氢二异丁香酚更具结合优势,可能是其重要的药效物质基础。结合体外实验初步证明八味沉香散可能通过PI3K-AKT信号通路调控线粒体自噬改善心肌缺血。本文为藏药八味沉香散的进一步研究和应用提供了参考。
