丹参总酚酸联合anti-PD-L1调控髓源性巨噬细胞浸润抑制乳腺癌发生发展
2023-10-22宋梦瑶
宋梦瑶,钱 程,陆 茵,2
(1. 南京中医药大学药学院,江苏省中药药效与安全性评价重点实验室,2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023)
作为威胁全球女性生命健康的头号杀手,乳腺癌的治疗一直成为临床长久未解决的问题。免疫疗法的出现为癌症治疗带来了新的曙光,然而多年临床治疗结果显示,肿瘤在发展过程中会出现多种免疫逃避机制,某些癌症类型天生就比其他类型的癌症更善于“隐藏”。随着对肿瘤免疫监视的深入了解,部分类型癌症,如黑色素瘤、膀胱癌和肾细胞癌,已被证明对免疫治疗干预有持久的反应,然而,乳腺癌并未显示出相同的治疗效果。乳腺癌被认为是一种免疫沉默的肿瘤,原因来自于较弱的免疫识别能力和强烈的免疫抑制机制[1-2]。
免疫细胞具有重要的辅助功能,并影响乳腺癌患者的术后康复,高免疫浸润对乳腺癌的治疗与恢复表现出强烈的相关性,免疫细胞浸润程度可有效评估乳腺癌的预后与化疗效果[3]。乳腺癌自身低免疫原性、T细胞浸润低以及肿瘤微环境中免疫检查点的表达已被确定为乳腺癌逃避免疫治疗的潜在机制与挑战[4]。肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)和肿瘤浸润树突状细胞(tumor infiltrating dendritic cells,TIDCs)可以促进肿瘤生长和转移[5],而高CD8+T细胞浸润在三阴性乳腺癌(triple negative breast cancer,TNBC)患者中展现出更高的存活率[6]。因此,免疫疗法仍然是一种很有前途的乳腺癌治疗策略。
大量临床及临床前证据表明,乳腺癌处于免疫监视之下,免疫系统和乳腺癌之间复杂的相互作用研究仍处于起步阶段。基于免疫环境的复杂性,单一疗法可能并不能提供最有效的治疗方式,目前面临的挑战是不断寻找针对乳腺癌产生有效免疫反应的策略和方法。早期临床使用抗血管生成药、化疗等方式与免疫抑制剂联合治疗,近几年针对改变免疫微环境,如减少巨噬细胞瘤内趋化与恢复其杀伤、吞噬功能的治疗方式陆续出现,并进入临床[1]。因此,从改变巨噬细胞数量及功能入手,中医药中活血化瘀法也存在相似的功效。中药丹参及其各活性成分治疗乳腺癌的研究层出不穷,现代药理学研究发现丹参对乳腺癌有治疗作用[7]。丹参总酚酸(total salvianolic acid,TSA)如丹酚酸B、迷迭香酸、丹酚酸A等可有效抑制肿瘤生长与转移[8-10],然而其对免疫微环境的研究仍较为匮乏,本文通过构建恶性程度较高、免疫反应较低的E0771乳腺癌小鼠模型,考察TSA增强anti-PD-L1的作用方式,为临床合理使用TSA治疗癌症提供参考价值。
1 材料
1.1 细胞株鼠源乳腺癌细胞株E0771细胞由江苏省药效与安全评价重点实验室提供,并传代培养。
1.2 动物6周龄SPF级雌性C57BL/6 J小鼠25只,体质量(20±2) g,购买自上海斯莱克实验动物有限责任公司,实验动物生产许可证:SCXK(沪)2017-0005,实验过程中所有操作均符合实验动物伦理委员会规定,动物伦理号:202109A016。常规饲养:自由饮食饮水,温度(23±2) ℃,相对湿度53%±2%,12 h黑暗光照周期,适用性饲养1周。
1.3药物 丹参饮片购自江苏省中医院。
1.4 试剂DMEM培养基(Gibco,31800-022),FBS(Cellmax,SA301.02),一次性无菌注射器(上海米沙瓦医科,20180202),异氟烷(瑞沃德,R510-22-10),anti-PD-L1单抗(BioXCell,BE0101),IL-6酶联免疫试剂盒(Biolegend,431304),MCP-1酶联免疫试剂盒(Biolegend,432704),CD45-PerCP/Cyanine5.5(Biolegend,103132),CD11b-APC(Biolegend,101211),F4/80-PE/Cyanine7(Biolegend,123113),CD8-PE(Biolegend,100708),CD4-APC(Biolegend,100412),F4/80(proteintech,KHC0208),鼠兔通用二步免疫组化检测试剂盒(中杉金桥,PV-9000),DAB显色试剂盒(中杉金桥,ZLI-9018),Hiscript RT Super Mix for qPCR(Vazyme,R323-01),ChamQ SYBR qPCR Master Mix(Vazyme,Q331-02)。
1.5 仪器CO2培养箱(Thermo Fisher Scientific,Forma 3111),流式细胞仪(美国BD,FACSCalibur),酶标仪(美国Bio-tek,Synergy2),游标卡尺(斑马器材,Hc0494),分析天平(Sartorius,BSA224S-CW)。
2 方法
2.1 细胞培养E0771细胞使用10 % FBS+DMEM培养基,置于含5 % CO2,37 ℃恒温培养箱常规培养,平均1~2 d传代1次。
2.2 TSA的制备丹参采用唇形科鼠尾草属植物丹参SalviamiltiorrhizaBudge.的干燥根及根茎饮片。TSA制备过程如下:使用天平称取丹参饮片500 g置于圆底烧瓶内,加入1.5 L双蒸水,80 ℃加热提取2次,每次提取2 h。合并提取液纱布过滤,浓缩至清膏,放冷,加入乙醇至含醇量为70%,静置12 h,取上清,减压回收乙醇并浓缩至稠膏,冷冻干燥,称质量共得132.017 0 g冻干粉,计算得率为26.034%。
2.3 E0771肿瘤模型的建立取对数生长期E0771细胞制备成单细胞悬液密度为5×106个/mL。对20只小鼠异氟烷麻醉后,每只左侧腋下淋巴结附近注射0.1 mL细胞悬液。
2.4 分组与给药5 d后造模小鼠均长出手指可触的皮下肿瘤。将25只小鼠随机分为空白组、模型组、TSA组、anti-PD-L1组、TSA+anti-PD-L1组,每组5只。空白组、模型组小鼠每日给予双蒸水灌胃;TSA组小鼠每日灌胃给药10 g·kg-1TSA;anti-PD-L1组小鼠每3天腹腔注射给药10 mg·kg-1anti-PD-L1;TSA+anti-PD-L1联合组每日灌胃给药10 g·kg-1TSA,且每3天腹腔注射10 mg·kg-1anti-PD-L1,连续给药14 d。
2.5 肿瘤重量及体积测量小鼠最后一次给药结束后,分析天平称量并记录肿瘤质量。每4天使用游标卡尺测量小鼠肿瘤大小并记录。肿瘤体积计算公式:肿瘤体积=a×b2/2,“a”为最大宽度,“b”为最小宽度。
2.6 脏器指数计算分析天平称取记录小鼠脾脏、肝脏重量,根据公式对每只小鼠脏器指数进行计算。脏器指数=脏器(mg)/体质量(g)×100%。
2.7 ELISA检测血浆IL-6、MCP-1含量按照ELISA检测试剂盒说明进行操作如下:黏附96孔板每孔中加入100 μL稀释后的捕获抗体,4 ℃孵育过夜。8 h后弃掉板内溶液,每孔加入300 μL 洗涤液拍洗4遍,每孔加入200 μL检测稀释液,500 r·min-1室温振摇1 h。弃板内溶液,洗板×4。按照预先布板分别加入100 μL梯度稀释后的标品和血浆样品,振摇2 h。弃板内溶液,洗板×4,每孔加入100 μL检测抗体,500 r·min-1室温振摇1 h。弃板内溶液,洗板×4,每孔加入100 μL标记亲和素(horseradish peroxidase,HRP),室温振摇30 min。弃板内溶液,洗板×5,室温避光孵育15 min,每孔加入100 μL终止液,450 nm处检测吸光度。
2.8 流式细胞术取小鼠脾脏组织、肿瘤接种侧腋下淋巴(引流淋巴结)及肿瘤组织进行检测。脾脏、淋巴:使用1×PBS研磨过70目筛网,收集上述细胞悬液,4 ℃,1 500 r·min-1离心10 min,弃上清。每管加入2 mL红细胞裂解液,避光室温裂解5 min后离心,1×PBS洗涤,1 000 r·min-1离心5 min,弃上清,加入8 mL 1×PBS重悬,1 000 r·min-1离心5 min,弃上清,加入对应抗体,4 ℃避光孵育40 min,1 000 r·min-1离心5 min,100 μL 1×PBS重悬,上机检测。
肿瘤组织:取各组乳腺癌肿瘤组织1 cm3,剪碎后转移至15 mL EP管,加入5 mL肿瘤组织消化液进行消化,37 ℃摇床振摇40 min,每间隔10 min吹打一次。随后加入等体积预冷的完全培养基终止消化。过70目筛网后1 000 r·min-1离心5 min,弃上清,10 mL FACS-EDTA洗涤,1 000 r·min-1离心5 min,FACS-EDTA重悬,离心,加入对应抗体,4 ℃避光孵育40 min,离心5 min,100 μL 1×PBS重悬,上机检测。
2.9 免疫组化切取4 μm厚石蜡切片,75 ℃烤片5 h。二甲苯-无水乙醇-95 %乙醇-80 %乙醇-75 %乙醇-30 %乙醇依次复水,1×PBS洗涤3 min×3,抗原修复,洗涤,内源性过氧化物酶清除10 min,洗涤,3% BSA封闭1 h,洗涤,一抗4 ℃孵育过夜,洗涤,按照试剂盒说明,分别滴加试剂2、试剂3,洗涤,滴加DAB显色,流水冲洗5 min,苏木精染色2 min,盐酸分化20 s,流水冲洗5 min。30 %乙醇-50 %乙醇-75 %乙醇-80 %乙醇-95 %乙醇-无水乙醇-甲苯依次脱水,中性树脂封片固定,显微镜下拍照。
2.10 qPCR称取80 mg肿瘤组织加入研磨EP管,1 mL TRIzol裂解至组织消失。取匀浆每管加入200 μL氯仿,剧烈振摇15 s,室温静置3 min,12 000 r·min-1,4 ℃,离心15 min。吸取上层水相加入等量异丙醇,来回颠倒,室温静置3 min,12 000 r·min-1,4 ℃,离心15 min。弃上清,1 mL 75 %乙醇洗涤,7 500 r·min-1,4 ℃,离心10 min。弃上清,置于通风橱内干燥至透明。加入30 μL DEPC水溶解RNA,55 ℃孵育10 min。Nano DropTMOne /One C检测RNA浓度及纯度,将样本稀释为500 g·L-1。按试剂盒说明逆转成cDNA,引物由生工生物工程(上海)股份有限公司合成,引物序列见Tab 1,点板,上机。
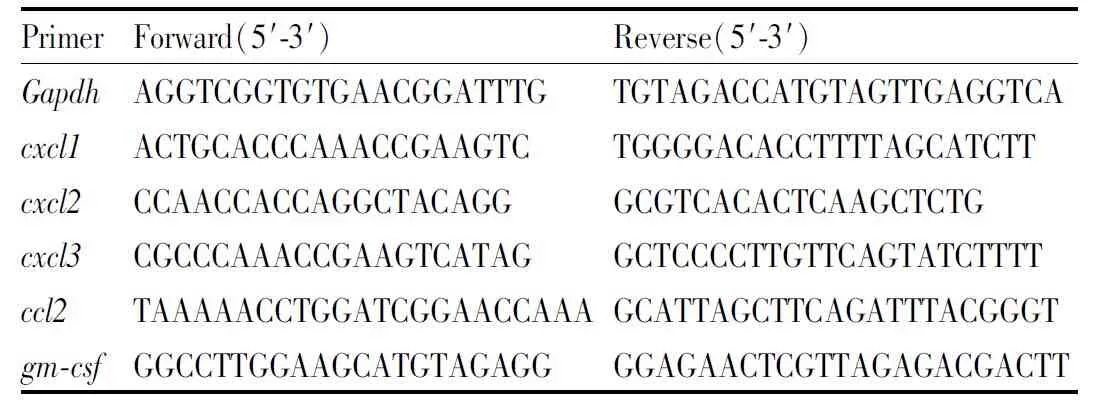
Tab 1 Primer sequence

3 结果
3.1 TSA联合anti-PD-L1显著降低乳腺癌小鼠肿瘤重量与模型组相比,TSA组、anti-PD-L1组、TSA+anti-PD-L1组小鼠乳腺癌肿瘤重量均明显下降(P<0.01)。与单独使用anti-PD-L1组相比,TSA+ anti-PD-L1组效果更佳显著(P<0.05),见Tab 2。

Tab 2 Effect of TSA+anti-PD-L1 on weight of E0771 subcutaneous tumor in each group (n=5)
3.2 TSA联合anti-PD-L1减缓小鼠肿瘤体积增长如Fig 1所示,接种E0771乳腺癌细胞后,肿瘤体积增长数据显示,与模型组相比,TSA组、anti-PD-L1组均可有效抑制肿瘤增长(P<0.01),而TSA+anti-PD-L1组抑制肿瘤生长进程更加显著,与单独使用anti-PD-L1相比,TSA+ anti-PD-L1组抑制肿瘤增长过程明显(P<0.05)。

Fig 1 The tumor volume growth in each group(n=5)
3.3 TSA联合anti-PD-L1对乳腺癌小鼠脾脏、肝脏脏器指数的影响与正常小鼠相比,模型组小鼠脾脏指数明显升高(P<0.01),病理表现为脾脏肿大。与模型组、anti-PD-L1组相比,TSA联合anti-PD-L1能有效降低小鼠脾脏指数(P<0.01),TSA组、anti-PD-L1组小鼠脾脏指数改变差异无显著性。同时,无论是模型组还是TSA组、anti-PD-L1组,小鼠肝脏指数均未见影响,见Tab 3。

Tab 3 Spleen and liver organ index of mice in each group (n=5)
3.4 TSA联合anti-PD-L1减少小鼠血清IL-6,MCP-1分泌与空白组相比,模型组小鼠血清内IL-6,MCP-1分泌含量明显增加(P<0.01)。与模型组相比,TSA组、anti-PD-L1组及TSA+anti-PD-L1组给药后可明显减少小鼠血清内IL-6,MCP-1含量(P<0.01),且TSA+anti-PD-L1组较anti-PD-L1组效果显著(P<0.05),见Tab 4。

Tab 4 Effect of TSA+anti-PD-L1 on IL-6, MCP-1 secretion in serum in each group (n=5)
3.5 TSA联合anti-PD-L1减少小鼠肿瘤组织内巨噬细胞相关趋化因子mRNA表达与模型组相比,TSA组、anti-PD-L1组及TSA+anti-PD-L1组均可降低小鼠肿瘤组织内与巨噬细胞趋化相关因子cxcl1,cxcl2,cxcl3,ccl2,gm-csfmRNA的表达,且TSA与anti-PD-L1联合给药较anti-PD-L1单独给药相比cxcl2,cxcl3,ccl2表达水平下降显著,见Fig 2。
3.6 TSA联合anti-PD-L1对小鼠淋巴及脾脏内CD4+,CD8+T细胞数量的影响通过流式检测各组小鼠淋巴及脾脏内CD4+T细胞、CD8+T细胞数量,如Fig 3所示,模型组小鼠淋巴内CD4+T细胞、CD8+T细胞数量与空白对照组相比未见显著差异,而TSA联合anti-PD-L1可增加CD4+T(P<0.01)与CD8+T细胞(P<0.05)在淋巴内的数量。TSA与anti-PD-L1联合给药较anti-PD-L1单独给药相比效果更佳明显(P<0.05)。在脾脏流式检测结果中,与空白组相比,模型组小鼠CD4+T细胞数量明显降低(P<0.01),TSA+anti-PD-L1联合使用有效恢复小鼠脾脏内CD4+T细胞数量(P<0.05),同时使小鼠CD8+T细胞增加(P<0.05)。
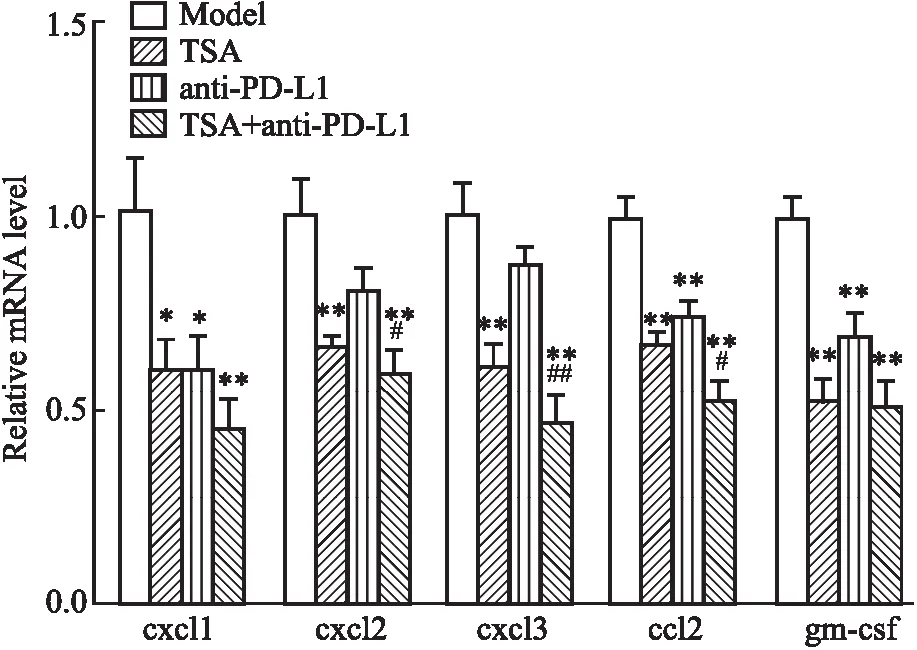
Fig 2 Expression of cxcl1, cxcl2, cxcl3, ccl2, gm-csf in each group by qPCR (n=4)
3.7 TSA联合anti-PD-L1抑制乳腺癌小鼠肿瘤、淋巴内巨噬细胞浸润如Fig 4所示,流式结果显示TSA、anti-PD-L1、TSA+anti-PD-L1联合给药组均可一定程度上降低肿瘤组织内髓源性巨噬细胞(CD11b+F4/80+)的浸润,其中与模型组(P<0.01)、anti-PD-L1组(P<0.05)相比,TSA与anti-PD-L1联合给药后抑制小鼠髓源性巨噬细胞浸润效果显著,免疫组化显示相似的结果(Fig 5)。同时,对小鼠淋巴内髓源性巨噬细胞浸润情况进行统计分析,结果显示TSA可减少淋巴内髓源性巨噬细胞数量(P<0.05),TSA+anti-PD-L1联合组小鼠淋巴内髓源性巨噬细胞数量显著降低(P<0.01),见Fig 6。
4 讨论
乳腺癌免疫疗法面临的最大障碍是如何将非免疫原性肿瘤转化为高免疫原性肿瘤,进而产生临床治疗反应[11]。肿瘤特异性T细胞上表达抑制性受体,例如PD-1和CTLA-4,会抑制其增殖及杀伤性细胞因子的分泌功能。使用靶向CTLA-4(ipilimumab)和PD-1/PD-L1(nivolumab/pembrolizumab)的单克隆抗体进行免疫检查点阻断已被证明可有效治疗多种恶性肿瘤。其中,抗PD-1/PD-L1抗体在黑色素瘤、肾细胞癌、非小细胞肺癌和其他肿瘤的治疗中显示出巨大前景[12-13]。临床单独使用PD-1/PD-L1抗体在治疗乳腺癌疗效不显著的情况下,单抗与各类治疗方式如抗血管生成药、化疗联合使用展现出一定的作用[12-13]。本研究通过构建C57BL/6J小鼠E0771乳腺癌皮下瘤模型,发现TSA与anti-PD-L1联合使用后肿瘤体积增长趋势显著减缓,同模型组相比,有效抑制E0771乳腺癌小鼠肿瘤发展进程,同时缓解了小鼠脾脏肿大现象。

Fig 3 Number of CD4+ T cells and CD8+ T cells in lymph and spleen in each group by flow cytometry (n=4)
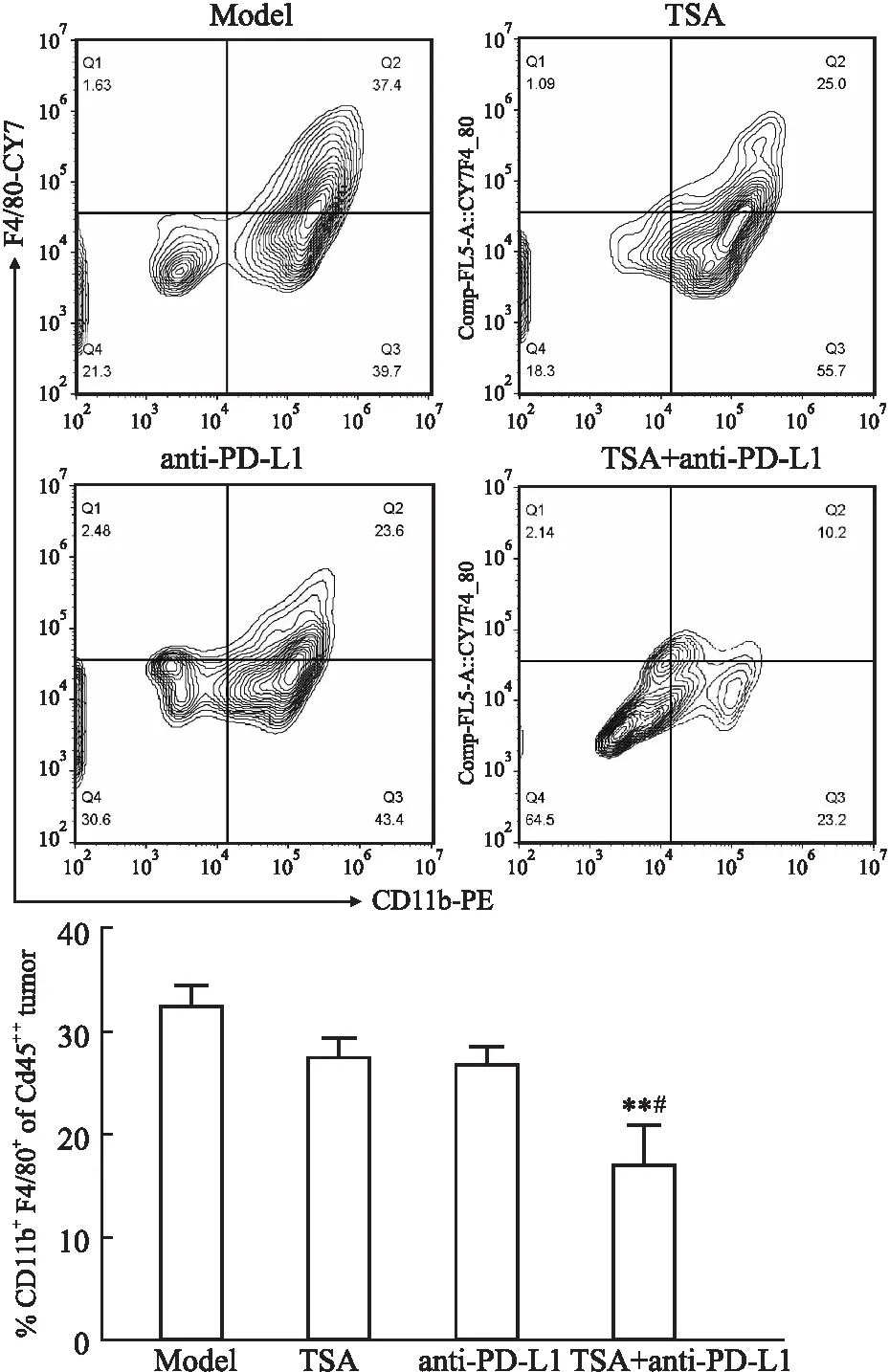
Fig 4 Infiltration of myeloid macrophage in tumor of mice in each group by flow cytometry (n=4)

Fig 5 The positive expression of F4/80 in each group by IHC (×200) (n=5)
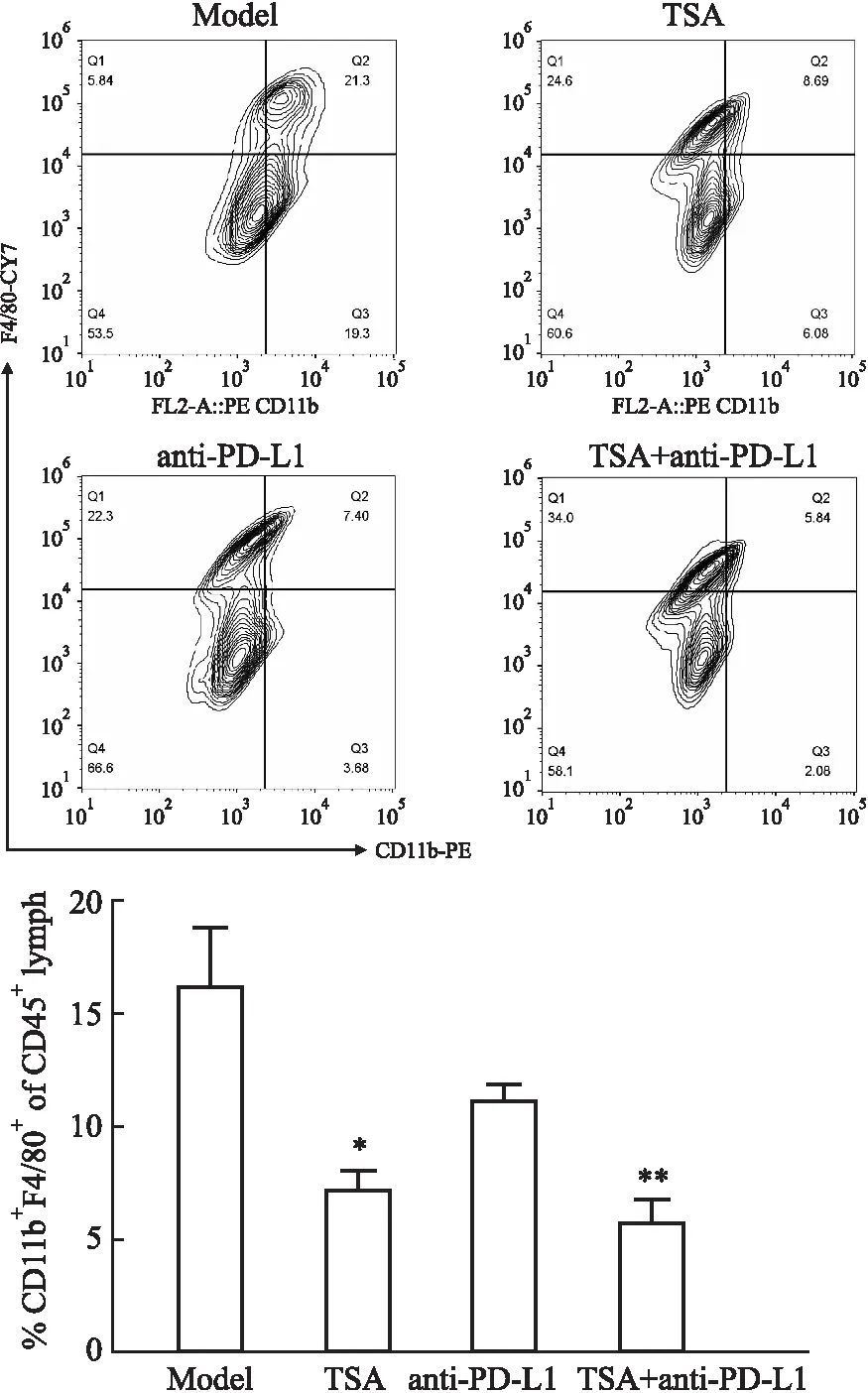
Fig 6 Infiltration of myeloid macrophage in lymph of mice in each group by flow cytometry (n=3)
进一步考察TSA联合anti-PD-L1的具体作用方式,ELISA结果显示TSA与anti-PD-L1联合使用后,IL-6、MCP-1炎性细胞因子分泌减少,提示炎性环境的改变及其潜在机制有待探索。肿瘤微环境中细胞因子的改变与免疫细胞的极化状态、瘤内募集和免疫排斥反应相关[14]。qPCR结果显示,TSA与anti-PD-L1联合使用可显著降低cxcl1,cxcl2,cxcl3,ccl2,gm-csfmRNA的表达,这些炎性因子与巨噬细胞趋化呈高度相关。肿瘤来源的IL-10和巨噬细胞集落刺激因子被证明通过抑制树突状细胞成熟而损害其抗原呈递能力,导致其功能障碍[15]。骨髓亚群包括TAMs、单核细胞和粒细胞,构成了免疫微环境的异质成分,具有很强的免疫抑制潜力。研究表明,骨髓抑制细胞产生的瘤内活性物质能够诱导CCL2趋化因子硝化并阻碍T细胞迁移和浸润[16]。本文研究中,TSA与anti-PD-L1联合使用促使脾脏和淋巴内CD4+T细胞、CD8+T细胞数量增多。基于此,TSA通过调控免疫微环境的改变发挥治疗作用也是中医药治疗疾病整体观念的体现。同时,TSA降低肿瘤免疫微环境炎症因子的释放,减少髓源性巨噬细胞在乳腺癌中的数量,淋巴内髓源性巨噬细胞数目同样降低。研究表明,除肿瘤细胞外,在肿瘤微环境内巨噬细胞和髓源性抑制细胞上PD-L1的表达,即宿主自身的免疫原性才是PD-1/PD-L1免疫治疗发挥作用的关键[17]。因此,TSA与anti-PD-L1联合使用后,可有效抑制瘤内髓源性巨噬细胞的数量和PD-L1介导的免疫逃逸作用。针对部分临床患者对于anti-PD-L1反应不敏感问题,除与传统化疗、抗血管疗法联合使用外,以TAMs趋化及功能恢复为目标的治疗方式逐渐成为联合anti-PD-L1治疗的新思路。活血化瘀药在中医药治疗癌症时维持较高使用频率,然而,研究发现,活血化瘀疗法对癌症的治疗并不在于其极高的杀伤活性,而是通过作用于肿瘤内部环境,如促使血管正常化、抑制血栓形成、改变免疫细胞浸润等方式。本研究通过实验证明,TSA可通过改变肿瘤免疫微环境,联合anti-PD-L1对E0771乳腺癌进行治疗,为临床应用丹参治疗癌症提供部分科学依据。
综上,本研究表明,TSA与anti-PD-L1联合使用可有效减缓E0771乳腺癌小鼠的肿瘤生长进程,减少IL-6,MCP-1炎性因子的释放,巨噬细胞趋化相关因子cxcl1,cxcl2,cxcl3,ccl2,gm-csf的表达,进而抑制髓源性巨噬细胞向肿瘤组织浸润,通过增加脾脏、淋巴结内CD4+T细胞,CD8+T细胞数量恢复小鼠免疫微环境。针对肿瘤免疫微环境的治疗方式的提出,为中医药治疗乳腺癌提供了潜在的可能性。
