地骨皮甲素调节IL-33/ST2信号对中耳炎大鼠的研究
2023-10-22张晓东
廖 军,蔡 沁,张晓东
(1.福建医科大学附属泉州市第一医院,福建 泉州 362000;2.福建医科大学,福建 福州 362002)
中耳炎是耳鼻喉科常见疾病,其虽然不会危及生命,但却是导致患者听力障碍的主要原因,且病情往往反复发作,严重影响着患者的生活质量[1]。近年来研究发现,免疫因素与其密切相关,免疫反应紊乱导致的免疫功能障碍是该病发生、发展的关键因素,因此如何改善免疫反应紊乱,提高免疫功能是目前临床工作的重点及焦点[2-3]。白介素-33(interleukin,IL-33)是一种多效性的细胞因子,其可通过与其特异性受体瘤变抑制因子2(suppression of tumorigenictiy 2,ST2)相结合来活化或极化多种类型的免疫细胞,从而参与免疫炎症反应的调控,进而发挥抗炎或促炎的作用,由此可推测IL-33/ST2信号在中耳炎免疫调节中将发挥不可忽视的作用[4]。近年来研究发现,中耳黏膜液体失衡是中耳炎发生、发展的重要环节,而上皮钠通道(epithelial sodium channel,ENaC)作为调控离水和离子的转运的重要途径在其中发挥着重要作用,因此,如何调控钠通道是近年来医学领域关注的热点之一[5]。地骨皮是枸杞的干燥根皮,是我国传统中药材,据今已有近两千年的药用历史,而地骨皮甲素是其有效药用成分,具有抗菌、消炎、降压、降糖、抗病毒以及免疫调节等多种功效,故地骨皮甲素治疗中耳炎将具有广阔的发展前景[6]。但IL-33/ST2信号通路是否参与了钠通道的调节目前尚无研究,因此,本文就地骨皮甲素调节IL-33/ST2信号对中耳炎大鼠免疫功能及钠通道进行研究探讨,为临床上治疗提供参考。
1 材料与方法
1.1 动物材料本实验选取上海凯学生物科技有限公司提供的60只SPF级SD雄性大鼠(合格证书为:SCXK(沪)2020-0005),平均体质量(180~250)g,饲养条件为(20~25)℃恒温,50%±5%恒湿,模仿昼夜交替,昼夜各12 h,无菌饮食2周,本次实验于福建医科大学动物实验中心完成,按照《实验动物管理条例》规定进行实验。
1.2 实验材料地骨皮甲素(货号:PB270,北京普非有限公司);IL-33/ST2信号抑制剂anti-ST2(货号:ab25877-ST2,上海恒斐有限公司);3型肺炎链球菌(货号:A0680,上海酶研有限公司);诱发电位仪(型号:7S-12型,日本三荣公司);苏木精染液(货号:H9627,美国Sigma公司);伊红染液(货号:AG1100-100 mL,上海吉至有限公司);光学显微镜(型号:CX-60,日本OLYMPUS公司);酶联免疫吸附测定(ELISA)试剂盒(货号:446502,美国R&D公司);全波长酶标仪(型号:Multiskan Sky,上海辅泽有限公司);荧光实时定量PCR仪(型号:CFX96,上海土森视觉有限公司);PowerPacTM基础电泳仪(型号:164-5051,美国 Bio-Rad公司);实时Real-Time PCR 试剂盒(货号:7000,美国ABI公司);TRIzol试剂(货号:Invitrogen,上海文韧有限公司);cDNA第一链合成试剂盒(货号:XY-TE-0738,上海烜雅有限公司);SDS-PAGE凝胶电泳试剂盒(货号:KGP113,江苏凯基有限公司);蛋白质裂解液(货号:SY0320-NWS,北京百奥莱博有限公司);SDS-PAWE凝胶电泳试剂(货号:CDLG-4942,武汉纯度有限公司);IL-33抗体(货号:70005-T16,北京义翘神州股份有限公司);ST2抗体(货号:253486,深圳豪地华拓有限公司);GAPDH抗体(货号:PL0403130,深圳豪地华拓有限公司);ECL检测试剂盒(货号:KFS09,北京百奥莱博有限公司)。
1.3 建模选取50只SPF级SD雄性大鼠,腹腔注射40 mg·kg-1戊巴比妥钠麻醉大鼠,固定后,进行常规备皮、消毒,然后暴露出两侧听泡,在其表面相邻2 mm处穿刺2个小孔以进入中耳腔,从其中一个孔注射50 μL 1×1011CFU·L-1的Ⅲ型肺炎链球菌悬液,另一个孔用于注射过程中排气,注射完成后用骨蜡封闭穿刺孔,逐层缝合伤口,同时给大鼠注射4万U的青霉素钠以预防感染,每天1次,注射3 d,待苏醒后将大鼠放回笼内常规饲养,2周后,耳镜观察到鼓膜充血,鼓室混浊,部分可见液平面及中耳内气泡形成,则视为造模成功,大鼠建模过程中因感染或意外死亡3只,其余均建模成功。
1.4 分组及给药从建模成功的大鼠中随机选取40只,将其分为模型(MO)组,地骨皮甲素(OS)组,IL-33/ST2信号抑制剂(ST)组,地骨皮甲素+IL-33/ST2信号抑制剂(UN)组,每组10只,同时选取剩余10只正常大鼠作为正常对照(NO)组,对OS组灌胃40 mg·kg-1的地骨皮甲素[15],对ST组灌胃0.2 mL 1 kg·L-1的anti-ST2,对UN组灌胃40 mg·kg-1的地骨皮甲素和0.2 mL 1 kg·L-1的anti-ST2,两组均1 d一次,持续14 d,NO组、MO组同期给予灌胃同体积生理盐水。
1.5 听性脑干反应检测听力水平实验结束后,应用诱发电位仪对各组大鼠进行听性脑干反应(auditory brainstem responses,ABR)阈值检测,将大鼠置于隔音室中,记录电极(蓝色)放置于额部皮下,参考电极(黑色)放置于同侧耳后皮下,接地电极(红色)放置于对侧耳后皮下,屏蔽耳机置 于外耳道口,然后耳机给声,ABR刺激声是短声,以click声作为诱发音源,脉冲宽度0.1 ms,刺激重复率20 Hz,叠加1 000次,从110 dB SPL开始,逐次减低10 dB SPL,以波Ⅲ刚出现时的声音强度做为听觉反应阈值,记录短声click及8、16、32 kHz纯音听力阈值。
1.6 标本采集听力测试完成后,腹腔注射40 mg·kg-1戊巴比妥钠麻醉处死大鼠,取听泡钻孔,用PBS灌洗中耳腔3次,收集灌洗液,在4 000 r·min-1条件下离心10 min,取上清液,置于冰箱密封保存,同时取主动脉血,离心后取上清液置于冰箱密封保存,并取中耳黏膜组织,10%福尔马林中固定48 h后,置于冰箱密封保存。
1.7 HE法检测大鼠中耳黏膜病理形态取各组大鼠中耳黏膜组织,常规脱水、透明、石蜡包埋、切片、烤片、二甲苯脱蜡、梯度乙醇复水后,蒸馏水洗涤2次,用苏木精染色2 min,自来水冲洗后,用1% 盐酸乙醇分化30 s,自来水冲洗,伊红染色2 min,自来水冲洗后,切片在无水乙醇内来回摇荡数秒,重复1次,待风干后,进行脱水、透明、中性树胶封片处理,用光学显微镜进行组织病理学观察。
1.8 酶联免疫吸附(ELISA)法检测大鼠免疫功能取各组大鼠耳泡灌洗液及血清,严格按照ELISA 试剂盒说明检测Th1细胞因子干扰素-γ(interferon,INF-γ)、Th2细胞因子白细胞介素-4(interleukin,IL-4),依次进行绘制样本布局表、配置试剂标准品、清洗孔板、加样、覆膜、洗版、加显色剂终止液处理,实验完成后立即用酶标仪在450 nm波长处,测定每孔吸光度A,绘制标准曲线,然后通过标准曲线,计算INF-γ、IL-4的含量。
1.9 Real-time PCR法检测ENaC mRNA相对表达取各组大鼠中耳黏膜组织,用TRIzol试剂提取总RNA,用cDNA 第一链合成试剂盒进行反转录合成cDNA,然后利用荧光实时定量PCR仪测定α-ENaC、β-ENaC、γ-ENaC基因转录差异,反应条件为,95 ℃预变性3 min,94 ℃ 20 s、59℃ 20 s、72 ℃ 30 s循环进行40次,72 ℃延伸5 min,在82.5 ℃检测荧光强度并收集α-ENaC、β-ENaC、γ-ENaC荧光信号,反应结束后进行数据分析,以同一样本中的GAPDH的Ct值作为内参,采用 2-ΔΔCt计算其基因相对表达量,引物序列见Tab 1。
1.10 免疫印迹法检测IL-33/ST2信号相关蛋白表达取各组中耳黏膜组织,清洗、剪碎后置于离心管中,加入蛋白质裂解液后研磨成匀浆,冰上振荡30 min,在4 ℃、13 000 r·min-1的条件下离心15 min,取上清液用BCA法测定蛋白浓度,处理好待测样品后,用SDS-PAWE 凝胶电泳试剂盒进行电泳分离,电泳完成后在冰浴下进行转膜1.5 h,封闭1 h,按说明书用封闭液稀释一抗(1 ∶1 000),加入稀释的IL-33、ST2一抗,4 ℃摇床振荡1 h,PBS洗涤3次,加入稀释的二抗(1 ∶5 000),37 ℃轻摇室温孵育2 h;PBS洗涤3次,显色液显影,用ECL荧光试剂盒测定结果,利用凝胶成像仪成像后,进行灰度值检测,以同一样本中的GAPDH作为内参,计算比值求得IL-33、ST2蛋白的相对表达含量。

Tab 1 α-ENaC, β-ENaC, γ-ENaC primer sequence

2 结果
2.1 各组大鼠听力水平结果与NO组相比,MO组大鼠click及8、16、32 kHz纯音听力阈值显著升高(P<0.05),与MO组比较,OS组、ST组、UN组大鼠click及8、16、32 kHz纯音听力阈值显著降低(P<0.05),且ST组与 OS组相比无明显差异(P>0.05),UN组比ST组降低明显(P<0.05),见Fig 1。
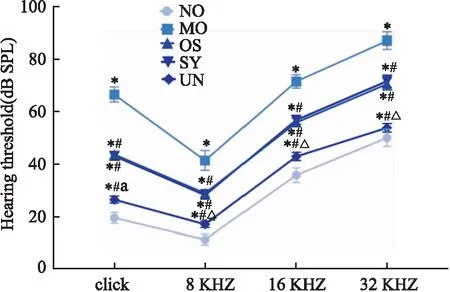
Fig 1 Hearing level of rats in each
2.2 各组大鼠中耳黏膜HE结果NO组大鼠中耳黏膜组织正常,黏膜、血管呈暗红色,且未见明显炎性细胞浸润,MO组中耳黏膜细胞出现明显肿胀,且有多处细胞脱落,黏膜明显增厚,可见大量炎性细胞浸润及纤维组织增生,与MO组相比,OS组、ST组、UN组病理症状明显改善,黏膜肿胀程度明显好转,炎性细胞浸润数量明显减少,见Fig 2。
2.3 各组大鼠免疫功能结果与NO组相比,MO大鼠耳泡灌洗液及血清中INF-γ含量明显降低(P<0.05),IL-4含量明显升高(P<0.05),与MO组比较,OS组、ST组、UN组耳泡灌洗液及血清中INF-γ含量明显升高(P<0.05),IL-4含量明显降低(P<0.05),且ST组与OS组相比无明显差异(P>0.05),UN组比ST组变化明显(P<0.05),见Tab 2。
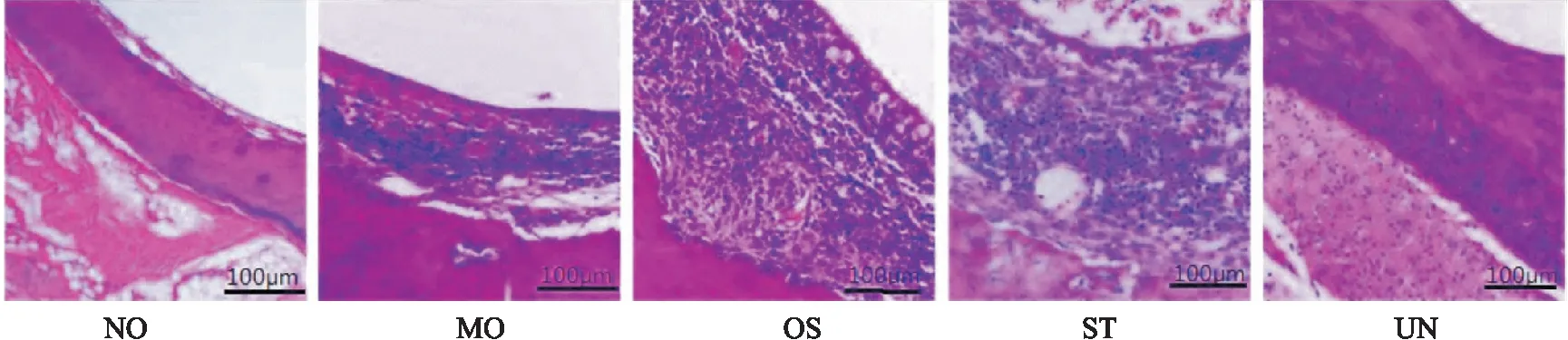
Fig 2 Pathological morphology of middle ear mucosa of rats in each group (HE×100)

Tab 2 Levels of immune function related indexes of rats in each
2.4 各组大鼠中耳黏膜组织ENaC mRNA相对表达结果与NO组相比,MO组大鼠中耳黏膜组织中α-ENaC、β-ENaC、γ-ENaC mRNA表达显著降低(P<0.05),与MO组比较,OS组、ST组、UN组中耳黏膜组织中α-ENaC、β-ENaC、γ-ENaC mRNA表达显著升高(P<0.05),且ST组与 OS组相比无明显差异(P>0.05),UN组比ST组升高明显(P<0.05),见Tab 3。
Tab 3 Middle ear mucosa of rats in each group α- ENaC, β- ENaC, γ- ENaC mRNA
2.5 各组大鼠中耳黏膜组织中IL-33/ST2信号相关蛋白表达结果与NO组相比,MO组大鼠中耳黏膜组织中IL-33、ST2蛋白表达明显升高(P<0.05),与MO组比较,OS组、ST组、UN组大鼠中耳黏膜组织中IL-33、ST2蛋白表达明显降低(P<0.05),且ST组与OS组相比无明显差异(P>0.05),UN组比ST组降低明显(P<0.05),见Fig 3,4。
3 讨论
研究发现,肺炎链球菌是中耳炎发生、发展过程中的最常见致病菌,可占60%左右,因此本文选择其作为致病菌建立中耳炎大鼠模型[7-8]。中医理论中,中耳炎属于“耳闭”、耳胀等范畴,其病机主要为正气不足、风邪外袭、内蕴湿热,以致痞塞耳窍、湿浊困耳、耳窍失养、清窍失聪等,因此健脾益气、补肺益肾、去湿化浊、清气通窍是关键所在[9-10]。地骨皮是一种常用的中药材,其味甘、性寒,归肝、肺、肾经,具有清肺降火、凉血除蒸之功效,而地骨皮甲素是从其中分离出的一种生物碱类物质,不仅具有地骨皮的作用,还兼之抗炎、抗氧化应激、免疫调节、保护神经、抗肿瘤等多种功效[11]。本文研究发现,地骨皮甲素具有显著疗效,其可显著提高中耳炎大鼠听力水平,改善病理损伤。对于中耳炎大鼠,地骨皮甲素主要是通过抗炎及免疫调节等作用,来抑制机体免疫炎症反应的发生,从而抑制炎症因子、黏附性因子的表达及分泌、抑制氧化应激的产生等,进而达到改善中耳黏膜病理形态的目的,最终有效提高大鼠听力水平。卡迪丽娅·木拉提等[12]研究发现,对于分泌性中耳炎大鼠,地骨皮甲素具有显著疗效,可有效改善大鼠中耳组织病理形态,提高INF-γ含量,降低IL-4含量,这与本文结果类似。
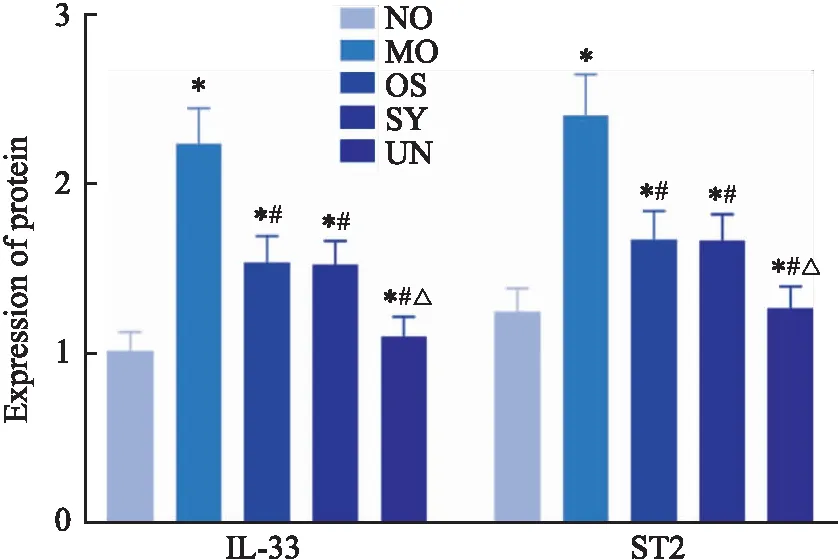
Fig 3 Expression of IL-33 and ST2 protein in middle ear mucosaof rats in each
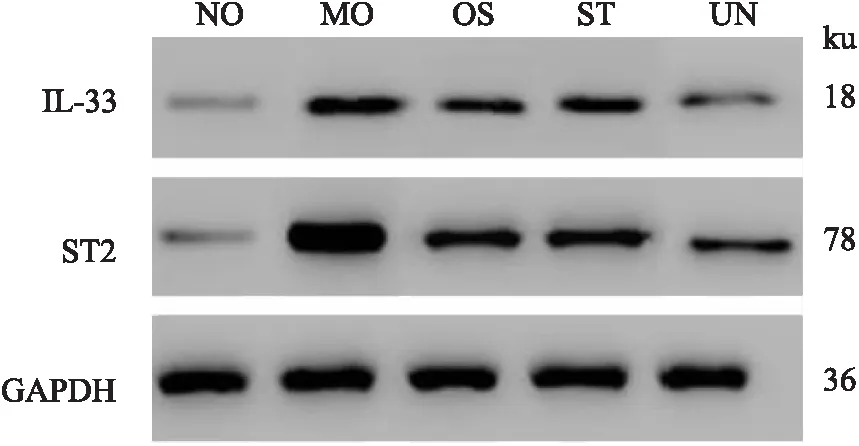
Fig 4 Electrophoresis of IL-33 and ST2 protein expressionin middle ear mucosa of rats in each group
Th1/Th2细胞因子分泌失调是多种免疫炎症疾病的发病基础,中耳炎也是如此,INF-γ是Th1细胞分泌的标志因子,IL-4是Th2细胞分泌的标志因子,因此检测INF-γ、IL-4可有效反映Th1/Th2失衡情况。研究发现,中耳黏膜与呼吸道黏膜具有同源性,既中耳黏膜表面同样覆盖着气道表面液体,维持着中耳腔的液体平衡,从而确保其保持相对干燥状态,进而保证声波从鼓膜正常的传导至内耳,而ENaC作为介导液体吸收的主要通道,在其中发挥着不可或缺的作用,因此越来越受到临床工作者的重视[13]。本文研究表明,地骨皮甲素可显著提高INF-γ含量,降低IL-4含量,并促进α-ENaC、β-ENaC、γ-ENaC mRNA表达,这说明其可有效改善大鼠免疫功能,促进钠通道表达。对于中耳炎大鼠,地骨皮甲素可能是通过调控相关信号通路的表达,来调节免疫炎症反应,从而抑制炎症介质的合成及释放、减少对肥大细胞、嗜酸性粒细胞刺激等,进而有效调节细胞分泌细胞因子,纠正Thl/Th2细胞免疫失衡,并改善机体液体平衡,加快耳泡中积液的清除,最终达到提高免疫功能,促进钠通道表达的目的。钟伦坤等[14]研究发现,分泌性中耳炎大鼠INF-γ含量明显降低,IL-4含量明显升高,给予治疗后,INF-γ含量明显升高,IL-4含量明显降低,这与本文结果类似。
而近年来研究发现,IL-33与ST2结合后可诱导大量Th2细胞向炎症部位转移,促使其分泌大量炎症因子,从而引起以Th2细胞为主的一系列免疫炎症反应,因此,可推测IL-33/ST2信号与中耳炎进展密切相关,可能是导致其迁延不愈的重要因素[15]。本文研究发现,与MO组比较,OS组、ST组、UN组大鼠中耳黏膜组织中IL-33、ST2蛋白表达显著降低,且ST组与 OS组相比无明显差异,UN组比ST组降低明显,这说明地骨皮甲素可有效抑制IL-33/ST2信号,其作用与IL-33/ST2信号抑制剂相同,且与IL-33/ST2信号抑制剂联合后效果更佳,故可推测地骨皮甲素可通过IL-33/ST2信号发挥作用。而对于中耳炎大鼠,地骨皮甲素可能是通过调控上游相关信号通路,来抑制IL-33的合成及分泌,从而抑制与ST2的结合,达到抑制IL-33/ST2信号激活的目的,进而抑制免疫炎症的发生、抑制Th2细胞的迁移等,最终有效改善大鼠临床症状。顾潇怡等[16]研究发现,IL-33在分泌性中耳炎中表达异常升高,从而使Th1/Th2信号传导系统失衡,进而促进中耳炎进程,这与本文结果类似。
综上所述,地骨皮甲素具有显著疗效,可显著改善中耳炎大鼠免疫功能,促进钠通道表达,其作用机制可能与抑制IL-33/ST2信号有关。但本文还存在一定不足,如未进行多样本、多中心研究,未设置多剂量组,未进行细胞实验等,在以后的实验中会继续深入研究,以期为临床提供更多、更可靠的数据支持。
